ここで核酸医薬のメリットを少し話すことにします。疾病の原因となるタンパク質に作用し、その機能を阻害する低分子医薬品や抗体医薬と異なり、核酸医薬は疾病の原因となる遺伝子発現を制御しており、従来の医薬品と異なり遺伝子選択性が高く、標的に直接作用します。そのため今まで開発が困難とされた難病の治療にも期待されており、更に薬物の副作用も軽減されると考えられます。
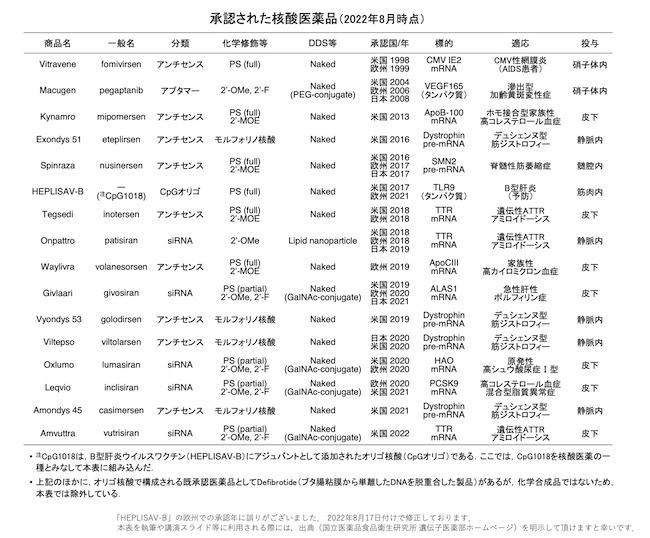
現在承認されている核酸医薬は、国立医薬品食品衛生研究所遺伝子医薬部のホームページで確認すると2022年8月時点では以下のようになっています。
これを見ると承認された核酸医薬品で一番多いのはアンチセンスで、次にsiRNAになります。そこで、初めにアンチセンスについて詳細を説明することにします。
アンチセンスは日常的に体内で行われている、DNAからmRNAができ、更にタンパク質が出来る遺伝子情報が伝達される流れの中で、途中の遺伝子レベルの機能であるDNAやmRNAに結合することで、疾病に関与するタンパク質の合成プロセスを阻害します。疾病の原因となるmRNAやDNAの塩基配列がわかっているとその部分を標的として、それに相補助な配列を有する短い核酸(アンチセンスRNA)を合成し、体内に投与することで、細胞内の疾病に関与する標的mRNAやDNAの標的位置にアンチセンスRNAがバインドすることで二重鎖を形成し、疾病に関与するタンパク質の生成を制御する方法です。特定の病原ウィルスの遺伝子やガン等の様に異常な遺伝子の働きで疾病を引き起こす場合は、遺伝子レベルで病気の治療にはアンチセンスRNA有効であると考えられます。
しかし、アンチセンス核酸の配列の選択をどのようにするかが問題です。普通mRNAは数百から数千塩基長とアンチセンス核酸に比べて非常に長く、mRNAのどの領域を標的にするかについての検討が必要です。一般にmRNAは一本鎖で存在することは少なく、配列中の相補的な領域同士で塩基対を形成し、多様な高次構造を形成していると考えられます。そのため、アンチセンス核酸の標的の位置によっては効果が大きく変わってしまうため、mRNAの二次構造を事前に予測して、適切な領域を選定しることが高活性なアンチセンス核酸を得るためには重要になってきます。
更に、アンチセンス核酸に天然のDNAやmRNAそのものを医薬品にするのは、体内でヌクレアーゼにより分解されるため、体内安定性が悪くなります。そこでヌクレアーゼに対する耐性獲得のために、核酸の部分をOMe化やホスホロチオエート結合を加えるなどの化学修飾をして、体内安定性を維持することが必要です。
アンチセンス医薬品のみならず核酸医薬全般に言えますが、標的とする遺伝子に到達・結合する確実性と、当該物質の安定性はまだまだ課題であり、それらを向上させる研究が続けられています。
話は逸れますが、前回の核酸医薬のところで、mRNAワクチンの基礎技術のキャップ構造を発見した古市泰宏博士が10月8日にお亡くなりになりました。私は同じ製薬企業のロシュにおり個人的にも親しく、コロナ禍前は一緒に年1回飲み会を開いていました。最近はメールでのやり取りが多かったのですが、3月のメールが最後でした。寂しい限りです。古市泰宏博士のご冥福をお祈りいたします。