2015年のノーベル生理学・医学賞は皆さんにとってサプライズでしたか。 私はこういう評価も当然ありと考えます。前評判が高いトレンディな研究よりも、地道に長年かけて積み上げた研究成果は、いずれはいろいろな意味で芽を吹き始め、科学にとって大きな財産でもあります。 大村智先生とはじめてお会いしたのは1995年の秋だったと記憶しています。
そのころ私は、細胞死(アポトーシス)の研究を開始して間もない時期でした。 神経突起誘導因子として大村先生が発見されたラクタシスチン[参考文献1, 2]が細胞死とどのような関係にあるかを調べたく、北里大学のラボへ伺ったわけです。ラクタシスチンはその少し前に、細胞内たんぱく質分解酵素のひとつであるプロテアソームに特異的に作用する阻害剤であるとの報告[参考文献4]があり、プロテアーゼを研究してきた私にとっては興味深い物質でした。 そして、白血球由来のがん細胞が分化する過程でラクタシスチンがアポトーシスを惹起することを速誌に発表できたのが同年の12月でした。[参考文 献3]
ラクタシスチンは、プロテアソームの触媒サブユニットのひとつに結合してたんぱく質分解活性を阻害することがわかっていました。
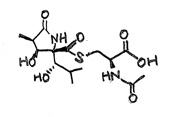
そして結合する場所は、N 末端近くのトレオニン残基の OH であることも判明していました[参考文献4]。 そこで私は、このサブユニットの N末端付近を化学合成し、ラクタシスチンを結合させて免疫原にすれば抗体を作成できると考え、大村先生に再度提案しました。 先生は抗ラクタシスチン抗体作成の計画を快く了承してくださり、ラクタシスチンをたくさんくださりました。
ところが、何回トライしてみても入らないのです。ペプチドにラクタシスチンが結合しなのです。そうこうするうちに、ラクタシスチンの作用機序が改めて調べられ、代謝された後でプロテアソームに結合することが明らかになりました[参考文献5]。 そういうわけで、この研究計画は頓挫したままですが、しっかりした構造解析が前提にあれば阻害剤に対する抗体をつくることは可能です。 昨今、病気の原因となるターゲット分子の解析が進められ、原因分子に結合する阻害剤が薬として開発されています。
しかし、この「結合」はほんとうに特異的なのでしょうか。 阻害剤が他のたんぱく質等にも結合すれば、薬による病態、すなわち副作用が出てくるはずです。 新しい薬の開発と並行しておこなうべきは、副作用の動態解析と考えます。たんぱく質に強固に結合する阻害剤は、この種の抗体を得れば通常のイムノブロット解析などで調べることができます。 阻害剤に対する抗体で副作用研究全体をカバーできるわけではありませんが、創薬開発な地味な部分として重要性を感じる次第です。
参考文献
- Omura 1991 J Antibiot 44 113-116 [PubMed]
- Omura 1991 J Antibiot 44 117-118 [PubMed]
- Imajoh-Ohmi 1995Biocem Biophys Res Commun 217 1070-1077 [PubMed]
- Fenteany 1995 Sience 268 726-731 [PubMed]
- Dick 1996 J Biol Chem 271 7273-7276 [PubMed]