私がまだ在職中、遠心機メーカーで技術を担当されていたかたが来られて、退職してロボットを受託して作る仕事をはじめたとのこと、そのときは漠然と「個別作業に特化した自動装置なんだ。それは良いな」と思ったものですが、いま改めて考えると、スモールビジネスとしては素晴らしいことと感心します。いまはどうされているでしょうか。バイオ研究の世界にも実験スタイルに変遷があります。
プロテオミクスが流行る前に、二次元電気泳動でジャイアントゲルというのがありました。一次元目の等電点電気泳動を長いキャピラリーで分離し二次元目も大きなサイズの SDS-PAGE で分離能を稼いでおき、大目のサンプルをのせれば、より高い分解能で今まで見えなかった微量たんぱく質も検出できるという目論見だったようです。 私がいたラボにも二次元電気泳動解析装置の付属品として入りました。
スラブゲルの面積で比較すると、当時私が使っていた通常サイズのゲルの数倍はありました。染色・脱色用のバットやシェーカーは大きいものを揃えてはみたものの、これだけ大きなゲルを何枚も並べて実験するスペース確保は厳しかったです。
結局、まともに使うことなくラボの片隅に放置されました。同じ頃、別メーカーのエンジニアがやってきて、ジャイアントゲルの良さを説いた挙句、どんな電気泳動装置を期待しているかと聞くので、顕微鏡で泳動像を観察できるようなものと応えると、理解できないという顔をして帰っていきました。 実験スペースの問題だけでなく、ダウンサイジングが必要と考えます。それも 並みのレベルではなくて、発想を変えた超スモールスケール化です。
バイオ研究でならば、細胞の中に入って解析ができるほどの大きさです。微細なものを調べるためには、それに相応した大きさのプローブが最適です。 そして、電気泳動のような物理化学的測定をするのではなく、生体分子そのものの仕組みを利用して解析するわけで、たとえば、酵素です。ここまで話を進めると、抗体に酵素をつけて生体内の抗原の近くのたんぱく質を修飾するような微小ロボットの話かなと思われるかもしれません。 そういう発想はすでにあるでしょう。
抗体医薬が目標とするところも基本的に同じです。細胞の内外の特定抗原に結合して、その近くの分子を改変しても、その変化が個体レベルで反映されるかといったら、なかなか難しいものもあります。一分子とかの現象ではだめで、少なくとも一定量を投与してバルクでの作用を期待するしかないです。ここでも抗体を使うので、「抗原の近く」までは同じですが、その先に少し別のことを考えてみましょう。
測定は情報収集です。そして、情報収集のひとつに撮影あるいはコピーがあります。抗原結合部位から一定距離のところ、たとえば Fc 領域 に「コピー機」をつけるわけです。生体レベルでのコピー機能、すなわちレプリカを作るならば、何と言っても核酸ですよね。アプタマーを使ってみましょうか。抗体分子のどこかにアプタマーを生成する機能をもたせ、結合した抗原と一定距離にある生体分子の構造を鋳型として in situ で アプタマーをつくります。これが未知の生体分子の相補的コピーです。核酸だから一分子あればそのあとの解析はお手の物です。抗体と抗原の結合は特異的なので、抗原から一定距離のところのにある分子に対するアプタマーがたくさん収集でき、いわゆるスキャンしたような結果になります。

図1:黄色い円の中心に抗原"B8"があるとする。

図2:抗原"B8"に結合する抗体(左)の Fc 領域は、結合の仕方に依存して円周(黄色い部分)に近いところに位置する。抗体の Fc 領域に「アプタマー生成装置」をつけた改造抗体(右)。端にある突起が、生体分子を鋳型にしてアプタマーをつくるポリメラーゼの作用点である。
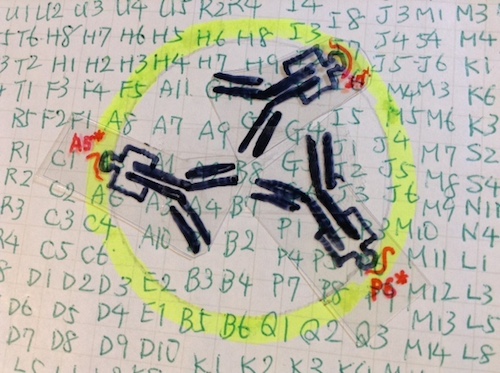
図3:3つの配置では、分子 A5、I7、P6それぞれに対するアプタマー A5*、I7*、P6*(赤色)が生成される。この操作を繰り返して(スキャンして)円周にある生体分子のアプタマーが得られる。
あとはアプタマーのシーケンスを決めて鋳型の構造を推定するためのデータ処理ですね。簡単にできそうなことを無責任に書きましたが、必須条件があります。分子コピーの機能を保証するためには、アプタマー生成が鋳型に対して一対一であることが重要です。そうでないと、作ったアプタマーから逆に鋳型の構造を推定できないからです。アプタマーがターゲットに対して「一義的」であるかどうかは、中村義一さんにきいてみないと。もう一つの問題は、不特定の生体分子を鋳型としてアプタマーを生成するような装置(酵素)をどうするかです。このあたりから基礎研究スタートですね。



