シアナのカイザーパーマネンテワシントン健康研究所(KPWHRI)で、コロナウイルス2019(COVID-19)を予防するために設計された治験ワクチンを評価する第1相臨床試験が始った。国立衛生研究所の一部である国立アレルギー感染症研究所(NIAID)が試験に資金を提供している。KPWHRIはNIAIDの感染症臨床研究コンソーシアムの一部だ。このオープンラベル試験では、18歳から55歳までのシアトルを拠点とする45人の健康な成人ボランティアが約6週間に渡り協力する。2020年3月16日に治験ワクチンを最初の参加者に接種した。この研究では、安全性と参加者に免疫応答を誘発する能力について、実験用ワクチンのさまざまな用量を評価する。これは、ワクチンの潜在的な利点を評価するための臨床試験プロセスにおける複数ステップの最初である。このワクチンはmRNA-1273( COVID-19 スパイクタンパク質をコードするメッセンジャーRNA分子)と呼ばれ、マサチューセッツ州ケンブリッジに拠点を置くバイオテクノロジー企業Moderna社のNIAID科学者とその共同研究者によって開発された。流行準備革新(CEPI:The Coalition for Epidemic Preparedness Innovations)連合は、第1相臨床試験のワクチン候補の製造を支援した。
「SARS-CoV-2による感染を防ぐための安全で効果的なワクチンを見つけることは、公衆衛生上の緊急の優先事項だ」とNIAIDのディレクター、Anthony S. Fauci博士は述べている。「記録的なスピードで開始されたこのフェーズ1の研究は、その目標を達成するための重要な最初のステップだ。」
COVID-19を引き起こすウイルスであるSARS-CoV-2による感染は、軽度から重度の呼吸器疾患を引き起こす可能性があり、発熱、咳、息切れの症状が含まれる。COVID-19の症例は、2019年12月に中国湖北省武漢で最初に特定された。2020年3月15日の時点で、世界保健機関(WHO)は、COVID-19の153,517例と世界中で5,735例の死亡を報告している。アメリカ疾病予防管理センター(CDC:Center for Disease Control and Prevention)によると、3月15日現在、2,800件以上の確認済みのCOVID-19症例と58人の死亡が米国で報告されている。今のところSARS-CoV-2の感染を防ぐための承認されたワクチンはない。
治験用ワクチンは、メッセンジャーRNA(mRNA)を使用して開発された。治験用ワクチンは、体細胞にウイルスタンパク質(スパイクタンパク質)を発現させ、強力な免疫応答を誘発することが期待されている。mRNA-1273ワクチンは動物モデルで有望であり、これはヒトでそれを調べる最初の試験だ。
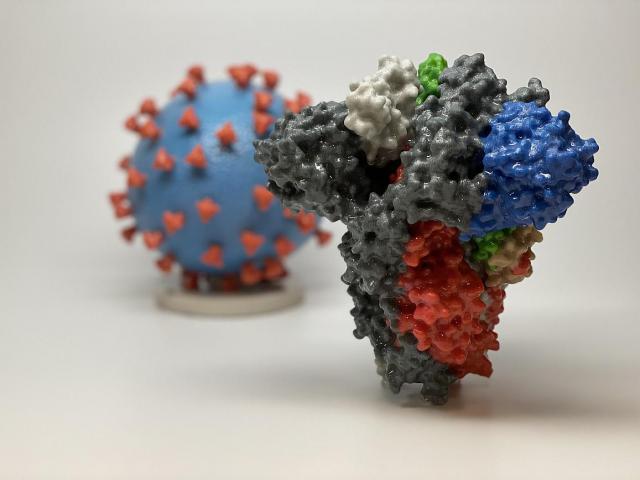
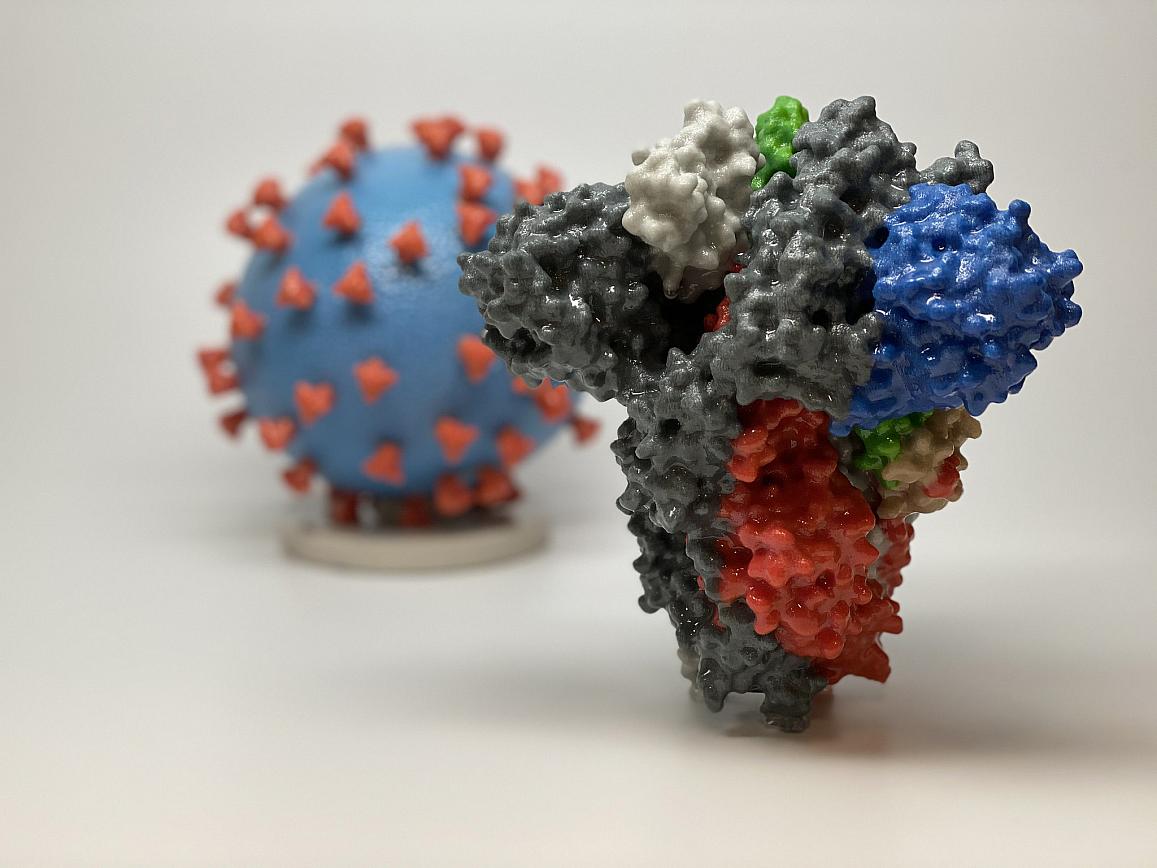
NIAIDのワクチン研究センター(VRC)とモデルナの科学者たちは、重度の急性呼吸器症候群(SARS)と中東呼吸器症候群(MERS)を引き起こす関連コロナウイルスの以前の研究により、mRNA-1273を迅速に開発することができた。コロナウイルスは球形で、表面から突き出たスパイクがあり、粒子に王冠のような外観を示す。スパイクは人間の細胞に結合し、ウイルスが侵入できるようにする。
VRCとModerna社の科学者は、スパイクを標的としたMERSワクチンの研究にすでに取り組んでおり、COVID-19を防御するためのワクチン候補を開発するための出発点となった。SARS-CoV-2の遺伝情報が利用可能になると、科学者たちは、既存のmRNAプラットフォームでウイルスの安定したスパイクタンパク質を発現する配列をすばやく選択した。
フェーズ1の試験は、KPWHRIの上級調査員であるLisa A. Jackson博士が主導している。研究参加者は、上腕に約28日間隔で筋肉内注射を介してワクチンを2回投与される。各参加者は、両方のワクチン接種で25マイクログラム(mcg)、100 mcg、または250 mcgの投与を受けるように割り当てられ、各投与コホートに15人が参加する。最初の4人の参加者は低用量の注射を1回受け、次の4人の参加者は100 mcgの用量を受ける。
治験責任医師は、25および100 mcgの投与グループの残りの参加者にワクチン接種する前、および参加者が2回目のワクチン接種を受ける前に、安全性データを確認する。参加者が250 mcgコホートに登録される前に、別の安全性レビューが行われる。
参加者は、ワクチン接種間のフォローアップ訪問のため、およびセカンドショット後の1年間にわたる追加の訪問のためにクリニックに戻るように求められる。臨床医は、注射部位の痛みや発熱などの一般的なワクチン接種の症状やその他の医学的問題がないか参加者を監視する。プロトコルチームは定期的に会合して安全性データをレビューし、安全性監視委員会も定期的に試験データをレビューし、NIAIDに助言する。
参加者はまた、指定された時点で血液サンプルを提供するように求められる。研究者は、実験ワクチンに対する免疫応答を検出および測定するために研究室でテストを行う。
「この作業は、この新たなウイルスの脅威に対応するための全国的な取り組みにとって重要だ」とJackson博士は述べた。「2007年以来、NIH臨床試験センターとしての経験から、この重要な試験を実施する準備ができている。」
画像
SARS-CoV-2ウイルス粒子の3Dプリントの前に、SARS-CoV-2(2019-nCoV、COVID-19を引き起こすウイルス)のスパイクタンパク質の3Dプリント。スパイクタンパク質(前景)により、ウイルスはヒトの細胞に入り、感染することができる。ウイルスモデルでは、ウイルスの表面(青)はスパイクタンパク質(赤)で覆われており、ウイルスがヒトの細胞に侵入して感染することを可能にする。
BioQuick News:NIH Clinical Trial of Investigational Vaccine for COVID-19 Begins; Vaccine Is mRNA Coding for Viral Spike Protein; Vaccine Developed by Collaborating Scientists at Moderna and NIAID
[NIH press release]
[Moderna, Inc.] [Moderna’s Work on a Potential Vaccine Against COVID-19]
[WCVB Boston]
[Fortune article]
[BioSpace article]