発表された最新の研究によれば、がんは肝臓に影響を及ぼす分子を放出することで、肝臓を病的に変化させ、炎症を引き起こし、脂肪を蓄積させ、解毒機能を損なうことが明らかになりました。この研究は、Weill Cornell Medicineの研究者と他の研究機関との共同作業によって行われました。この発見は、がんの生存メカニズムの中でも非常に巧妙なものの一つであり、新たな検査や薬剤の開発に向けた可能性を示唆しています。これにより、肝臓の状態を改善し、逆転させる手段が見つかるかもしれません。
この研究は、最新の論文として、2023年5月24日にNature誌に掲載されました。論文のタイトルは、「Tumour Extracellular Vesicles and Particles Induce Liver Metabolic Dysfunction(腫瘍由来の細胞外小胞および粒子が肝臓の代謝機能障害を誘発する)」です。
研究者たちは、肝臓外で成長する様々な腫瘍が、肝臓を脂肪肝に似た状態に再プログラムするために、脂肪酸を含む細胞外小胞および粒子(EVP)の分泌を利用していることを発見しました。このプロセスは、がんの動物モデルや実際のがん患者の肝臓で確認されました。
Weill Cornell Medicineの小児科および細胞・発達生物学の教授であり、研究共同責任者であるDavid Lyden医学博士は、「我々の発見は、腫瘍が肝臓疾患を含む重大な全身的な合併症を引き起こす可能性があることを示しています。しかし、同時に、これらの合併症に対処するための将来の治療法の可能性も示唆しています」と述べました。
なお、この研究は、Weill Cornell Medicineのゲイル&アイラ・ドルキエ研究所とサンドラ&エドワード・マイヤーがんセンターのメンバーであるDavid Lyden博士と彼の研究グループは、過去20年間にわたってがんの全身への影響を研究してきました。これらの研究は、がんが生存を確保し、進行を促進するために特定の戦略を利用していることを示しています。
例えば、2015年に行われた研究では、膵臓がんが細胞外小胞(EV)に包まれた分子を分泌し、それが血流に乗って肝臓に運ばれ、新たな転移性腫瘍の成長を支援するための準備を行うことが明らかになりました。
このような研究結果は、がんの複雑なメカニズムを理解する上で重要な一歩です。それにより、将来的にはがんの合併症に対処する新たな治療法や予防策の開発が可能になるかもしれません。
Weill Cornell Medicineのゲイル&アイラ・ドルキエ研究所とサンドラ&エドワード・マイヤーがんセンターのメンバーであるDavid Lyden博士と彼の研究グループは、これからもがんに関するさらなる研究を進め、その治療と予防に貢献していくことが期待されます。
研究グループは、肝臓に転移しないが他の臓器に転移する骨、皮膚、乳がんの動物モデルを用いて、遠隔のがん細胞による肝臓の変化を明らかにしました。この研究により、これらの腫瘍が肝細胞に脂肪分子を蓄積させ、その結果、肥満やアルコールに関連する脂肪性肝疾患に似た状態で肝臓を再プログラムすることが示されました。
さらに、肝臓が再プログラムされると、炎症レベルが上昇し、薬物代謝酵素であるチトクロームP450のレベルが低下することが確認されました。チトクロームP450の減少は、がん患者が病気の進行とともに化学療法や他の薬物に対する耐性を失う理由の一つとなる可能性があります。
研究チームは、肝臓の再プログラム化には、特にパルミチン酸を含む脂肪酸が放出される細胞外小胞および粒子(EVP)が関与していることを突き止めました。これらの脂肪酸は肝臓内のクッパー細胞と呼ばれる免疫細胞に取り込まれることで、TNF-αの産生を誘発し、脂肪肝の形成を促進すると考えられます。
この研究は、主にがんの動物モデルを使用して行われましたが、膵臓がんと診断され、その後肝臓以外の部位に転移を有する患者の肝臓でも同様の変化が観察されることが確認されました。これにより、肝臓の再プログラム化が広範囲のがん患者に共通するメカニズムである可能性が示唆されます。
「我々のより顕著な観察の1つは、このEVP によって誘発された脂肪肝の状態が、肝転移と共起しなかったことです。これは、脂肪肝を引き起こすことと、転移のために肝臓を準備することが、がんが肝機能を操作するために使用する別個の戦略であることを示唆しています」と、ライデン研究所の博士研究員であり、共同ファースト著者のGang Wang博士は述べました。また、共同研究者であり、この研究の共同筆頭著者でもあるJianlong Li博士も同様の見解を示しました。
科学者たちは、脂肪肝の状態が肝臓を脂質ベースのエネルギー源に変えてがんの成長を促進する可能性があると考えています。
「我々は肝細胞において、脂肪の異常な蓄積だけでなく、脂質の正常な処理からシフトして、生成される脂質ががんにとってより有利になることを観察しています」と、ワイルコーネル医学のマイヤーがんセンターメンバーであり、ニューヨーク・プレスビテリアン/ワイルコーネル医療センターの肝臓学者である共同主任著者のロバート・シュワルツ博士は述べました。彼はまた、消化器・肝臓部門の医学准教授でもあります。
「免疫細胞の機能に関与する重要な分子も存在し、これらの脂肪肝ではその産生が変化しており、この状態が抗腫瘍免疫を弱める可能性も示唆されています。」と、ワイルコーネル医学部小児科の細胞・発達生物学助教授であり、共同研究者でもあるHaiying Zhang博士は述べました。
研究チームは、実験動物モデルを使用して、腫瘍から放出されるEVPの放出を阻害したり、パルミチン酸を EVP にパッケージングすることを阻害したり、TNF-αの活性を抑制したり、クッパー細胞を除去するなどの戦略を実施することによって、腫瘍が肝臓に及ぼすこれらの全身的な影響を軽減することができました。研究者たちは、これらの戦略を実際の患者に適用し、腫瘍が肝臓に遠隔作用するのを阻止する可能性をさらに調査し、進行したがんの潜在的な警告サインとして、血液中の腫瘍EVP 中のパルミチン酸の検出を利用する可能性を探求しています。
[Cornell Weill Medicine news release] [Nature abstract]
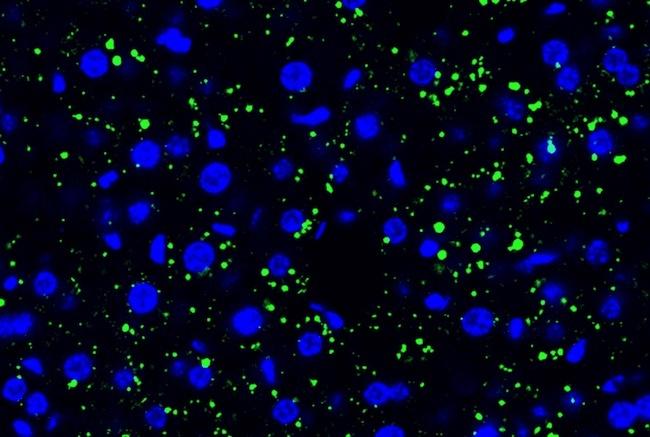
腫瘍細胞由来のEVP は、マウス肝臓に脂質滴の蓄積を誘導した。
緑:脂質滴・青:DAPI
(Credit: Gang Wang, Jianlong Li, David Lyden).





