国際共同研究により、セント・ジュード小児研究病院の科学者チームが、データサイエンス、薬理学、構造情報を活用し、アドレナリンと結合するレセプターの各アミノ酸が、この天然リガンドの存在下でレセプター活性にどのように寄与するかを原子レベルで解明しました。
研究チームは、主要な薬理学的特性を制御するアミノ酸を正確に特定しました。研究対象のアドレナリンレセプターは、G タンパク質共役型受容体(GPCR)ファミリーのメンバーで、このファミリーは米国食品医薬品局(FDA)承認薬の3分の1の標的となっています。したがって、GPCRが天然または治療用リガンドにどのように応答するかを理解することは、レセプター活性に正確な効果を持つ新薬の開発に不可欠です。
この研究は2023年12月21日付けのScienceに掲載され、論文タイトルは「Molecular Determinants of Ligand Efficacy and Potency in GPCR Signaling」(GPCRシグナリングにおけるリガンド効力と有効性の分子決定要因)です。
時計の仕組みを理解するには、部品ごとに分解し、各部品が時刻維持機能においてどのような役割を果たしているかを研究するかもしれません。同様に、GPCRなどのタンパク質では、各アミノ酸が外部シグナルに対するタンパク質の応答にそれぞれ異なる役割を果たしている可能性があります。セント・ジュード研究チームは、スタンフォード大学、モントリオール大学、MRC分子生物学研究所、ケンブリッジ大学の科学者と協力し、ひとつずつアミノ酸を置換することで、β2アドレナリン受容体(β2AR)におけるシグナル応答を媒介する各アミノ酸の寄与を理解しようと試みました。
「科学者は遺伝子を一つずつ破壊することで、細胞機能への遺伝子の寄与を学びます。私たちは『なぜ、もう一歩掘り下げて調べないのでしょうか? アミノ酸を一つずつ変異させ、レセプターの機能に対する各アミノ酸の寄与を理解しましょう』と考えました」と、セント・ジュード構造生物学部門所属で、Center of Excellence for Data-Driven Discovery のディレクター、ジョージ・J・ペダーセン生物データサイエンス基金学術教授職を務めるM.マダン・バブ博士(M. Madan Babu PhD)が共同責任著者として述べています。「進化の過程で、レセプターの各アミノ酸は、天然リガンド(この場合はアドレナリン)と結合し、適切な生理学的応答を引き起こすよう、何らかの形で彫り上げられてきました。」
形態の中の機能を見出す
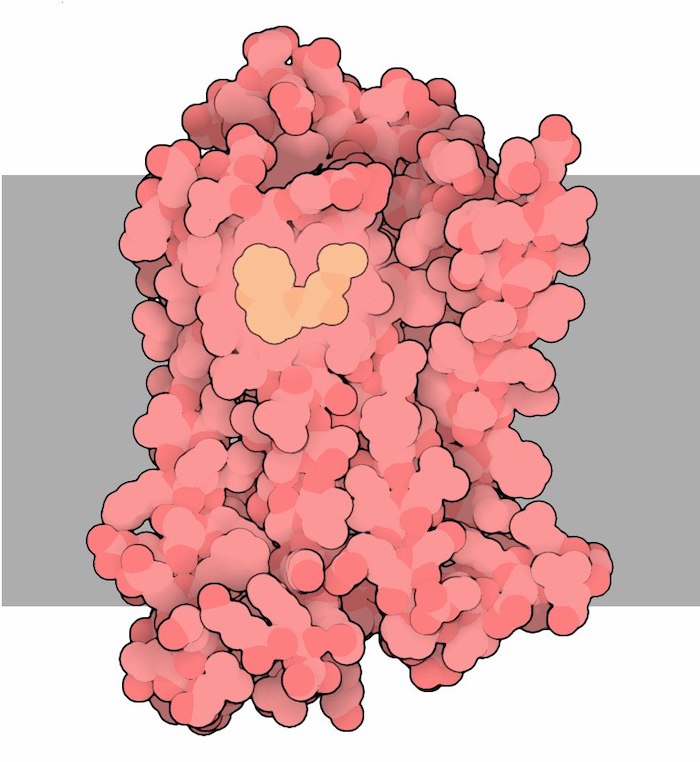
GPCRは細胞膜を貫通するタンパク質で、細胞の外側と内側環境をつなぎ、外部シグナルを細胞内に伝達します。β2ARの場合、アドレナリンが細胞外部のGPCRに結合し、細胞内で応答を誘導します。
リガンドが結合すると、特に細胞内側のGタンパク質結合部位周辺で、レセプターの形状変化が引き起こされます。リガンドとGタンパク質の結合部位はタンパク質の反対側にありますが、タンパク質全体にわたる複雑なアミノ酸接触ネットワークを介して接続されています。GPCR内の構造(形状)変化がGタンパク質を活性化し、細胞内でダウンストリームのシグナル応答を引き起こします。アドレナリンは複数の組織やGPCRに作用し、β2ARを含むレセプターを介してファイトオアフライト反応(戦うか逃げるかの反応)を誘発することができます。
GPCRにおける各アミノ酸の役割を理解するため、フランシスカ・ハイデンライヒ博士(Franziska Heydenreich PhD、現マールブルク・フィリップス大学)がこのプロジェクトのリーダーおよび共同責任著者として、β2ARの412個のアミノ酸を一つずつ変異させました。そして、各変異体のアドレナリンリガンドに対する応答を評価し、薬理学的特性である効力と親和性の古典的指標を求めました。効力はリガンドが引き起こし得る最大応答を示し、親和性は最大応答の半分を引き起こすのに必要なリガンド量を示します。目的は、原子レベルで、各アミノ酸がこれらの薬理学的特性にどのように寄与するかを明らかにすることでした。
「驚いたことに、400を超えるアミノ酸のうち、これらの薬理学的特性に寄与するのは約80個だけでした。薬理学的に関連するこれらのアミノ酸のうち、リガンドやGタンパク質がレセプターに結合する領域に存在するのは3分の1に過ぎませんでした」とハイデンライヒ博士は述べています。
「効力を制御するアミノ酸、親和性を制御するアミノ酸、そしてその両方に影響するアミノ酸があることが興味深い観察結果でした」とバブ博士は言います。「つまり、より高い親和性や効力の薬を開発したい場合、新しいリガンドが影響を及ぼす必要があるアミノ酸残基が特定できるということです。」また、効力と親和性に対する個々のアミノ酸残基の寄与度が等しくないことから、新規治療用リガンドのデザインにおいて薬剤応答をさらに微調整する機会があることも示唆されました。
「効力と親和性は、数十年にわたり無数のリガンド-レセプター シグナル系で測定されてきました。今や、タンパク質配列の特定のアミノ酸がこれらの薬理学的特性にどのように影響するかを理解できるようになりました」とバブ博士は説明しています。
「研究結果の興味深い点は、効力と親和性が異なるメカニズムを介して独立に制御されうることです。これは、遺伝的変異が個人間の薬物応答にどのように影響するかを理解する基礎となります」と、モントリオール大学生化学・分子医学部門およびモントリオール大学がん免疫研究所の総ディレクターであるミシェル・ブヴィエ博士(Michel Bouvier PhD)が共同責任著者として付け加えています。
美しいネットワーク
従来の研究で、β2ARの活性型および非活性型の構造が明らかにされています。この知見に基づき、研究チームは新たな探究を開始しました。リガンドやGタンパク質結合に関与しないと示された薬理学的に関連する3分の2のアミノ酸が、レセプターの活性型と非活性型の遷移に何らかの役割を果たす可能性を探りました。
「私たちはシステマティックに、活性型で特異的な残基接触をすべて調べ、そうした活性型特異的な接触を形成するアミノ酸がすべて重要かどうかを理解しようとしました」とハイデンライヒ博士は述べています。
研究チームは、薬理学的データと構造データを体系的に統合するためのデータサイエンス的枠組みを開発し、GPCRシグナル伝達の包括的な理解を初めて実現しました。「薬理データを構造にマッピングすると、美しいネットワークが現れました」とバブ博士は言います。
「これにより、効力と親和性を制御するリガンド結合ポケットとGタンパク質結合部位を繋ぐ、立体的ネットワークに関する新たな洞察が得られました」と、2012年にGタンパク質共役型受容体の作用機序の発見で化学賞ノーベル賞を受賞したスタンフォード大学医学部のブライアン・コビルカ博士(Brian Kobilka MD)が共同責任著者として付け加えています。
原子レベルでのGPCRシグナル伝達の理解が進んだことから、研究チームは、より一層深く探究できる期待を抱いています。活性型と非活性型の中間の一時的な準安定状態を見ることができるかもしれず、タンパク質の構造の landscapes を探索できるかもしれません。
「私たちには、効力、親和性、またはその両方にのみ影響を与える変異体が分かっています」とハイデンライヒ博士は言います。
「今や、そうした変異体に対して分子動力学計算や単一分子実験を行い、シグナル応答を仲介するアロステリックネットワークが、どのようなメカニズムで効力と親和性に影響するのかを明らかにできます。このような方向性は、複数の研究機関から主任研究者が参加するセント・ジュードのGPCRに関する共同研究を通じて追求しています」とバブ博士は説明しています。
活性型特異的な接触を媒介し、変異させると薬理学的性質に影響を与えるこれらの「ドライバー」残基に加えて、バブ博士と同僚らは、この研究で明らかになった他の重要な発見についても探究する予定です。活性型で接触を形成するものの、変異させても効力や親和性に影響を与えない「乗客(パッセンジャー)」アミノ酸を研究対象としています。また、活性型特異的な接触を媒介しないが、変異すると薬理特性に影響を与える「調節(モジュレーター)」残基にも興味があります。構造情報と薬理学的測定値を統合するこのデータサイエンスアプローチは、β2ARに限らず任意のGPCRに適用でき、この重要な創薬標的クラスの作用機序の理解を深めることができます。
この研究の他の著者には、マリア・マルティ・ソラノ(Maria Marti-Solano、ケンブリッジ大学)、マンビル・サンドフ(Manbir Sandhu、セント・ジュード)が含まれます。
セント・ジュード小児研究病院について
セント・ジュード小児研究病院は、世界の小児がん、重症筫血病、その他の生命を脅かす疾患の理解、治療、治癒に向けて先導的役割を果たしています。同病院は、小児のみを対象とした米国立がん研究所指定の包括的がんセンターです。セント・ジュードで開発された治療法により、同病院開設以来60年余りで小児がんの全体的な生存率が20%から80%に押し上げられました。セント・ジュードは、自身の突破口を共有し、世界中の医療機関やがん治療センターの医師や研究者が、より多くの子供たちにとってよりよい治療とケアを提供できるよう支援しています。詳細は stjude.org をご覧いただくか、St. Jude Progressブログをお読みいただくか、@stjuderesearchでソーシャルメディアをフォローしてください。
画像:β2アドレナリン受容体(PDB: 2rh1)の細胞外部位に逆アゴニストであるカラゾロール(黄色)を結合させた画像。