遺伝性の衰弱性疾患を治すことは、現代医学の大きな課題の一つである。過去10年間、CRISPR技術の開発と遺伝学研究の進歩は、患者とその家族に新たな希望をもたらしたが、これらの新しい手法の安全性は依然として大きな懸念材料となっている。2022年7月1日発行のScience Advances誌に、カリフォルニア大学サンディエゴ校の博士研究員シタラ・ロイ博士、専門家アナベル・ギチャード博士、イーサン・ビア教授を含む生物学者チームが、将来的に遺伝的欠陥を修正できるかもしれない新しい、より安全なアプローチについて説明している。この自然のDNA修復機構を利用する戦略は、広範な遺伝性疾患を治療する可能性を有する新しい遺伝子治療戦略の基礎を提供するものだ。
このオープンアクセス論文は「ショウジョウバエ体細胞におけるCas9/ニッカーゼによる相同染色体テンプレート修復による対立遺伝子変換(Cas9/Nickase-Induced Allelic Conversion by Homologous Chromosome-Templated Repair in Drosophila Somatic Cells)」と題されている。
多くの場合、遺伝性疾患の患者は、両親から受け継いだ2本の遺伝子のコピーに、それぞれ異なる変異を有している。つまり、一方の染色体上の変異が、もう一方の染色体上の機能的な配列と対応することがよくあるのだ。この研究者らは、この事実を利用するために、CRISPR遺伝子編集ツールを採用した。
「健全な変異体は、変異体DNAを切断した後、細胞の修復機構によって欠陥のある変異を修正するために使用することができる。驚くべきことに、これは単純で無害なニックによってさらに効率的に達成できる。」と、この研究の主執筆者のギチャード博士は述べている。
研究チームは、ミバエを用い、目の色素の産生によって「相同染色体テンプレート修復」(HTR)を可視化できる変異体を設計した。このような変異体は、当初、目が全体的に白かった。これは、細胞のDNA修復機構が、もう一方の染色体から取り出した機能的なDNAを使って突然変異を修復したことを示すものである。
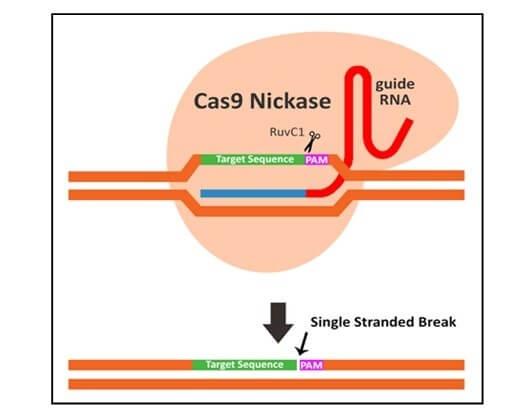
そこで研究チームは、この新しいシステムを、DNAの両鎖ではなく片方の鎖だけを標的とする「ニッカーゼ」と呼ばれるCas9の変異体でテストした。その結果、驚くべきことに、このニッカーゼでも、変異していない健康なハエとほぼ同レベルの赤目の色を回復できることが判明した。ニッカーゼによる修復成功率は50~70%であるのに対し、2本鎖切断型のCas9ではわずか20~30%であり、Cas9は頻繁に変異を生み出し、ゲノム中の他の部位(いわゆるオフターゲット変異)を標的にしていることがわかった。
「このニッカーゼがこれほど上手く機能するとは信じられなかった。この新しいシステムの汎用性は、哺乳類の遺伝子変異を修復するモデルとして役立つ可能性がある」とロイ博士は指摘している。
「このプロセスがヒトの細胞にどのように適用されるのか、また、どのような遺伝子にも適用できるのか、まだ分かっていない。ヒトの染色体が持つ病気の原因となる突然変異を効率よくHTRするためには、何らかの調整が必要かもしれない。」とギチャード博士は述べている。
これは、ガイドRNAがCRISPRシステムに遺伝子の望ましくない変異体を切断し、好ましいバージョンの遺伝子に置き換えるよう指示するもので、遺伝子ドライブの原理を発展させた「allelic-drives」による精密編集のこれまでの研究成果を発展させたものである。
この研究の大きな特徴は、ニッカーゼを用いたシステムでは、従来のCas9を用いたCRISPR編集で知られているようなオンターゲットおよびオフターゲットの変異がはるかに少ないということである。また、ニッカーゼの成分を数日間にわたってゆっくりと継続的に投与することで、1回だけ投与するよりも有益であることが証明されたとしている。
「このアプローチのもう一つの特筆すべき利点は、そのシンプルさだ」とビア教授は述べている。
「突然変異を伴う完全なDNA切断をしばしば作り出すCas9とは異なり、非常に少ない構成要素に依存し、DNAニックは"ソフト"なのだ。もし、ホモログ間ペアリングを促進するか、ニック特異的修復プロセスを最適化することによって、そのような事象の頻度を増やすことが出来るなら、そのような戦略は、多数の優性またはトランスヘテロ接合性の疾患原因変異を修正するために利用されるだろう。」とロイ博士は述べている。