私が酵素抗体法(ELISA, Enzyme-Linked Immunosorbent Assay) と出会ったのは大学院博士課程に在学していた1970年代後半の頃でした。 本郷キャンパスの医学部生化学教室には、附属病院から学位取得のために研究をしに訪れるお医者さんが何人かいて、木村吉雄先生もその一人でした。
木村先生は、筋ジストロフィー症の原因たんぱく質の一つと考えられていたカルパイン(当時私たちは CANP: Calcium-Activated Neutral Protease と呼んでいた)の筋肉内定量を目指し、筋組織抽出液中に存在するカルパインを ELISA で調べる実験を進めていました。
ELISA の定量性を検証するために、私は粗抽出液をイオン交換カラムで分画しカルシウムイオン依存性のタンパク質分解活性を調べるとともに、カルパインを電気泳動で二次元展開して木村先生のお手伝いをしました。
今になって考えると、私がたんぱく質分解に生涯関わることになったのは、この実験がきっかけだったかもしれないと感慨深いものがあります。
ELISA は、酵素標識した抗体を利用して粗抽出液中の抗原量を見積もる方法で、それほど煩雑な実験操作なしで結果が得られます。標識酵素としてはアルカリホスファターゼやペルオキシダーゼがよく用いられます。 酵素の代わりに放射性同位体で標識する方法が RIA(Radioimmuno Assay)、蛍光物質で標識するのが FIA(Fluoroimmuno Assay) です。ELISA による抗原量測定では、サンプル数をこなす必要があるため、反応を96穴マイクロタイタープレートで行うことが多く、比色測定はマイクロプレートリーダーが便利です。
96穴プレートの底に始めに何を吸着させるかによって幾つかの方法があります。 目的の抗原に対する抗体を一種類しか持っていないときは、抗原を含むサンプル液をプレートに吸着させます。
ここに抗体を加え、抗原を介してプレートに結合した抗体を酵素反応で定量します。
抗体にあらかじめ酵素標識する直接法と、抗体に対する標識抗体を二次抗体として用いる間接法があります。抗体をたくさん持っている場合は、実験操作が少ない直接法が結果を迅速に得ますが、感度は間接法が良いです。 また、標識した二次抗体が各種市販されていることもメリットの一つです。
抗原をプレートに結合させる方法は、抗原によってプレートへの結合性も異なり、特に抗原量が少ないときは定量的に吸着しないためお薦めしません。あくまでも、抗体をひとつしか持っていないときの簡便法と考えてください。 抗体をあらかじめプレートへ結合させる方法は、この固定化抗体とは異なるエピトープを持つ抗体をもう一つ必要とします。先につけた抗体と後からの検出用抗体の間に抗原を挟み込むのでサンドイッチ法とも呼ばれています。
検出用抗体は先の抗体とは別の動物で作った抗体でなければなりません。
例えば、プレートに固定化する抗体がマウスで作ったモノクローナル抗体ならば、検出用抗体はウサギで作った別のエピトープに対するポリクローナル抗体といった組み合わせです。標識酵素は、検出用抗体に直接つけても二次抗体として用いる抗ウサギ IgG 抗体につけても良いです。標識二次抗体は多数市販されていますので選べます。
ただし、先につけた抗体とは交差しないことを確認しておいてください。 抗体をいくつも持っているときは、どれをプレートに固定化するか迷うかもしれませんが、抗体価が高い良い抗体を使うのがよろしいです。プレート底面に一定密度で吸着させるために、また抗原に対する非特異結合が極力小さくなるように濃度などの条件をしっかり設定してください。 共通した注意点をひとつ。純化した抗原で標準曲線を必ずとっておいてください。
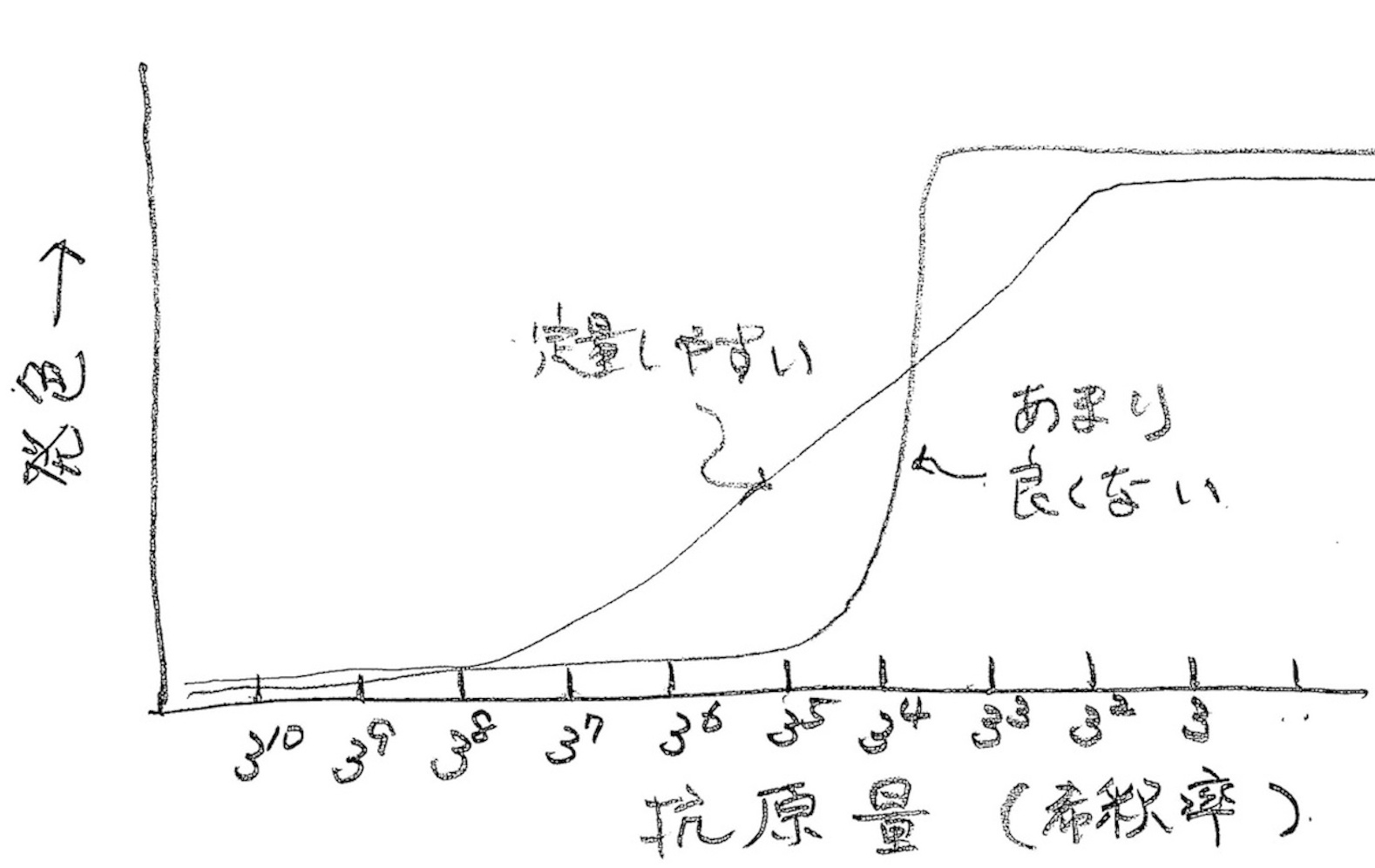
また、各抗体の濃度や反応条件の検討についても純化した抗原を用いて行います。
それぞれの抗体濃度を変えると発色カーブが呼応して変化し、実験技術の練習になるとともに、本番のサンプル測定でのトラブルも少なくなります。





