こんにちは! 質量分析屋の髙橋です。LC/MSで汎用的に用いられているイオン化法はESIですが、ESIの大きな問題はマトリックス効果特にイオン化抑制が起こり易い事です。ここでは、、“ESIでイオン化抑制が何故起こるのか”について解説したいと思います。因みに、この内容の多くは、山梨大学の平岡先生から教えて頂いたことです。
前述した様に、ESIでは夾雑成分の共存によって分析種のイオン化が抑制(あるいは促進)される“マトリックス効果”という現象が頻繁に起こります。生体試料を測定するメタボロミクスなどの研究分野においては、特に問題になっています。イオン化抑制の原因になる物質には様々なものがありますが、中でも血漿試料に含まれるリン脂質や試料調製過程でコンタミしてしまう(と考えられる)ポリエチレングリコールなど界面活性作用をもつ物質は、マトリックス効果を示す代表例です。
ESIでは、図1に示すように、キャピラリー先端部の液体の塊から、静電的な引力によってイオンが液滴として引きちぎられることによって帯電液滴となり、脱溶媒⇒液滴の分裂⇒イオンエバポレーションを経て、気相イオンが生成します。
図1
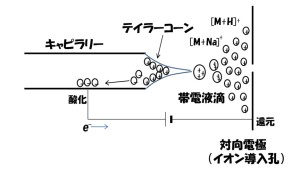
ESIにおけるイオン生成の様子 この時、帯電液滴の電荷密度と液滴の大きさはキャピラリー先端の内径、液体の流量、および液滴の生成を補助する外力(ネブライザーガス)の有無に依存します。即ち、キャピラリー先端の内径が小さく、液体の流量が少なく、ネブライザーガスを使わない条件では電荷密度の高い小さな液滴が生成し、キャピラリー先端の内径が大きく、液体の流量が多く、ネブライザーガスを使う条件では電荷密度の低い大きな液滴が生成します。マトリックス効果は、帯電液滴の電荷密度が低い程受けやすく、それはエネルギー供給が絶たれた状態の帯電液滴から、時間をかけて脱溶媒⇒液滴の分裂⇒イオンエバポレーションという過程を経ることに主な原因があると考えられます。界面活性作用をもつ物質(界面活性剤)によるイオン化抑制のイメージを図2に示します。
図2

界面活性剤によるイオン化抑制のイメージ 界面活性剤は、気液界面すなわち液滴の表面に集まりやすい性質があり、イオン化効率(プロトン親和力)も高いことが多いため、液滴表面から優先的にイオンエバポレーションして気相イオンになります。
界面活性剤が優先的にイオンエバポレーションすることで、帯電液滴中の電荷密度は減少します。この時、元々の液滴電荷密度が十分に高く液滴が小さければ、界面活性剤が先にイオン化して液滴の電荷密度が減少しても、液滴の更なる脱溶媒によって電荷密度は高まるので、分析種もイオンエバポレーションすることができます。しかし、元々の液滴電荷密度が低く液滴が大きい場合、界面活性剤がイオン化することで液滴内の過剰電荷が著しく減少し電荷密度が小さくなりすぎてしまい、更なる脱溶媒⇒液滴分裂⇒イオンエバポレーションの過程が進行するのに時間がかかるため、液滴内に残った分析種がイオンエバポレーションされない(MSに取り込まれない)ことになります。
一般的に用いられているESイオン源のイメージを図3に示します。
図3に示すようなESイオン源では、通常LC移動相は200~400 µL/minで用いられます。図1に示すような、静電的な引力のみで帯電液滴が生成する液体導入量は<数 µL/minであり、それ以上の流量では液滴生成を補助するためにネブライザーガス(図3中のN2)が用いられます。ガスの圧力で無理やり液滴を作るために、帯電液滴の電荷密度は静電的な引力のみで作られた液滴に比べると、当然小さくなります。また、数百 µL/minという高流速に対応するため、キャピラリー先端の内径は低流速で用いるESIよりも大きくせざるをえません。このような一般的なESイオン源では、前述したような理由でイオン化抑制が起きやすくなります。
図3
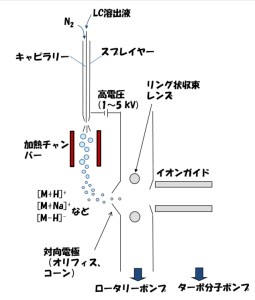
一般的なESイオン源のイメージ 内径の細い(数 µm)キャピラリーを用い、nL/minオーダーの液体導入量で用いるESIは、ナノESIと呼ばれます。ナノESIの応用例として、細胞にナノESIチップを突き刺してサンプリングし、溶媒で希釈するだけで直接マススペクトルを測定する、一細胞質量分析が知られています。細胞から直接サンプリングするため、試料溶液には大量の塩が含まれます。塩もイオン化抑制を示す物質の代表例の1つですが、大量の塩が含まれていても代謝物などの含有成分由来のイオンが観測されるのは、ナノESIで生成する帯電液滴がイオン化抑制を起こし難い環境であるからにほかなりません。ただし、ナノESIを用いればイオン化抑制を完全に防げるという訳ではありません。
次回は、“エネルギー供給が絶たれた状態の帯電液滴”を経ることがイオン化抑制の原因になるという事について、他の事例を挙げて考えてみたいと思います。



