疾患の動的ネットワークのプロテインープロテイン相互作用のシステム、すなわち、それぞれの疾患における臨床バイオマーカーの解明し、更にゲノムの情報や臨床検査に用いられている項目の値などを取り入れ、IT技術を用い総合的に判断することで、その疾患の患者さんの層別が出来ると考えています。
そして、この様な総合判断が一般化すると、現在市販されている医薬品の個々の患者さんにあった最適な選択も可能にし、更に今までphase2でドロップアウトした医薬候補品も、上記の様に患者さんを層別し、再度臨床試験をすることで医薬品にできる可能性もあると考えます。 更に、この様に層別した患者さんに適した医薬品を提供することが、本当にメデカルニーズにあった創薬と思います。
そこで、創薬の標的を考えるために、患者さんの層別に用いた疾患の動的ネットワークのプロテインープロテイン相互作用メカニズムを詳細に解析し、そのメカニズムのどの部分を創薬の標的にするかを検討する必要があります。それには薬理学的な観点から動的ネットワークを見る必要があり、そこでは今までゲノム解析情報や創薬研究者の経験と蓄積が生かされます。この様に創薬標的プロテインを探索することを製薬業界では「ターゲットバリデーション」と言います。
そして、ターゲットバリデーションした創薬標的プロテインが「既存標的」で健常な状態の生理学的な標的機能も、ヒトの病理学的な標的機能も科学的な理解が良くなされている場合は創薬研究に結び付けることがスムーズにできます。しかし、一般には、「新規標的」の場合が多く、発見された新規標的プロテインの多くはGタンパク質共役受容体(GPCR)とプロテインキナーゼが主な主流になっていると考えます。
創薬標的プロテインがターゲット細胞の外なのか、それとも細胞表面か、細胞内かを見極め、更にその標的プロテインが疾患を引き起こすシグナル伝達に関与しているのか、それとも直接疾患に関与しているのかを見極める必要があります。 一般的にはシグナル伝達に関与するプロテインープロテイン相互作用は1対1の弱い相互作用であり、一方直接疾患に関与しているプロテインープロテイン相互作用は複数のプロテインが関与することが多く、更に強い相互作用の場合が多いと考えられています。 そこで、ターゲットバリデーションで見つけた標的プロテインを用いて創薬研究を行うためには、そのプロテインがシグナル伝達に関与しているのか、それとも直接疾患に関与しているのかを解明し、更にプロテインープロテイン相互作用などの立体構造を含めた詳細な解析が必要となります。
この詳細なプロテインープロテイン相互作用の解析には、今はX線解析を用いることが主流になっていますが、しかしX線解析はプロテイン-プロテイン相互作用部位のような流動的な部分や、疾患に関与している多重合プロテインや膜タンパクなどの解析には不十分です。そこで、最近は、X線解析で解析困難な部分の解析にクライオ電子顕微鏡を用いた単粒子再構成法が構造生物学解析に魅力的な手法の一つになりつつあります。それは結晶をつくることなく原子モデルを構築することのできる高分解能の3次元構造が得られるようになってきたからで、大きな膜タンパク質の構造やスプライソソームのような複雑かつ多数の分子からなる複合体の構造も解かれてきています。
このクライオ電子顕微鏡はコンピューターにより制御され高性能のステージを搭載し、電子直接検出器,そしてこれまでになかったアルゴリズムを取り入れた新しい解析ソフトウェアにより、近原子分解能とよばれる高分解能の達成することができ、構造生物学への道が開いたと考えられます。 更に、天然の状態にかぎりなく近い状態に再構成された膜タンパク質の構造もみることができようになりました。2016年に入りTRPV1をナノディスクに再構成した試料における近原子分解能での解析で再構成された密度図(EMDB ID:8117)から、原子モデル(PDB ID:5IRX)が構築され(図5)、1) 更にTcトキシンをナノディスクに再構成した試料の解析における膜貫通部位の議論も報告されています。2)これらの応用は膜タンパク質の構造研究に新たな展開をもたらすことはいうまでもなく、創薬研究にも有効な手段になりうると考えています。
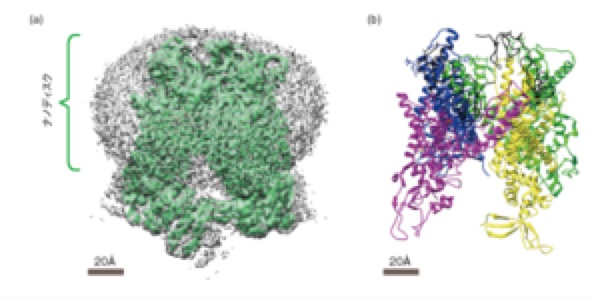
図 ナノディスクに再構成されたTRPV1チャネルの2.95Å分解能での構造 1.Gao, Y., Cao, E., Julius, D. et al.: TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action. Nature, 534, 347-351 (2016) 2.Gatsogiannis, C., Merino, F., Prumbaum, D. et al.: Membrane insertion of a Tc toxin in near-atomic detail. Nat. Struct. Mol. Biol., 23, 884-890 (2016)
但し、このクライオ電子顕微鏡は、まだ非常に高価な装置で、更に測定と解析に技術的に非常に高いノウハウが必要なため、もっと利用しやすくするために今後の更なる開発に期待したいと思います。
プロテインープロテインの強い相互作用ではX線解析や上記のクライオ電子顕微鏡などで結合部位を正確に判断することができますが、シグナル伝達に関与するプロテインープロテインの弱い相互作用の結合部位を解析するためには、X線解析やクライオ電子顕微鏡では困難であると考えられます。
そこで、このような弱い相互作用にはよくNMRのプロテイン解析技術が用いられてきました。特にNuclear Overhauser Effect(NOE)を用いプロテイン相互作用している一方のプロテインをNOE励起させると、相互作用しているプロテインの結合部位にNOE効果が移り結合部位が解析される方法で、一般的にはTransfer-NOEやSaturation Transfer Difference(STD)と言われる方法が有効であると思われます。しかし、これらの方法には多くの特許が出ているわりには、あまり使われず、技術的な方法を特許で抑えてしまうと更なる発展はありません。
それではNMRは利用できないのでしょうか? 私は、コラムの第1回で書いたPhoto-Chemically Induced Dynamic Nuclear Polarization(Photo-CIDNP)が利用できると考えています。このPhoto-CIDNPをプロテイン相互作用に応用することは1980年代に大阪大学蛋白研の故京極先生のグループが行っていました。 プロテイン-プロテイン相互作用の結合部位は電子的な相互作用で結合することが多く、この場合の多くにUVスペクトルで高周波領域にCharge Transfer(CT)バンドが見られます。CTバンド領域に選択的に光照射してNMRを測定すると電子的に結合している部位のシグナルがエンハンスやサプレッションする現象が現れ、それを解析することで結合部位の詳細がわかるのではないかと考えています。 NMR以外ではSPRや等温滴定型カロリメトリーで選択的に相互作用を見ることが多いようですが、これらの方法では結合部位を解析できないので、前回説明したLC/MS/MSを用いたH/D交換(HDX)方法などと組み合わせることで結合部位の解析が可能になると思います。
以上、このような手法を用いてターゲットバリデーションをして創薬標的を探索していく必要があります。更に、低分子、中分子、抗体と免疫創薬のどの創薬分野に焦点を当てて創薬研究を行うかは、このターゲットバリデーションの時に考えておく必要があると思います。それは、先に創薬分野を選んで創薬標的を探索する場合と、探索した創薬標的から創薬分野を判断する場合があるからです。どれかの創薬分野に特化して研究・技術の能力が高い場合は前記を選ぶでしょうし、大手製薬会社のようにどの創薬分野でも研究開発が可能な場合は後記を選ぶことが多いのではないでしょうか。
この創薬分野の選択に関しては、次回の創薬標的を用いた創薬リードの探索(Screening)の話の際に、少し詳しく説明をしましょう。



