ターゲットバリデーションより見つけられた創薬標的プロテインを用いて創薬リード化合物の探索(Screening)を行います。その場合低分子医薬か、抗体医薬か、プロテイン-プロテインインターラクション(PPI)を阻害するようなサイクリックペプタイドのような中分子医薬か、更に最近話題になっている免疫阻害剤のどのリード化合物を探索するかは、その標的プロテインの機能から判断する必要があります。
今回は私が長年行ってきた低分子・中分子創薬の創薬リード化合物のScreeningを中心に、その今後について考えてみます。 最近の創薬の傾向は長年行われて来た低分子創薬は時代遅れで、これからは抗体・免疫阻害剤の時代だと考える人も多いようですが、臨床試料を用いたゲノム解析やプロテオーム解析から新たな創薬標的が探索される可能性は高く、そこでは低分子創薬がまだまだ必要になっていると考えます。但し、今までの低分子創薬のScreeningのように、大量の低分子化合物についてロボットを用いたハイスクールプット(HT)Screeningでランダムに探索することは少なくなっていくと考えます。
それは、前回のターゲットバリデーションでお話しした標的プロテインの機能と、X線などを用いその立体構造から相互作用を行っている部分が詳細にわかると、Screeningに用いる大量の化合物から相互作用の可能性がある化合物をコンピューターで選び出し(ヒットバレデーション)、選ばれた化合物だけをScreeningすることが可能になるからです。 実際、私たちもロシュ・中外製薬時代に標的プロテインのX線から得た詳細な相互作用部分の立体構造を用い、コンピューターでその部分にバインドする化合物を、大量の化合物ライブラリーからヒットバリデーションすると、バインデングする化合物が全体の1%程に絞ることができ、それを化学構造の似異性で分けると構造の異なった数グループに分類でき、その内の1つのグループで11化合物に選択的なバインデング活性があることがわかり、一番活性の高い化合物を創薬のリードとした経験があります。
その後、このリードから医薬候補品が見つかりP1のステージ近くまで開発が進んだのですが、他社で同じ標的ターゲットの先行開発品があり、それより先に先行することが難しいのと、差別化も出来ないので開発を断念しました。その時のこのプロジェクトリーダーは非常に悔しがっていましたが、「今後は標的プロテインのバインデング部位の詳細な解析とコンピューターを用いた低分子創薬探索の時代が来る」と強調していました。
しかし、標的プロテインのバインデング部位の詳細な立体構造が解析できない場合は、ロボットを用いたHT-Screeningに頼るのが現状で、初めに書いたように、長年行ってきた低分子創薬は規格化された方法があり、そのため外注を請け負う会社が存在しており、自社で行うよりもコストパフォーマンスが良いため外注委託をする製薬企業が多くなっています。
一方で、ゲノム解析や臨床プロテオーム解析により疾患の動的バイオマーカーネットワークの解析が進み、その中のターゲットバリデーションから阻害標的プロテイン-プロテインインターラクション(PPI)が見つかった場合、その結合部位は、多くの場合は数個の弱い相互作用するバインデングポケットは存在するが、全体的には低分子創薬の場合より広い面で、電子的相互作用で結合していると考えられています。
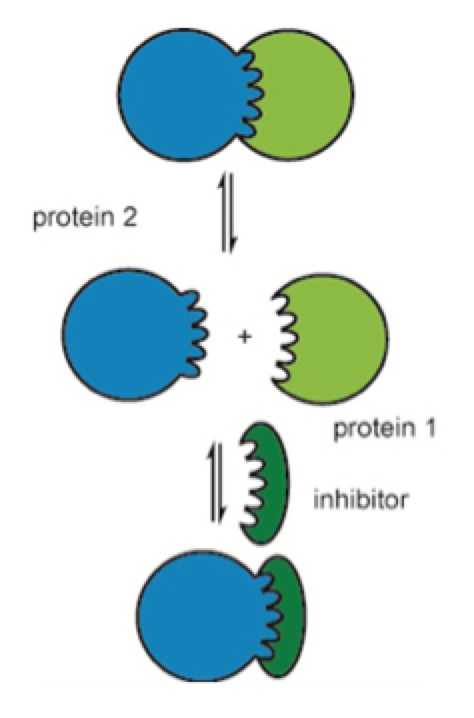
蛋白質間相互作用を阻害するPPI Drug
そこでPPIの阻害剤の探索には中分子有機化合物が良いと言われており、中分子化合物でも薬物の体内動態を考慮するとペプチドに近い化合物が良いのではないかと考えられます。
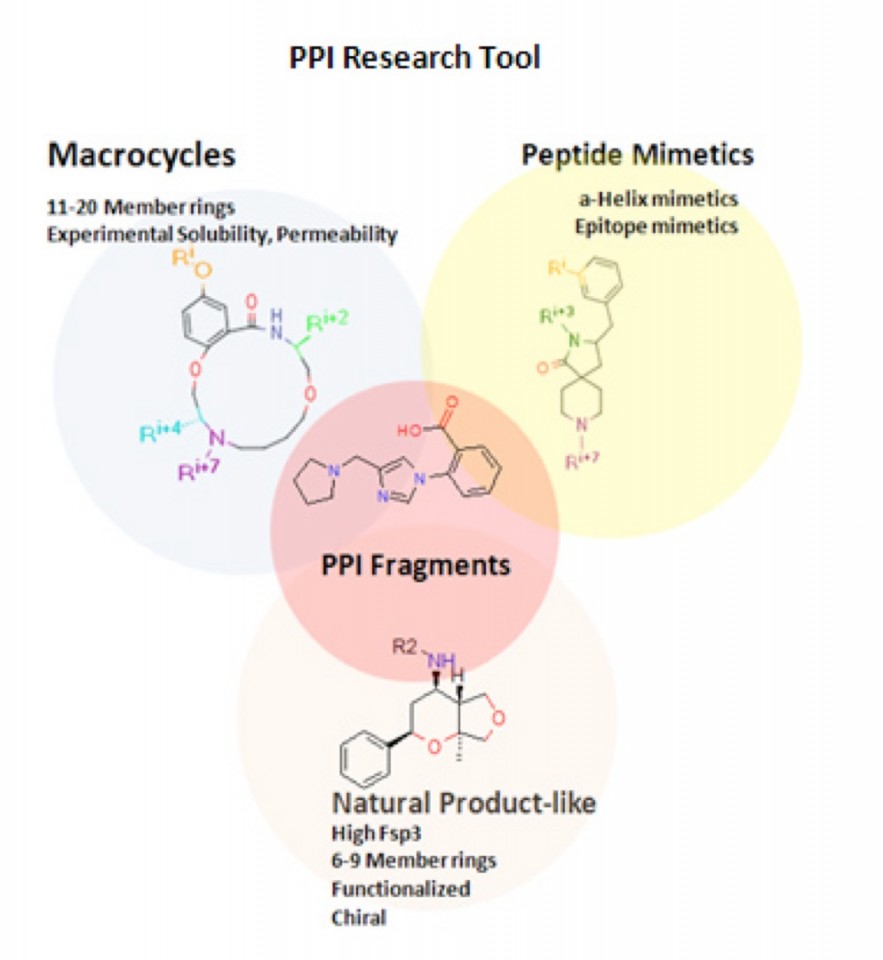
Aroraたちは上記のようにPPI阻害剤としてはMacrocytic PeptideやPeptide Mimetic Compoundを報告しています。これらの化合物は天然物に非常に多く含まれており、生理活性物質を多く含んでいることも報告されています。
しかし、以前に行われていた天然物のScreeningは標的プロテインの活性のON-OFFをする部位をターゲットにしていたため低分子化合物が有効であり、 低分子化合物Screeningでは分子量が500位までが良いというファイザールールが多く適応され、1000以上の分子量の化合物は対象外として排除してきました。ところが実際に天然物のScreeningを行うと非常に高い確率でMacrocytic PeptideやPeptide Mimeticで分子量が1000以上の化合物がヒットしてきます。特に最近の標的プロテインを用いたScreeningよりも、一世代前に行っていた細胞Cellを用いたScreeningで高い確率でした。
そこで、私はPPIを阻害する中分子化合物Screeningのソースとして天然物を用いることが有効であると考えました。
但し、天然物のScreeningには以前の様に活性のある分画を分離精製し構造を決める方法では効率が悪いため、私は以前に「探索的プロテインープロテイン相互作用の解明」のところで紹介したNanopore Optical Interferometry(nPOI)とLC/MS/MSを接続したSkiPr(Silicon Kinetics)と、LC/MS/MSを用いたH/D交換(HDX)方法を有効に使った方が良いと考えています。 nPOIは、天然物の中分子分画を測定し光によるKon,Koffのセンサーグラムの現象が観測されれば、LC/MS/MSに導入しセンサーグラムの現象を起こしている化合物を決定することが可能です。また、複数の化合物がセンサーグラムに関与している場合も、MSで分子量を測定できるので、相互作用をしている全ての化合物をMSのM+1イオンで分離しそれぞれのセンサーグラムをMSで得ることが可能で、それによりバインディング化合物の強さも比較することが出来ます。
この様にnPOIは天然物の中分子化合物Screeningに最適であると考えています。 更に、プロテインープロテイン相互作用(PPI)は上記のように面で相互作用を起こしているので、得られたScreeningで活性中分子化合物がPPIと同様の面で相互作用を起こしているかを明らかにしなければなりません。そこで、LC/MS/MSを用いたH/D交換(HDX)方法を用いるとPPIの相互作用と同一の部位と相互作用を行っているかを検討することができます。 以上が低分子・中分子創薬の創薬リード化合物の探索(Screening)に関しての私の考えです。
しかし、抗体医薬や免疫阻害剤の場合は創薬リード化合物の探索の方法が全く異なり、私もその専門家ではないので、浅はかな知識で自分の考えを話すのは控えます。 次は、Screeningで見つかったリード化合物をどの様に医薬候補品にするかが問題です。どの医薬品も人や動物の体に対しては異物であり、また常に効能と毒性(副作用)を持っていることを考慮しながら医薬候補品にする必要があります。詳しくは次回お話しします。