生命の設計図、遺伝子。その情報が正しく使われるためには、細胞内で日々行われている「RNAスプライシング」という巧妙な“編集作業”が欠かせません。この作業では、遺伝情報が写し取られたメッセンジャーRNAから不要な部分(イントロン)が切り取られ、必要な部分だけが精密につなぎ合わされます。この重要なプロセスを司るのが「スプライソソーム」という巨大な分子機械です。今回、マサチューセッツ工科大学(MIT)の生物学者たちは、このスプライソソームの働きをさらに精密に制御する、これまで知られていなかった新たな調節メカニズムを発見しました。驚くべきことに、この仕組みはヒトの遺伝子の約半数に関与し、動物から植物に至るまで広く存在しているというのです。この発見は、生命の基本的な仕組みであるRNAスプライシングが、私たちの想像以上に複雑で洗練されたものであることを示しています。
「ヒトのようなより複雑な生物におけるスプライシングは、酵母のような一部のモデル生物におけるスプライシングよりも複雑です。これは非常に保存された分子的プロセスであるにもかかわらずです。ヒトのスプライソソームには、特定のイントロンをより効率的に処理するための『付加機能』のようなものがあります。このようなシステムの利点の一つは、より複雑なタイプの遺伝子調節を可能にすることかもしれません」と、MITの大学院生であり、この研究の筆頭著者であるコナー・ケニー氏(Connor Kenny)は述べています。
MITの生物学のアンカス・アンド・ヘレン・ウィタカー記念教授であるクリストファー・バージ博士(Christopher Burge, PhD)が、この研究の責任著者です。この研究は2025年2月20日に「ネイチャー・コミュニケーションズ」誌に掲載されました。このオープンアクセス論文のタイトルは「LUC7 Proteins Define Two Major Classes of 5′ Splice Sites in Animals and Plants(LUC7タンパク質は動物と植物における5ʼスプライス部位の2つの主要なクラスを定義する)」です。
タンパク質の構築
1970年代後半に発見されたRNAスプライシングは、細胞がタンパク質を作るための指示を運ぶmRNA転写産物の内容を正確に制御することを可能にするプロセスです。
各mRNA転写産物には、エクソンとして知られるコード領域と、イントロンとして知られる非コード領域が含まれています。また、スプライシングがどこで起こるべきかのシグナルとして機能する部位も含まれており、これにより細胞は目的のタンパク質のための正しい配列を組み立てることができます。このプロセスにより、単一の遺伝子から複数のタンパク質を産生することが可能になります。進化のタイムスケールでは、異なるエクソンが含まれたり除外されたりすることで、スプライシングは遺伝子やタンパク質のサイズや内容を変化させることもあります。
イントロン上に形成されるスプライソソームは、タンパク質と、低分子核内RNAと呼ばれる非コードRNAから構成されています。スプライソソーム組み立ての最初のステップでは、U1 snRNAとして知られるsnRNA分子がイントロンの始まりにある5ʼスプライス部位(5’ splice site)に結合します。これまでは、5ʼスプライス部位とU1 snRNAとの間の結合の強さが、イントロンがmRNA転写産物からスプライシングされるかどうかを決定する最も重要な要因であると考えられていました。
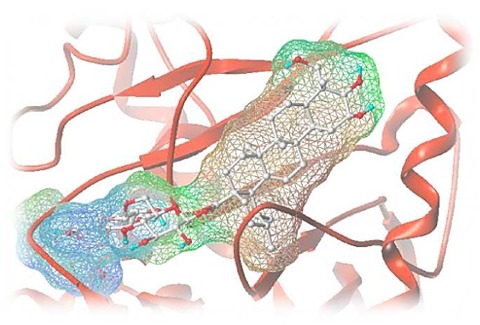
新しい研究で、MITの研究チームは、LUC7と呼ばれるタンパク質ファミリーもスプライシングが起こるかどうかを決定するのに役立つことを発見しましたが、それはイントロンのサブセット(ヒト細胞では最大50%)に対してのみでした。
この研究以前には、LUC7タンパク質がU1 snRNAと結合することは知られていましたが、その正確な機能は明らかではありませんでした。ヒト細胞には3種類の異なるLUC7タンパク質が存在し、ケニー氏の実験により、これらのタンパク質のうち2種類が、研究者らが「右巻き型」と呼ぶ特定のタイプの5ʼスプライス部位と特異的に相互作用することが明らかになりました。3番目のヒトLUC7タンパク質は、研究者らが「左巻き型」と呼ぶ別のタイプと相互作用します。
研究者らは、ヒトのイントロンの約半分が右巻き型または左巻き型の部位を含んでいるのに対し、残り半分はLUC7タンパク質との相互作用によって制御されていないように見えることを発見しました。このタイプの制御は、特定のイントロンをより効率的に除去するのに役立つ、さらなる調節の層を加えているようだと研究者らは述べています。
「この論文は、これら2つの異なる5ʼスプライス部位のサブクラスが存在し、互いに独立して調節されうることを示しています」とケニー氏は言います。「これらの核となるスプライシングプロセスの中には、私たちが以前認識していたよりも実際には複雑なものがあり、これらの高度に保存された分子的プロセスについて私たちが真実だと信じていることを、より注意深く調べる必要があります」。
複雑なスプライシング機構
これまでの研究で、右巻き型スプライス部位に結合するLUC7タンパク質の一つに変異または欠失があると、急性骨髄性白血病(AML: acute myeloid leukemias)の約10%を含む血液がんと関連していることが示されています。今回の研究で、研究者らはLUC7L2遺伝子のコピーを一つ失ったAMLでは、右巻き型スプライス部位のスプライシングが非効率になることを発見しました。これらの白血病はまた、以前の研究で見られたのと同じタイプの代謝変化も示しました。
「一部のAMLにおけるこのLUC7タンパク質の喪失がどのようにスプライシングを変化させるかを理解することは、これらのスプライシングの違いを利用してAMLを治療する療法の設計に役立つ可能性があります」とバージ博士は述べています。「脊髄性筋萎縮症のような他の疾患に対しては、U1 snRNAと特定の5ʼスプライス部位との間の相互作用を安定化させる低分子医薬品も存在します。したがって、特定のLUC7タンパク質が特定の5ʼスプライス部位でこれらの相互作用に影響を与えるという知識は、このクラスの低分子医薬品の特異性を向上させるのに役立つ可能性があります」。
ドイツのマルティン・ルター大学ハレ・ヴィッテンベルク校の教授であるザッシャ・ラウビンガー博士(Sascha Laubinger, PhD)が率いる研究室との共同研究により、研究者らは植物のイントロンにもLuc7タンパク質によって調節される右巻き型および左巻き型の5ʼスプライス部位があることを発見しました。
研究者らの分析は、このタイプのスプライシングが植物、動物、菌類の共通祖先で生じたものの、菌類が植物や動物から分岐した直後に失われたことを示唆しています。
「スプライシングがどのように機能し、その核となる構成要素が何であるかについて私たちが知っていることの多くは、実は比較的古い酵母の遺伝学的研究に由来しています」とケニー氏は言います。「私たちが見ているのは、ヒトや植物はより複雑なスプライシング機構を持ち、異なるイントロンを独立して調節できる追加の構成要素を持っている傾向があるということです」。
研究者らは現在、Luc7タンパク質とmRNAおよびスプライソソームの残りの部分との相互作用によって形成される構造をさらに分析することを計画しており、これにより異なる形態のLuc7が異なる5ʼスプライス部位にどのように結合するかをより詳細に解明するのに役立つ可能性があります。
この記事は、MITのサイエンスライターであるアン・トラフトン氏(Anne Trafton)が執筆したリリースに基づいています。
画像;MIT biologists have discovered that a family of proteins known as Luc7 (shown in blue) is necessary for the accurate splicing of certain mRNA molecules. (Credit: Courtesy of the researchers, edited by MIT News).