創薬研究の革命:100年ぶりに覆された化学の基本ルール
 教科書を書き換える時が来た:UCLA研究者が100年の有機化学ルール「ブレッド則」を覆す
有機化学の世界では、分子構造に関する基本的なルールが約100年にわたり教科書に記載され、科学者たちの研究を方向付けてきました。その一つが「ブレッド則(Bredt’s Rule)」です。しかし、UCLA(カリフォルニア大学ロサンゼルス校)の化学者ニール・ガーグ博士(Neil Garg, PhD)らの研究チームは、このルールが絶対ではなく、むしろ科学的創造性を妨げていると指摘。彼らはこの制約を突破し、「ブレッド則」を破る分子の合成に成功しました。この発見は、有機化学の基礎を再評価し、創薬をはじめとするさまざまな分野で新たな可能性を切り開くものです。
ブレッド則とは?
1924年に報告されたブレッド則は、ブリッジヘッド(分子構造中で環状構造が交わる箇所)に炭素-炭素二重結合(オレフィン)を配置することができないという法則です。このルールは、分子の幾何学的な制約に基づいており、オレフィンがねじれたり歪んだりして、教科書に記載される剛直な構造を維持できなくなるという考えに基づいています。このため、化学者たちはブリッジヘッド上で二重結合を持つ分子の設計や合成を試みることを避けてきました。
発見の背景と意義
ガーグ博士の研究チームは、これまで「不可能」とされてきた反ブレッドオレフィン(anti-Bredt olefins: ABO)と呼ばれる分子の合成を可能にしました。研究者らは、「化学の世界において固定観念に囚われるべきではない。ブレッド則のようなルールは、科学的な想像力を阻害するものだ」と述べています。ガーグ博士らは、「シリル(擬似)ハライド(silyl (pseudo)halides)」と呼ばれる分子をフッ化物源と反応させ、脱離反応を誘導することでABOを形成する方法を開発しまし
教科書を書き換える時が来た:UCLA研究者が100年の有機化学ルール「ブレッド則」を覆す
有機化学の世界では、分子構造に関する基本的なルールが約100年にわたり教科書に記載され、科学者たちの研究を方向付けてきました。その一つが「ブレッド則(Bredt’s Rule)」です。しかし、UCLA(カリフォルニア大学ロサンゼルス校)の化学者ニール・ガーグ博士(Neil Garg, PhD)らの研究チームは、このルールが絶対ではなく、むしろ科学的創造性を妨げていると指摘。彼らはこの制約を突破し、「ブレッド則」を破る分子の合成に成功しました。この発見は、有機化学の基礎を再評価し、創薬をはじめとするさまざまな分野で新たな可能性を切り開くものです。
ブレッド則とは?
1924年に報告されたブレッド則は、ブリッジヘッド(分子構造中で環状構造が交わる箇所)に炭素-炭素二重結合(オレフィン)を配置することができないという法則です。このルールは、分子の幾何学的な制約に基づいており、オレフィンがねじれたり歪んだりして、教科書に記載される剛直な構造を維持できなくなるという考えに基づいています。このため、化学者たちはブリッジヘッド上で二重結合を持つ分子の設計や合成を試みることを避けてきました。
発見の背景と意義
ガーグ博士の研究チームは、これまで「不可能」とされてきた反ブレッドオレフィン(anti-Bredt olefins: ABO)と呼ばれる分子の合成を可能にしました。研究者らは、「化学の世界において固定観念に囚われるべきではない。ブレッド則のようなルールは、科学的な想像力を阻害するものだ」と述べています。ガーグ博士らは、「シリル(擬似)ハライド(silyl (pseudo)halides)」と呼ばれる分子をフッ化物源と反応させ、脱離反応を誘導することでABOを形成する方法を開発しまし
アルテリウイルスが哺乳類細胞に侵入する仕組みを解明!感染予防の可能性を示唆
 アルテリウイルスは、主に非ヒト霊長類、豚、馬などの哺乳類を宿主とするウイルスの一群です。これらのウイルスは、宿主間での感染を引き起こすことで進化し、長期感染を維持しながら宿主間でより病原性を高める能力を持つとされています。一部のアルテリウイルスは、動物に肺炎や妊娠中の流産、さらには出血熱や脳炎などの深刻な病気を引き起こしますが、これまでのところヒトへの感染は確認されていません。
今回の研究では、アルテリウイルスが哺乳類細胞へ侵入し、感染を開始するために利用する重要な受容体タンパク質が特定されました。特に、この受容体に対する既存のモノクローナル抗体が感染を阻止できることが示され、ウイルス感染の予防や治療への新たな可能性が示唆されました。
研究の主な成果
研究チームは、ゲノム全体を対象としたCRISPRノックアウトスクリーニング技術を活用して、アルテリウイルス感染に必須な遺伝子を特定しました。その結果、FCGRTとB2Mという2つの遺伝子が抽出され、これらが共同して細胞表面に発現する新生児Fc受容体(FcRn)を形成することが明らかになりました。このFcRn受容体は、母体から胎児への抗体輸送を担う役割を持つ一方で、免疫細胞や血管内皮細胞にも存在し、アルテリウイルスの感染に利用されることが判明しました。
実験により、FcRnが以下の少なくとも5種類のアルテリウイルスの宿主細胞侵入に関与することが示されました。
サルアルテリウイルスの3つの異なる株豚繁殖呼吸障害症候群ウイルス2(PRRSV-2)馬動脈炎ウイルス(EAV)特に、宿主細胞からFCGRT遺伝子をノックアウトするとウイルス感染が完全に阻害されることが確認されました。また、FcRnに結合するモノクローナル抗体を用いて細胞を前処理することで、感染が防止できることも示されました。
種間感染における遺伝的要因
さ
アルテリウイルスは、主に非ヒト霊長類、豚、馬などの哺乳類を宿主とするウイルスの一群です。これらのウイルスは、宿主間での感染を引き起こすことで進化し、長期感染を維持しながら宿主間でより病原性を高める能力を持つとされています。一部のアルテリウイルスは、動物に肺炎や妊娠中の流産、さらには出血熱や脳炎などの深刻な病気を引き起こしますが、これまでのところヒトへの感染は確認されていません。
今回の研究では、アルテリウイルスが哺乳類細胞へ侵入し、感染を開始するために利用する重要な受容体タンパク質が特定されました。特に、この受容体に対する既存のモノクローナル抗体が感染を阻止できることが示され、ウイルス感染の予防や治療への新たな可能性が示唆されました。
研究の主な成果
研究チームは、ゲノム全体を対象としたCRISPRノックアウトスクリーニング技術を活用して、アルテリウイルス感染に必須な遺伝子を特定しました。その結果、FCGRTとB2Mという2つの遺伝子が抽出され、これらが共同して細胞表面に発現する新生児Fc受容体(FcRn)を形成することが明らかになりました。このFcRn受容体は、母体から胎児への抗体輸送を担う役割を持つ一方で、免疫細胞や血管内皮細胞にも存在し、アルテリウイルスの感染に利用されることが判明しました。
実験により、FcRnが以下の少なくとも5種類のアルテリウイルスの宿主細胞侵入に関与することが示されました。
サルアルテリウイルスの3つの異なる株豚繁殖呼吸障害症候群ウイルス2(PRRSV-2)馬動脈炎ウイルス(EAV)特に、宿主細胞からFCGRT遺伝子をノックアウトするとウイルス感染が完全に阻害されることが確認されました。また、FcRnに結合するモノクローナル抗体を用いて細胞を前処理することで、感染が防止できることも示されました。
種間感染における遺伝的要因
さ
線虫研究から明らかに:まれな遺伝病の新発見
 未解明の病気に新たな光、タンパク質の折りたたみ機能障害による新型遺伝性疾患を発見
ワシントン大学セントルイス校(Washington University School of Medicine in St. Louis)の研究者らは、世界各地の医療チームと協力し、既知の疾患パターンに該当しないまれな遺伝性疾患を持つ子どもの原因を解明しました。この研究は2024年10月31日付けで科学誌Scienceに「Brain Malformations and Seizures by Impaired Chaperonin Function of Tric(脳の奇形とシャペロニン機能障害による発作)」として掲載されました。
子どもの症状の原因を解明し、新たな疾患タイプを特定
この研究では、知的障害、筋緊張低下、小脳の奇形を持つドイツの男児を対象とし、遺伝子変異が神経系やタンパク質折りたたみ機能に与える影響を調べました。この男児にはCCT3遺伝子に変異があり、研究チームはその遺伝的変化が疾患の原因である可能性を探りました。
ワシントン大学のスティーブン・パク博士(Stephen Pak, PhD)は、「多くの重篤でまれな遺伝性疾患の患者が、徹底した医療評価を受けても診断がつかない状況です。今回の研究により、この家族が子どもの病気をより深く理解し、不要な医療検査を避けることが可能になりました」と述べています。
タンパク質折りたたみの役割と疾患の関係
研究では、モデル生物の線虫(C. elegans)を用い、CCT3遺伝子の変異が運動能力や神経系にどのような影響を及ぼすかを解析しました。この遺伝子は、TRIC/CCTシャペロニンと呼ばれるタンパク質折りたたみ機構の一部を形成しており、この機構が正常に機能するには健康なCCT3が一定量必要であることが判明しました。
さらに、ド
未解明の病気に新たな光、タンパク質の折りたたみ機能障害による新型遺伝性疾患を発見
ワシントン大学セントルイス校(Washington University School of Medicine in St. Louis)の研究者らは、世界各地の医療チームと協力し、既知の疾患パターンに該当しないまれな遺伝性疾患を持つ子どもの原因を解明しました。この研究は2024年10月31日付けで科学誌Scienceに「Brain Malformations and Seizures by Impaired Chaperonin Function of Tric(脳の奇形とシャペロニン機能障害による発作)」として掲載されました。
子どもの症状の原因を解明し、新たな疾患タイプを特定
この研究では、知的障害、筋緊張低下、小脳の奇形を持つドイツの男児を対象とし、遺伝子変異が神経系やタンパク質折りたたみ機能に与える影響を調べました。この男児にはCCT3遺伝子に変異があり、研究チームはその遺伝的変化が疾患の原因である可能性を探りました。
ワシントン大学のスティーブン・パク博士(Stephen Pak, PhD)は、「多くの重篤でまれな遺伝性疾患の患者が、徹底した医療評価を受けても診断がつかない状況です。今回の研究により、この家族が子どもの病気をより深く理解し、不要な医療検査を避けることが可能になりました」と述べています。
タンパク質折りたたみの役割と疾患の関係
研究では、モデル生物の線虫(C. elegans)を用い、CCT3遺伝子の変異が運動能力や神経系にどのような影響を及ぼすかを解析しました。この遺伝子は、TRIC/CCTシャペロニンと呼ばれるタンパク質折りたたみ機構の一部を形成しており、この機構が正常に機能するには健康なCCT3が一定量必要であることが判明しました。
さらに、ド
リボソームの謎を解く:基礎生物学から医療応用への新たな展望
 リブソームの驚くべき物語:構造生物学の進化と医療への展望
「パラーデ粒子」という言葉を聞いたことがない人は少なくないでしょう。しかし、これは生物学の基礎を築いた馴染み深い物語の一つです。1950年代、ロックフェラー大学のジョージ・E・パラーデ(George E. Palade)が細胞の細胞質中の膜に付着した密度の高い巨大分子を発見したのが始まりです。彼はその目的を全く理解していませんでしたが、その分子の大きさが重要性を示唆し、またその粒状の外観からサブコンポーネントの集合体であると考えられました。この粒子は後に「リボソーム」と名付けられ、遺伝子コードをタンパク質に翻訳する分子機械であることが判明しました。この発見が1974年のノーベル賞を彼にもたらしました。
リボソーム構造解明への道
その後、リボソームの研究はゆっくりとしたペースで進み、2000年代初頭にようやくX線結晶解析により原核生物のリボソームの3D構造が初めて明らかにされました。しかし、リボソームがどのように組み立てられるのかという根本的な疑問は解明されず、構造生物学における最大の課題の一つであり続けました。ロックフェラー大学のセバスチャン・クリンゲ博士(Sebastian Klinge, PhD)は、「パラーデの発見から比較的最近まで、真核生物におけるリボソームの組み立てについてはほとんど何も分かっていなかった」と語っています。
2013年に同大学に加わったクリンゲ博士は、過去10年間にわたりリボソームの構造を解明することで、この分野の第一人者となっています。約200種類のリボソーム組立因子の働きを解明し、これまで未知であった多くの因子を特定しました。この研究は、リボソームという唯一知られている有機的な分子機械がどのように自己組織化されるかという根本的な謎に迫るものであり、同時に人間の健康にも大きな影
リブソームの驚くべき物語:構造生物学の進化と医療への展望
「パラーデ粒子」という言葉を聞いたことがない人は少なくないでしょう。しかし、これは生物学の基礎を築いた馴染み深い物語の一つです。1950年代、ロックフェラー大学のジョージ・E・パラーデ(George E. Palade)が細胞の細胞質中の膜に付着した密度の高い巨大分子を発見したのが始まりです。彼はその目的を全く理解していませんでしたが、その分子の大きさが重要性を示唆し、またその粒状の外観からサブコンポーネントの集合体であると考えられました。この粒子は後に「リボソーム」と名付けられ、遺伝子コードをタンパク質に翻訳する分子機械であることが判明しました。この発見が1974年のノーベル賞を彼にもたらしました。
リボソーム構造解明への道
その後、リボソームの研究はゆっくりとしたペースで進み、2000年代初頭にようやくX線結晶解析により原核生物のリボソームの3D構造が初めて明らかにされました。しかし、リボソームがどのように組み立てられるのかという根本的な疑問は解明されず、構造生物学における最大の課題の一つであり続けました。ロックフェラー大学のセバスチャン・クリンゲ博士(Sebastian Klinge, PhD)は、「パラーデの発見から比較的最近まで、真核生物におけるリボソームの組み立てについてはほとんど何も分かっていなかった」と語っています。
2013年に同大学に加わったクリンゲ博士は、過去10年間にわたりリボソームの構造を解明することで、この分野の第一人者となっています。約200種類のリボソーム組立因子の働きを解明し、これまで未知であった多くの因子を特定しました。この研究は、リボソームという唯一知られている有機的な分子機械がどのように自己組織化されるかという根本的な謎に迫るものであり、同時に人間の健康にも大きな影
カメのゲノム構造で明らかにされた進化の謎:医療応用への可能性
 DNA分子は長いヌクレオチド配列の中に、生物がどのように機能すべきかを指示する遺伝情報の膨大な蓄えを保持しており、「生命の設計図」と呼ばれています。しかし、この設計図がどのように保存されているかが、情報の読み取り方や使用方法に影響を与えます。細胞が分裂して複製を繰り返す際、DNAはタンパク質(クロマチン)に巻き付けられて緊密に束ねられた染色体として存在します。分裂後には、染色体が緩まり、クロマチンはより疎な状態になります。このクロマチン繊維がどのように折りたたまれ、ループ構造を形成するかが、遺伝子の活性化に影響を与えます。アイオワ州立大学を中心とした研究チームの新しい発見は、このプロセスの理解を深め、将来的に医療分野での応用が期待されています。
クロマチンの3次元構造とその重要性
「クロマチンの折りたたまれた3次元構造は、遺伝子制御において重要です。クロマチンが細胞核内で物理的にどこに位置するかも重要な要素です。クロマチン折りたたみパターンの進化は、ゲノム機能や発達プログラムを変化させ、表現型の進化や環境への適応を促します」と、アイオワ州立大学生態・進化・生物学教授のニコール・バレンスエラ博士(Nicole Valenzuela, PhD)は述べています。「染色体の折りたたみは未だに謎が多い分野で、これまで多くのことを学んできましたが、まだ氷山の一角に過ぎません。」
細胞分裂後の細胞周期の間期における染色体の形状と位置は、遺伝子機能に影響を与えます。例えば、エンハンサー配列と遺伝子プロモーターのような非隣接領域が接触することで、遺伝子が活性化されることがあります。また、活性化されたクロマチン領域内で相互作用可能なDNAは発現されやすい一方で、アクセスしにくい抑制されたクロマチン内のDNAはサイレンシングされます。
カメのゲノム構造における驚きの発見
2024年
DNA分子は長いヌクレオチド配列の中に、生物がどのように機能すべきかを指示する遺伝情報の膨大な蓄えを保持しており、「生命の設計図」と呼ばれています。しかし、この設計図がどのように保存されているかが、情報の読み取り方や使用方法に影響を与えます。細胞が分裂して複製を繰り返す際、DNAはタンパク質(クロマチン)に巻き付けられて緊密に束ねられた染色体として存在します。分裂後には、染色体が緩まり、クロマチンはより疎な状態になります。このクロマチン繊維がどのように折りたたまれ、ループ構造を形成するかが、遺伝子の活性化に影響を与えます。アイオワ州立大学を中心とした研究チームの新しい発見は、このプロセスの理解を深め、将来的に医療分野での応用が期待されています。
クロマチンの3次元構造とその重要性
「クロマチンの折りたたまれた3次元構造は、遺伝子制御において重要です。クロマチンが細胞核内で物理的にどこに位置するかも重要な要素です。クロマチン折りたたみパターンの進化は、ゲノム機能や発達プログラムを変化させ、表現型の進化や環境への適応を促します」と、アイオワ州立大学生態・進化・生物学教授のニコール・バレンスエラ博士(Nicole Valenzuela, PhD)は述べています。「染色体の折りたたみは未だに謎が多い分野で、これまで多くのことを学んできましたが、まだ氷山の一角に過ぎません。」
細胞分裂後の細胞周期の間期における染色体の形状と位置は、遺伝子機能に影響を与えます。例えば、エンハンサー配列と遺伝子プロモーターのような非隣接領域が接触することで、遺伝子が活性化されることがあります。また、活性化されたクロマチン領域内で相互作用可能なDNAは発現されやすい一方で、アクセスしにくい抑制されたクロマチン内のDNAはサイレンシングされます。
カメのゲノム構造における驚きの発見
2024年
ショウジョウバエの行動可塑性:環境適応を支えるPdf遺伝子の謎
 ショウジョウバエの行動柔軟性:日照時間変動への適応を支える遺伝子の役割を解明
2024年10月16日、スイス・ローザンヌ大学(UNIL)生物学・医学学部統合ゲノミクスセンターのリチャード・ベントン博士(Richard Benton, PhD)とその研究チームが発表した論文が、ショウジョウバエが日照時間の変動にどのように適応するかを探る研究を明らかにしました。この論文は、「Circadian Plasticity Evolves Through Regulatory Changes in a Neuropeptide Gene(神経ペプチド遺伝子の調節変化を通じて進化する概日可塑性)」というタイトルで、オープンアクセス形式で雑誌 Nature に掲載されています。
地球上で広く分布する種、例えば人間を含む生物は、多様な環境変動に直面し、それに適応する柔軟性、すなわち「可塑性」によってそれを乗り越えています。この適応能力は生存にとって不可欠ですが、その分子メカニズムについては依然として解明が不十分です。本研究は、遺伝子と神経系が行動可塑性をどのように調整しているのかを解読し、環境変化に対応する広域分布種の進化や気候変動への適応を理解する上で重要な手がかりを提供します。
概日リズムの適応:ショウジョウバエ2種の比較
日照時間は季節や緯度によって変動する重要な環境要因です。特定のショウジョウバエ種は、この日照時間の変動に応じて概日リズム(1日の活動サイクル)を調整します。研究チームは、世界中に広く分布するショウジョウバエ Drosophila melanogaster(ミバエ)と、赤道近くのセーシェル諸島に生息する Drosophila sechellia(セーシェルショウジョウバエ)を比較しました。後者は12時間の一定した日照条件に適応しており、日照時間が長くなる環境
ショウジョウバエの行動柔軟性:日照時間変動への適応を支える遺伝子の役割を解明
2024年10月16日、スイス・ローザンヌ大学(UNIL)生物学・医学学部統合ゲノミクスセンターのリチャード・ベントン博士(Richard Benton, PhD)とその研究チームが発表した論文が、ショウジョウバエが日照時間の変動にどのように適応するかを探る研究を明らかにしました。この論文は、「Circadian Plasticity Evolves Through Regulatory Changes in a Neuropeptide Gene(神経ペプチド遺伝子の調節変化を通じて進化する概日可塑性)」というタイトルで、オープンアクセス形式で雑誌 Nature に掲載されています。
地球上で広く分布する種、例えば人間を含む生物は、多様な環境変動に直面し、それに適応する柔軟性、すなわち「可塑性」によってそれを乗り越えています。この適応能力は生存にとって不可欠ですが、その分子メカニズムについては依然として解明が不十分です。本研究は、遺伝子と神経系が行動可塑性をどのように調整しているのかを解読し、環境変化に対応する広域分布種の進化や気候変動への適応を理解する上で重要な手がかりを提供します。
概日リズムの適応:ショウジョウバエ2種の比較
日照時間は季節や緯度によって変動する重要な環境要因です。特定のショウジョウバエ種は、この日照時間の変動に応じて概日リズム(1日の活動サイクル)を調整します。研究チームは、世界中に広く分布するショウジョウバエ Drosophila melanogaster(ミバエ)と、赤道近くのセーシェル諸島に生息する Drosophila sechellia(セーシェルショウジョウバエ)を比較しました。後者は12時間の一定した日照条件に適応しており、日照時間が長くなる環境
緑内障治療薬が認知症治療の鍵に:メタゾラミドがタウ蛋白を抑制する仕組みを解明
 グラウコーマ治療薬がアルツハイマー病を含む認知症の新たな治療法に:メタゾラミドがタウ蛋白蓄積を抑制する可能性
グラウコーマ(緑内障)治療薬として広く使用されているメタゾラミドが、認知症やアルツハイマー病に関与する脳内のタウ蛋白蓄積を防ぐ可能性があることが、イギリスのケンブリッジ大学認知症研究所による新たな研究で示されました。この研究では、遺伝子操作を施したゼブラフィッシュやマウスモデルを用いて、メタゾラミドを含む炭酸脱水酵素阻害剤がタウ蛋白の蓄積を抑制し、疾患の進行を軽減する効果が明らかになりました。研究結果は、2024年10月31日に「Nature Chemical Biology」に公開されました。論文のタイトルは「Carbonic Anhydrase Inhibition Ameliorates Tau Toxicity Via Enhanced Tau Secretion(炭酸脱水酵素阻害によるタウ毒性の緩和:タウ分泌の促進を介して)」です。
タウオパチーと疾患背景
タウオパチーとは、神経細胞内にタウ蛋白の「凝集体」が蓄積することで進行する神経変性疾患の総称です。これには、認知症、ピック病、進行性核上性麻痺などの疾患が含まれます。また、アルツハイマー病や慢性外傷性脳症(CTE:頭部外傷の繰り返しにより発症する神経変性、例としてフットボールやラグビー選手の報告あり)でもタウ蛋白の蓄積が見られます。これらの疾患の治療において、効果的な薬剤の開発は進んでおらず、新たな治療法の探索が急務とされています。特に既存薬の再利用(リポジショニング)は、治療薬開発のスピードを加速させる有望な戦略とされています。
ゼブラフィッシュを活用した大規模スクリーニング
研究チームは、人間のタウオパチーを模倣するよう遺伝子操作を施したゼブラフィッシュを用い、1,437種類の既存薬を
グラウコーマ治療薬がアルツハイマー病を含む認知症の新たな治療法に:メタゾラミドがタウ蛋白蓄積を抑制する可能性
グラウコーマ(緑内障)治療薬として広く使用されているメタゾラミドが、認知症やアルツハイマー病に関与する脳内のタウ蛋白蓄積を防ぐ可能性があることが、イギリスのケンブリッジ大学認知症研究所による新たな研究で示されました。この研究では、遺伝子操作を施したゼブラフィッシュやマウスモデルを用いて、メタゾラミドを含む炭酸脱水酵素阻害剤がタウ蛋白の蓄積を抑制し、疾患の進行を軽減する効果が明らかになりました。研究結果は、2024年10月31日に「Nature Chemical Biology」に公開されました。論文のタイトルは「Carbonic Anhydrase Inhibition Ameliorates Tau Toxicity Via Enhanced Tau Secretion(炭酸脱水酵素阻害によるタウ毒性の緩和:タウ分泌の促進を介して)」です。
タウオパチーと疾患背景
タウオパチーとは、神経細胞内にタウ蛋白の「凝集体」が蓄積することで進行する神経変性疾患の総称です。これには、認知症、ピック病、進行性核上性麻痺などの疾患が含まれます。また、アルツハイマー病や慢性外傷性脳症(CTE:頭部外傷の繰り返しにより発症する神経変性、例としてフットボールやラグビー選手の報告あり)でもタウ蛋白の蓄積が見られます。これらの疾患の治療において、効果的な薬剤の開発は進んでおらず、新たな治療法の探索が急務とされています。特に既存薬の再利用(リポジショニング)は、治療薬開発のスピードを加速させる有望な戦略とされています。
ゼブラフィッシュを活用した大規模スクリーニング
研究チームは、人間のタウオパチーを模倣するよう遺伝子操作を施したゼブラフィッシュを用い、1,437種類の既存薬を
星間雲に発見されたパイレン:太陽系の炭素起源を解明
 太陽系形成の手がかり:遠方の星間雲でパイレンの豊富な存在を発見
MITの研究者らを中心とするチームは、遠方の星間雲に多量のパイレン(pyrene)が存在することを発見しました。パイレンは、多環芳香族炭化水素(PAH)と呼ばれる炭素を多く含む分子の一種です。この星間雲は、かつて私たちの太陽系を構成した塵とガスの集合体に似ており、この発見は、パイレンが太陽系内の炭素の重要な起源である可能性を示唆しています。この仮説は、近地球小惑星「リュウグウ」から回収されたサンプルにも大量のパイレンが含まれていたという最近の発見によっても支持されています。
星間分子の新たな発見
この研究は、MIT化学科の助教授ブレット・マクガイア博士(Brett McGuire, PhD)を中心に行われました。同氏は、「星や惑星の形成における大きな疑問は、初期の分子雲からどれだけの化学物質が引き継がれ、それが太陽系の基本的な構成要素を形成するかということです。私たちは始まりと終わりを比較し、同じものが見えている。それは、初期の分子雲の物質が氷、塵、岩石へと引き継がれた強力な証拠です」と述べています。
パイレンの検出:科学的挑戦
パイレンはその対称性のため、従来の星間分子の検出に用いられてきた電波天文学技術では直接検出できません。その代わり、研究者たちはシアン化パイレンという異性体を検出しました。これは、シアン化物が結合することでパイレンの対称性が破壊された分子です。この分子は、西バージニア州にあるグリーンバンク天文台の100メートル電波望遠鏡(GBT)を使用して、遠方の星間雲TMC-1で発見されました。この発見に関する論文は、2024年10月24日付のScience誌に「Detection of Interstellar 1-Cyanopyrene: A Four-Ring Polycyclic
太陽系形成の手がかり:遠方の星間雲でパイレンの豊富な存在を発見
MITの研究者らを中心とするチームは、遠方の星間雲に多量のパイレン(pyrene)が存在することを発見しました。パイレンは、多環芳香族炭化水素(PAH)と呼ばれる炭素を多く含む分子の一種です。この星間雲は、かつて私たちの太陽系を構成した塵とガスの集合体に似ており、この発見は、パイレンが太陽系内の炭素の重要な起源である可能性を示唆しています。この仮説は、近地球小惑星「リュウグウ」から回収されたサンプルにも大量のパイレンが含まれていたという最近の発見によっても支持されています。
星間分子の新たな発見
この研究は、MIT化学科の助教授ブレット・マクガイア博士(Brett McGuire, PhD)を中心に行われました。同氏は、「星や惑星の形成における大きな疑問は、初期の分子雲からどれだけの化学物質が引き継がれ、それが太陽系の基本的な構成要素を形成するかということです。私たちは始まりと終わりを比較し、同じものが見えている。それは、初期の分子雲の物質が氷、塵、岩石へと引き継がれた強力な証拠です」と述べています。
パイレンの検出:科学的挑戦
パイレンはその対称性のため、従来の星間分子の検出に用いられてきた電波天文学技術では直接検出できません。その代わり、研究者たちはシアン化パイレンという異性体を検出しました。これは、シアン化物が結合することでパイレンの対称性が破壊された分子です。この分子は、西バージニア州にあるグリーンバンク天文台の100メートル電波望遠鏡(GBT)を使用して、遠方の星間雲TMC-1で発見されました。この発見に関する論文は、2024年10月24日付のScience誌に「Detection of Interstellar 1-Cyanopyrene: A Four-Ring Polycyclic
胎児期の脳内遺伝子編集:新たなmRNAデリバリー技術で神経発達障害を克服
 胎児期の脳内遺伝子編集の可能性を開拓:新たなmRNAデリバリー技術が示す希望
新たな研究で、発達中の胎児脳細胞に遺伝物質を送達し、欠陥のある遺伝子を編集するバイオメディカルツールがマウスモデルで成功したことが示されました。この技術は、アンジェルマン症候群やレット症候群などの遺伝性神経発達障害の進行を出生前に食い止める可能性を秘めています。この研究を主導したのは、カリフォルニア大学デービス校(UC Davis)で外科学および生物医学工学を担当する教授、アイジュン・ワン博士(Aijun Wang, PhD)です。「このツールが神経発達障害の治療に与える影響は極めて大きいです。脳の重要な発達期に遺伝子異常を根本的に修正することが可能になるかもしれません」とワン博士は述べています。
本研究は、ワン研究室とカリフォルニア大学バークレー校(UC Berkeley)のマーティ研究室との共同研究であり、その成果は2024年10月24日付けの『ACS Nano』に「Widespread Gene Editing in the Brain via In Utero Delivery of mRNA Using Acid-Degradable Lipid Nanoparticles(酸分解性脂質ナノ粒子を用いたmRNAの胎内送達による脳の広範な遺伝子編集)」というタイトルで公開されました。
胎内での遺伝子治療:新しい技術の可能性
この技術は、胎児期における神経発達障害の進行を防ぐことを目的としており、出生前診断で検出可能な遺伝的疾患への応用が期待されています。治療を胎内で実施することで、細胞が発達・成熟する段階で生じるさらなる損傷を回避する可能性があります。
革新的なmRNAデリバリー法
体内の機能に不可欠なタンパク質は、遺伝子がコードする指令によって産生されます。遺伝的疾患では
胎児期の脳内遺伝子編集の可能性を開拓:新たなmRNAデリバリー技術が示す希望
新たな研究で、発達中の胎児脳細胞に遺伝物質を送達し、欠陥のある遺伝子を編集するバイオメディカルツールがマウスモデルで成功したことが示されました。この技術は、アンジェルマン症候群やレット症候群などの遺伝性神経発達障害の進行を出生前に食い止める可能性を秘めています。この研究を主導したのは、カリフォルニア大学デービス校(UC Davis)で外科学および生物医学工学を担当する教授、アイジュン・ワン博士(Aijun Wang, PhD)です。「このツールが神経発達障害の治療に与える影響は極めて大きいです。脳の重要な発達期に遺伝子異常を根本的に修正することが可能になるかもしれません」とワン博士は述べています。
本研究は、ワン研究室とカリフォルニア大学バークレー校(UC Berkeley)のマーティ研究室との共同研究であり、その成果は2024年10月24日付けの『ACS Nano』に「Widespread Gene Editing in the Brain via In Utero Delivery of mRNA Using Acid-Degradable Lipid Nanoparticles(酸分解性脂質ナノ粒子を用いたmRNAの胎内送達による脳の広範な遺伝子編集)」というタイトルで公開されました。
胎内での遺伝子治療:新しい技術の可能性
この技術は、胎児期における神経発達障害の進行を防ぐことを目的としており、出生前診断で検出可能な遺伝的疾患への応用が期待されています。治療を胎内で実施することで、細胞が発達・成熟する段階で生じるさらなる損傷を回避する可能性があります。
革新的なmRNAデリバリー法
体内の機能に不可欠なタンパク質は、遺伝子がコードする指令によって産生されます。遺伝的疾患では
アルツハイマー病治療に新たな希望:アミロイドβ線維成長停止メカニズムを解明
 アルツハイマー病の新たな治療標的を発見:アミロイドβ線維成長の分子メカニズム解明
アルツハイマー病に密接に関連するアミロイドβ(Aβ)線維の成長メカニズムが、国内外の複数の研究機関による共同研究で新たに解明されました。この研究には、生命創成探究センター(Exploratory Research Center on Life and Living Systems)、分子科学研究所(Institute for Molecular Science of National Institutes of Natural Sciences)、名古屋市立大学、名古屋大学、および筑波大学の研究者が参加しています。研究チームは、高速原子間力顕微鏡(HS-AFM)という先端技術を用い、Aβ線維の成長過程を分子レベルでリアルタイムに観察しました。この成果は、線維の成長を効果的に阻止する可能性を示す重要な手掛かりを提供します。
アルツハイマー病とアミロイドβ線維の関係
アルツハイマー病は、認知機能の低下や記憶喪失を引き起こす深刻な神経変性疾患です。その主な原因の一つとされるのが、脳内に蓄積するAβタンパク質です。このタンパク質は凝集し、線維状の構造を形成することで脳の機能を妨げます。しかし、これまでAβ線維がどのように成長し、その進行をどのように阻止できるかについては不明な点が多く残されていました。
研究の主な成果
研究チームは、Aβ線維がプロトフィラメントと呼ばれる2本の細い鎖から構成されることを明らかにしました。これらのプロトフィラメントは交互に成長し、個々のAβ分子が一度に1つずつそれぞれの端に付加されます。また、特筆すべき発見として、プロトフィラメントの端が整列すると、線維が一時的に成長を停止する「休止状態」に入ることが分かりました。この「休止状態」は、Aβ線維形成の重要なステ
アルツハイマー病の新たな治療標的を発見:アミロイドβ線維成長の分子メカニズム解明
アルツハイマー病に密接に関連するアミロイドβ(Aβ)線維の成長メカニズムが、国内外の複数の研究機関による共同研究で新たに解明されました。この研究には、生命創成探究センター(Exploratory Research Center on Life and Living Systems)、分子科学研究所(Institute for Molecular Science of National Institutes of Natural Sciences)、名古屋市立大学、名古屋大学、および筑波大学の研究者が参加しています。研究チームは、高速原子間力顕微鏡(HS-AFM)という先端技術を用い、Aβ線維の成長過程を分子レベルでリアルタイムに観察しました。この成果は、線維の成長を効果的に阻止する可能性を示す重要な手掛かりを提供します。
アルツハイマー病とアミロイドβ線維の関係
アルツハイマー病は、認知機能の低下や記憶喪失を引き起こす深刻な神経変性疾患です。その主な原因の一つとされるのが、脳内に蓄積するAβタンパク質です。このタンパク質は凝集し、線維状の構造を形成することで脳の機能を妨げます。しかし、これまでAβ線維がどのように成長し、その進行をどのように阻止できるかについては不明な点が多く残されていました。
研究の主な成果
研究チームは、Aβ線維がプロトフィラメントと呼ばれる2本の細い鎖から構成されることを明らかにしました。これらのプロトフィラメントは交互に成長し、個々のAβ分子が一度に1つずつそれぞれの端に付加されます。また、特筆すべき発見として、プロトフィラメントの端が整列すると、線維が一時的に成長を停止する「休止状態」に入ることが分かりました。この「休止状態」は、Aβ線維形成の重要なステ
進化の成功は共存にあり?昆虫を分け合う真菌の驚くべき戦略
 昆虫を分け合う病原菌:競争より共存で進化の成功を収めた真菌
メリーランド大学の昆虫学者らが、昆虫に侵入し、寄生し、効率的に殺すことで知られる2種の真菌が、資源を巡って争うのではなく、平和的に共存しながら被害者を分け合う独特の関係を発見しました。この研究成果は、2024年11月7日にPLoS Pathogensに掲載され、論文タイトルは「Metarhizium Fight Club: Within-Host Competitive Exclusion and Resource Partitioning(メタリジウム・ファイトクラブ:宿主内競争的排除と資源分配)」です。
研究を主導したのは、メリーランド大学の昆虫学の著名教授であるレイモンド・セント・レジャー博士(Raymond St. Leger, PhD)と、昆虫学博士課程の学生であるシン・フイユ(Huiyu Sheng)氏です。
進化の成功:競争ではなく分配
「自然界の進化的成功において、必ずしも強者が生き残るわけではありません。時には『共存できる者』が生き残ることもあります」とセント・レジャー博士は述べています。今回の研究で明らかになったのは、これらの真菌が互いを排除するのではなく、洗練された共存の方法を進化させてきたという事実です。
研究対象となったのは、Metarhizium 属の2種の真菌で、この属の真菌は世界中の土壌に存在します。この真菌群は植物を乾燥や栄養不足といった非生物的ストレスや害虫から守る役割を果たしており、「キーストーン種」とも呼ばれます。そのため、今回の発見は、この真菌群が生態系で成功を収めている理由の一端を説明するものとされています。
研究の方法と発見
研究チームは、蛍光タンパク質を利用して真菌を赤や緑に発光させる先進的なイメージング技術を駆使し、真菌が昆虫に侵入・感染し、体内で
昆虫を分け合う病原菌:競争より共存で進化の成功を収めた真菌
メリーランド大学の昆虫学者らが、昆虫に侵入し、寄生し、効率的に殺すことで知られる2種の真菌が、資源を巡って争うのではなく、平和的に共存しながら被害者を分け合う独特の関係を発見しました。この研究成果は、2024年11月7日にPLoS Pathogensに掲載され、論文タイトルは「Metarhizium Fight Club: Within-Host Competitive Exclusion and Resource Partitioning(メタリジウム・ファイトクラブ:宿主内競争的排除と資源分配)」です。
研究を主導したのは、メリーランド大学の昆虫学の著名教授であるレイモンド・セント・レジャー博士(Raymond St. Leger, PhD)と、昆虫学博士課程の学生であるシン・フイユ(Huiyu Sheng)氏です。
進化の成功:競争ではなく分配
「自然界の進化的成功において、必ずしも強者が生き残るわけではありません。時には『共存できる者』が生き残ることもあります」とセント・レジャー博士は述べています。今回の研究で明らかになったのは、これらの真菌が互いを排除するのではなく、洗練された共存の方法を進化させてきたという事実です。
研究対象となったのは、Metarhizium 属の2種の真菌で、この属の真菌は世界中の土壌に存在します。この真菌群は植物を乾燥や栄養不足といった非生物的ストレスや害虫から守る役割を果たしており、「キーストーン種」とも呼ばれます。そのため、今回の発見は、この真菌群が生態系で成功を収めている理由の一端を説明するものとされています。
研究の方法と発見
研究チームは、蛍光タンパク質を利用して真菌を赤や緑に発光させる先進的なイメージング技術を駆使し、真菌が昆虫に侵入・感染し、体内で
腸内生態系の防御メカニズム:細菌の拮抗武器に迫る
 腸内細菌の武器切り替えメカニズムを解明 – シカゴ大学の研究
腸内細菌は遺伝情報を共有することで急速に進化します。その中でも、バクテロイデス目(Bacteroidales)と呼ばれる細菌群は、数百もの遺伝的要素を交換することで知られています。しかし、これらのDNAのやり取りが細菌や宿主にどのような影響を及ぼすのか、まだ詳しく分かっていませんでした。シカゴ大学を中心とした研究チームは、新たな研究で、腸内の代表的な細菌「バクテロイデス・フラジリス(Bacteroides fragilis)」において、大型で普遍的な可動性遺伝因子(Mobile Genetic Element: MGE)が細菌の拮抗的な武器を変化させる仕組みを明らかにしました。
この研究によれば、MGEを取り込んだバクテロイデス・フラジリスは、従来持っていた強力な攻撃手段を停止する一方で、新しい武器を手に入れます。この新しい武器はDNAを提供した菌株には効果がなく、腸内の競争が激しい環境での生存を可能にします。
研究の中心人物と背景この研究を主導したのは、シカゴ大学デュショワ家族研究所(Duchossois Family Institute)の微生物学教授であるローリー・コムストック博士(Laurie Comstock, PhD)です。コムストック博士は、「バクテロイデス目のDNA伝達とその拮抗機構」に10年以上にわたり取り組んできました。「これらの細菌はDNA伝達によって非常に速く進化します。それは驚異的です」と博士は述べています。「ある株が攻撃能力を失っていることは知っていましたが、それが大型の可動性遺伝因子を獲得した結果であると分かったとき、この研究が非常に興味深いものになると確信しました。」この研究成果は、2024年10月24日付けの科学誌Scienceに「A Ubiquitous Mobile
腸内細菌の武器切り替えメカニズムを解明 – シカゴ大学の研究
腸内細菌は遺伝情報を共有することで急速に進化します。その中でも、バクテロイデス目(Bacteroidales)と呼ばれる細菌群は、数百もの遺伝的要素を交換することで知られています。しかし、これらのDNAのやり取りが細菌や宿主にどのような影響を及ぼすのか、まだ詳しく分かっていませんでした。シカゴ大学を中心とした研究チームは、新たな研究で、腸内の代表的な細菌「バクテロイデス・フラジリス(Bacteroides fragilis)」において、大型で普遍的な可動性遺伝因子(Mobile Genetic Element: MGE)が細菌の拮抗的な武器を変化させる仕組みを明らかにしました。
この研究によれば、MGEを取り込んだバクテロイデス・フラジリスは、従来持っていた強力な攻撃手段を停止する一方で、新しい武器を手に入れます。この新しい武器はDNAを提供した菌株には効果がなく、腸内の競争が激しい環境での生存を可能にします。
研究の中心人物と背景この研究を主導したのは、シカゴ大学デュショワ家族研究所(Duchossois Family Institute)の微生物学教授であるローリー・コムストック博士(Laurie Comstock, PhD)です。コムストック博士は、「バクテロイデス目のDNA伝達とその拮抗機構」に10年以上にわたり取り組んできました。「これらの細菌はDNA伝達によって非常に速く進化します。それは驚異的です」と博士は述べています。「ある株が攻撃能力を失っていることは知っていましたが、それが大型の可動性遺伝因子を獲得した結果であると分かったとき、この研究が非常に興味深いものになると確信しました。」この研究成果は、2024年10月24日付けの科学誌Scienceに「A Ubiquitous Mobile
ハンチントン病の新発見:DNA修復経路の異常と新たな治療法の可能性
 ハンチントン病の新たな治療の道:DNA修復センサーPARP1への注目
カナダ、英国、米国の研究者らが行った新しい研究により、ハンチントン病(Huntington Disease, HD)の病態において「ポリADPリボース(PAR)シグナル伝達」が異常をきたしていることが明らかになりました。この発見は、HDに関する理解を深めるだけでなく、承認済みの癌治療薬や新しい治療法の再利用を通じ、HD治療への展望を広げる可能性があります。
治療の未達成と新たなターゲットの必要性
HDは数十年にわたる研究と100件を超える臨床試験を経てもなお、疾患修飾的な治療法が承認されていません。この現状は、新しい治療ターゲットの必要性を示しています。本研究は、DNA損傷センサーである「ポリ(ADPリボース)ポリメラーゼ1(PARP1)」をターゲットとすることで、早期予防治療の新たな可能性を提案します。
特に注目すべき点は、PARP阻害剤が既に癌治療薬として承認されており、一部は他の神経変性疾患の治療法としても検討されている点です。2015年の研究では、PARP1阻害がマウスモデルにおけるHDに対して神経保護効果を示したことが報告されています。今回の研究は、カナダのマックマスター大学生化学・生物医科学部のレイ・トゥルアント博士(Ray Truant PhD)を中心に行われ、2024年9月25日に「PNAS」に「Poly ADP-Ribose Signaling Is Dysregulated in Huntington Disease(ポリADPリボースシグナル伝達はハンチントン病で異常をきたす)」というタイトルで発表されました。
ハンチントン病の背景と課題
HDは、ハンチンチン(HTT)遺伝子のエクソン1におけるシトシン(C)、アデニン(A)、グアニン(G)のコドン繰り返しが拡張するこ
ハンチントン病の新たな治療の道:DNA修復センサーPARP1への注目
カナダ、英国、米国の研究者らが行った新しい研究により、ハンチントン病(Huntington Disease, HD)の病態において「ポリADPリボース(PAR)シグナル伝達」が異常をきたしていることが明らかになりました。この発見は、HDに関する理解を深めるだけでなく、承認済みの癌治療薬や新しい治療法の再利用を通じ、HD治療への展望を広げる可能性があります。
治療の未達成と新たなターゲットの必要性
HDは数十年にわたる研究と100件を超える臨床試験を経てもなお、疾患修飾的な治療法が承認されていません。この現状は、新しい治療ターゲットの必要性を示しています。本研究は、DNA損傷センサーである「ポリ(ADPリボース)ポリメラーゼ1(PARP1)」をターゲットとすることで、早期予防治療の新たな可能性を提案します。
特に注目すべき点は、PARP阻害剤が既に癌治療薬として承認されており、一部は他の神経変性疾患の治療法としても検討されている点です。2015年の研究では、PARP1阻害がマウスモデルにおけるHDに対して神経保護効果を示したことが報告されています。今回の研究は、カナダのマックマスター大学生化学・生物医科学部のレイ・トゥルアント博士(Ray Truant PhD)を中心に行われ、2024年9月25日に「PNAS」に「Poly ADP-Ribose Signaling Is Dysregulated in Huntington Disease(ポリADPリボースシグナル伝達はハンチントン病で異常をきたす)」というタイトルで発表されました。
ハンチントン病の背景と課題
HDは、ハンチンチン(HTT)遺伝子のエクソン1におけるシトシン(C)、アデニン(A)、グアニン(G)のコドン繰り返しが拡張するこ
ゾウがホースでシャワー!道具使用と“いたずら”行動の新発見
 アジアゾウのホースを使ったシャワー行動と巧妙な“いたずら”
動物による道具使用は、人間だけの特権ではありません。チンパンジーが枝を道具として使ったり、イルカやカラス、ゾウがそれぞれ独自の道具使用能力を示していることが知られています。そして今回、2024年11月8日付けのCurrent Biology誌に掲載された論文「Water-Hose Tool Use and Showering Behavior by Asian Elephants(アジアゾウによるホースの道具使用とシャワー行動)」では、ゾウがホースを柔軟なシャワーヘッドとして巧みに使用する能力を明らかにしました。さらに驚きの発見として、他のゾウがそのホースを止める方法を知っており、まるで「いたずら」のような行動をとることが観察されました。
ホースを自在に操るゾウたち
「ゾウのホース使いは見事です」と語るのは、本研究の主任研究者の1人であるベルリン・フンボルト大学のマイケル・ブレヒト博士(Michael Brecht, PhD)。「ゾウの場合、ホースの使い方は個体ごとに大きく異なりますが、中でもメアリー(Mary)というゾウは、シャワーの達人といえます」。研究チームは、ベルリン動物園でメアリーがホースを使ってシャワーを浴びている様子を偶然目撃したことをきっかけにこの研究を始めました。観察を行ったのは同じくフンボルト大学のレナ・カウフマン氏(Lena Kaufmann)で、彼女が撮影した映像を研究チームに共有したことで、詳細な分析が進むことになりました。分析を担当したのは筆頭著者のレア・アーバン氏(Lea Urban)です。
メアリーのシャワーテクニック
研究によれば、メアリーはホースを使って自分の体を効率的にシャワーで洗い流す技術を持っています。ホースの先端近くを握ってシャワーヘッドとして使用し、手足と
アジアゾウのホースを使ったシャワー行動と巧妙な“いたずら”
動物による道具使用は、人間だけの特権ではありません。チンパンジーが枝を道具として使ったり、イルカやカラス、ゾウがそれぞれ独自の道具使用能力を示していることが知られています。そして今回、2024年11月8日付けのCurrent Biology誌に掲載された論文「Water-Hose Tool Use and Showering Behavior by Asian Elephants(アジアゾウによるホースの道具使用とシャワー行動)」では、ゾウがホースを柔軟なシャワーヘッドとして巧みに使用する能力を明らかにしました。さらに驚きの発見として、他のゾウがそのホースを止める方法を知っており、まるで「いたずら」のような行動をとることが観察されました。
ホースを自在に操るゾウたち
「ゾウのホース使いは見事です」と語るのは、本研究の主任研究者の1人であるベルリン・フンボルト大学のマイケル・ブレヒト博士(Michael Brecht, PhD)。「ゾウの場合、ホースの使い方は個体ごとに大きく異なりますが、中でもメアリー(Mary)というゾウは、シャワーの達人といえます」。研究チームは、ベルリン動物園でメアリーがホースを使ってシャワーを浴びている様子を偶然目撃したことをきっかけにこの研究を始めました。観察を行ったのは同じくフンボルト大学のレナ・カウフマン氏(Lena Kaufmann)で、彼女が撮影した映像を研究チームに共有したことで、詳細な分析が進むことになりました。分析を担当したのは筆頭著者のレア・アーバン氏(Lea Urban)です。
メアリーのシャワーテクニック
研究によれば、メアリーはホースを使って自分の体を効率的にシャワーで洗い流す技術を持っています。ホースの先端近くを握ってシャワーヘッドとして使用し、手足と
家族と科学が挑む超希少疾患の解明:CHASERR遺伝子の新発見
 極めて稀な疾患に立ち向かう家族と科学者たちの物語:新たな遺伝性疾患の発見
8歳のエマ・ブロードベント(Emma Broadbent)さんは、重度の脳発達遅延を引き起こす極めて稀な疾患と闘っています。エマさんはこれまでに数百日を病院で過ごし、発達状態は3~5か月齢の乳児にとどまっています。それでも、父ブライアン・ブロードベントさん(Brian Broadbent)は「エマが調子の良いときは、周囲に幸せを分け与えるような存在です」と語り、家族はこの難病に向き合い続けています。
新たな遺伝性疾患の発見
2024年10月23日、マサチューセッツ工科大学・ハーバード大学ブロード研究所、ノースウェスタン大学、ナント大学、ワイツマン科学研究所、ベイラー医科大学からなる国際的な研究チームは、エマさんの病気の原因となる遺伝的変化を特定したことを発表しました。この成果は権威ある医学誌「New England Journal of Medicine」に掲載された論文「Neurodevelopmental Disorder Caused by Deletion of CHASERR, a lncRNA Gene(CHASERRというlncRNA遺伝子の欠失による神経発達障害)」として発表されています。
この研究では、CHASERRと呼ばれる「長鎖非コードRNA(lncRNA)」遺伝子の片方のコピーが欠失することで、隣接するCHD2遺伝子のタンパク質が過剰に生成される仕組みを解明しました。CHD2遺伝子は、これまで不足することで脳発達障害を引き起こすことが知られていましたが、今回の発見により、過剰なCHD2もまた疾患を引き起こすことが判明しました。CHASERR欠損による人間の疾患が確認されたのはこれが初めてであり、非コード領域の重要性を改めて示しています。
家族の尽力と科学者たちの協
極めて稀な疾患に立ち向かう家族と科学者たちの物語:新たな遺伝性疾患の発見
8歳のエマ・ブロードベント(Emma Broadbent)さんは、重度の脳発達遅延を引き起こす極めて稀な疾患と闘っています。エマさんはこれまでに数百日を病院で過ごし、発達状態は3~5か月齢の乳児にとどまっています。それでも、父ブライアン・ブロードベントさん(Brian Broadbent)は「エマが調子の良いときは、周囲に幸せを分け与えるような存在です」と語り、家族はこの難病に向き合い続けています。
新たな遺伝性疾患の発見
2024年10月23日、マサチューセッツ工科大学・ハーバード大学ブロード研究所、ノースウェスタン大学、ナント大学、ワイツマン科学研究所、ベイラー医科大学からなる国際的な研究チームは、エマさんの病気の原因となる遺伝的変化を特定したことを発表しました。この成果は権威ある医学誌「New England Journal of Medicine」に掲載された論文「Neurodevelopmental Disorder Caused by Deletion of CHASERR, a lncRNA Gene(CHASERRというlncRNA遺伝子の欠失による神経発達障害)」として発表されています。
この研究では、CHASERRと呼ばれる「長鎖非コードRNA(lncRNA)」遺伝子の片方のコピーが欠失することで、隣接するCHD2遺伝子のタンパク質が過剰に生成される仕組みを解明しました。CHD2遺伝子は、これまで不足することで脳発達障害を引き起こすことが知られていましたが、今回の発見により、過剰なCHD2もまた疾患を引き起こすことが判明しました。CHASERR欠損による人間の疾患が確認されたのはこれが初めてであり、非コード領域の重要性を改めて示しています。
家族の尽力と科学者たちの協
自己免疫疾患治療の未来:新酵素CU43の画期的な発見
 筋強直症や自己免疫疾患治療への新たな可能性を示す酵素の発見
エモリー大学の研究者を中心とする国際共同研究チームは、2024年10月21日付で科学誌Cellに発表された論文「Potent Efficacy of an Ig-G Specific Endoglycosidase Against IgG-Mediated Pathologies(IgG媒介性疾患に対するIgG特異的エンドグリコシダーゼの強力な有効性)」において、新しい酵素が自己免疫疾患の治療に役立つ可能性を示しました。この研究は、筋強直症(Myasthenia Gravis, MG)のような自己免疫疾患や他のIgG抗体が原因となる疾患(IgG媒介性疾患)の治療において、エンドグリコシダーゼ「CU43」が特に効果的であることをマウスモデルを用いて明らかにしました。
筋強直症とは?
筋強直症は、抗体が神経と筋肉の間の信号伝達を妨げることで、骨格筋の脱力を引き起こす慢性自己免疫疾患です。この疾患では、複視、嚥下困難、さらには深刻な呼吸困難を含むさまざまな症状が現れます。このような自己免疫疾患やIgG抗体の調節ができないことによる他の疾患群を総称して「IgG媒介性疾患」と呼びます。
研究の主な成果
本研究では、CU43という特定の酵素がIgG媒介性疾患の症状を劇的に軽減する可能性があることが分かりました。この酵素は抗体を修飾し、疾患を引き起こさない形に変化させることができます。エモリー大学医学部のエリック・サンドバーグ博士(Eric Sundberg, PhD)は、「ヒトの抗体は病原体との免疫応答において重要な役割を果たす一方で、自己免疫疾患の原因にもなり得ます。この酵素は抗体を修飾し、疾患の原因とならないようにすることが可能です」と述べています。
高い治療効果と低用量の利点
マウスモデルでの実験におい
筋強直症や自己免疫疾患治療への新たな可能性を示す酵素の発見
エモリー大学の研究者を中心とする国際共同研究チームは、2024年10月21日付で科学誌Cellに発表された論文「Potent Efficacy of an Ig-G Specific Endoglycosidase Against IgG-Mediated Pathologies(IgG媒介性疾患に対するIgG特異的エンドグリコシダーゼの強力な有効性)」において、新しい酵素が自己免疫疾患の治療に役立つ可能性を示しました。この研究は、筋強直症(Myasthenia Gravis, MG)のような自己免疫疾患や他のIgG抗体が原因となる疾患(IgG媒介性疾患)の治療において、エンドグリコシダーゼ「CU43」が特に効果的であることをマウスモデルを用いて明らかにしました。
筋強直症とは?
筋強直症は、抗体が神経と筋肉の間の信号伝達を妨げることで、骨格筋の脱力を引き起こす慢性自己免疫疾患です。この疾患では、複視、嚥下困難、さらには深刻な呼吸困難を含むさまざまな症状が現れます。このような自己免疫疾患やIgG抗体の調節ができないことによる他の疾患群を総称して「IgG媒介性疾患」と呼びます。
研究の主な成果
本研究では、CU43という特定の酵素がIgG媒介性疾患の症状を劇的に軽減する可能性があることが分かりました。この酵素は抗体を修飾し、疾患を引き起こさない形に変化させることができます。エモリー大学医学部のエリック・サンドバーグ博士(Eric Sundberg, PhD)は、「ヒトの抗体は病原体との免疫応答において重要な役割を果たす一方で、自己免疫疾患の原因にもなり得ます。この酵素は抗体を修飾し、疾患の原因とならないようにすることが可能です」と述べています。
高い治療効果と低用量の利点
マウスモデルでの実験におい
16世紀の船員の骨に刻まれた歴史:加齢と利き手が骨化学に与える影響を解明
 骨の化学変化と利き手の関係に迫る:16世紀イギリス軍艦メアリー・ローズ号の人骨研究が現代の健康科学に新たな知見を提供
2024年10月30日、英国ランカスター大学のシオナ・シャンクランド博士(Dr. Sheona Shankland)をはじめとする研究チームは、16世紀のイギリス軍艦メアリー・ローズ号から発掘された人骨を用いた新たな研究結果を、オープンアクセスジャーナル「PLOS ONE」に発表しました。論文のタイトルは「Shining Light on the Mary Rose: Identifying Chemical Differences in Human Aging and Handedness in the Clavicles of Sailors Using Raman Spectroscopy(メアリー・ローズ号を照らす光:ラマン分光法を用いた船員の鎖骨における加齢と利き手の化学的差異の特定)」です。
歴史的背景と研究の概要
メアリー・ローズ号はヘンリー8世治下のチューダー王朝海軍の一部であり、1545年7月19日にソレント海戦でフランス艦隊と交戦中に沈没しました。20世紀後半に発掘されたこの船の遺物や乗組員の遺骨は、保存状態が非常に良好で、多くの研究対象となってきました。今回の研究では、この船とともに沈んだ13歳から40歳の12人の男性の骨に焦点を当て、骨の化学的変化が加齢や身体活動にどう影響されるのかを探りました。特に、骨の化学組成がその人のライフスタイルの手がかりとなり得るという仮説を立てています。研究チームは、非破壊的なレーザー技術であるラマン分光法を用いて、人間の鎖骨の有機タンパク質と無機ミネラルの化学組成を分析しました。この手法により、骨の化学的変化を損傷することなく明らかにすることが可能です。
鎖骨化学組成の発見
分析の結果、1
骨の化学変化と利き手の関係に迫る:16世紀イギリス軍艦メアリー・ローズ号の人骨研究が現代の健康科学に新たな知見を提供
2024年10月30日、英国ランカスター大学のシオナ・シャンクランド博士(Dr. Sheona Shankland)をはじめとする研究チームは、16世紀のイギリス軍艦メアリー・ローズ号から発掘された人骨を用いた新たな研究結果を、オープンアクセスジャーナル「PLOS ONE」に発表しました。論文のタイトルは「Shining Light on the Mary Rose: Identifying Chemical Differences in Human Aging and Handedness in the Clavicles of Sailors Using Raman Spectroscopy(メアリー・ローズ号を照らす光:ラマン分光法を用いた船員の鎖骨における加齢と利き手の化学的差異の特定)」です。
歴史的背景と研究の概要
メアリー・ローズ号はヘンリー8世治下のチューダー王朝海軍の一部であり、1545年7月19日にソレント海戦でフランス艦隊と交戦中に沈没しました。20世紀後半に発掘されたこの船の遺物や乗組員の遺骨は、保存状態が非常に良好で、多くの研究対象となってきました。今回の研究では、この船とともに沈んだ13歳から40歳の12人の男性の骨に焦点を当て、骨の化学的変化が加齢や身体活動にどう影響されるのかを探りました。特に、骨の化学組成がその人のライフスタイルの手がかりとなり得るという仮説を立てています。研究チームは、非破壊的なレーザー技術であるラマン分光法を用いて、人間の鎖骨の有機タンパク質と無機ミネラルの化学組成を分析しました。この手法により、骨の化学的変化を損傷することなく明らかにすることが可能です。
鎖骨化学組成の発見
分析の結果、1
葉虫の植物消化の秘密:バクテリア共生と水平遺伝子伝播の役割
 葉虫が植物消化を効率化するために見つけた鍵:バクテリアとの共生と遺伝子の水平伝播
葉虫(リーフビートル)は、50,000種以上の記載種を持つ地球規模で多様な昆虫グループであり、すべての草食性昆虫の約4分の1を占めています。葉虫は、地下の根圏や樹冠、さらには水中までさまざまな環境で植物を食べることが知られています。その中には、コロラドポテトビートルのような農業害虫も含まれます。しかし、葉は消化が難しく、栄養が偏っているため、この昆虫たちの進化的成功は驚くべきものです。マックスプランク化学生態学研究所の昆虫共生学部門とマックスプランク生物学研究所の共生研究グループの研究者らは、葉虫が進化の過程でこのような食性の課題をどのように克服してきたのかを解明しました。
外来遺伝物質の役割を理解する
ほぼすべての葉虫が、植物細胞壁の成分を分解するために必要な酵素を産生する外来遺伝物質を自らのゲノムに取り込んでいます。たとえば、ペクチンを分解する酵素「ペクチナーゼ」は、多くのバクテリアによって代謝されるものの、人間には消化できない食物繊維です。葉虫の約半数は、共生バクテリアと密接に関係しており、これらの共生体が消化酵素を供給することで葉虫の栄養吸収を助けています。また、ビタミンや必須アミノ酸も供給されることがあります。
「これらの消化酵素は葉虫の生存に欠かせません。しかし、どの種が共生バクテリアを必要としているのか、また必要としていないのか、さらにペクチナーゼがどこから来たのかについてはまだ断片的な理解しかありません」と語るのは、研究の筆頭著者であるロイ・キルシュ博士(Roy Kirsch, PhD)です。
ペクチナーゼ進化の動的な歴史
研究チームは、世界中から収集した74種の葉虫を対象に、ゲノムおよびトランスクリプトーム解析を実施しました。この比較解析により、葉虫がどのよう
葉虫が植物消化を効率化するために見つけた鍵:バクテリアとの共生と遺伝子の水平伝播
葉虫(リーフビートル)は、50,000種以上の記載種を持つ地球規模で多様な昆虫グループであり、すべての草食性昆虫の約4分の1を占めています。葉虫は、地下の根圏や樹冠、さらには水中までさまざまな環境で植物を食べることが知られています。その中には、コロラドポテトビートルのような農業害虫も含まれます。しかし、葉は消化が難しく、栄養が偏っているため、この昆虫たちの進化的成功は驚くべきものです。マックスプランク化学生態学研究所の昆虫共生学部門とマックスプランク生物学研究所の共生研究グループの研究者らは、葉虫が進化の過程でこのような食性の課題をどのように克服してきたのかを解明しました。
外来遺伝物質の役割を理解する
ほぼすべての葉虫が、植物細胞壁の成分を分解するために必要な酵素を産生する外来遺伝物質を自らのゲノムに取り込んでいます。たとえば、ペクチンを分解する酵素「ペクチナーゼ」は、多くのバクテリアによって代謝されるものの、人間には消化できない食物繊維です。葉虫の約半数は、共生バクテリアと密接に関係しており、これらの共生体が消化酵素を供給することで葉虫の栄養吸収を助けています。また、ビタミンや必須アミノ酸も供給されることがあります。
「これらの消化酵素は葉虫の生存に欠かせません。しかし、どの種が共生バクテリアを必要としているのか、また必要としていないのか、さらにペクチナーゼがどこから来たのかについてはまだ断片的な理解しかありません」と語るのは、研究の筆頭著者であるロイ・キルシュ博士(Roy Kirsch, PhD)です。
ペクチナーゼ進化の動的な歴史
研究チームは、世界中から収集した74種の葉虫を対象に、ゲノムおよびトランスクリプトーム解析を実施しました。この比較解析により、葉虫がどのよう
潰瘍性大腸炎の重症化を予測する新発見:個別化医療の可能性を広げる
 個別化医療への道を切り開く研究成果:潰瘍性大腸炎の重症度を予測する遺伝子変異を発見
デンマークの研究者らが、潰瘍性大腸炎患者の病状が一部で重症化する理由を解明する重要な発見をしました。この成果は、個々の患者に適した治療法を提供する「個別化医療」に向けた大きな一歩といえます。
潰瘍性大腸炎とは
腹痛、下痢、そして極度の疲労が、慢性的な腸疾患を患う何百万人もの人々の日常生活を支配しています。この疾患は、若年層で診断されることが多く、その進行には大きな個人差があり、患者には将来に対する不安がつきまといます。潰瘍性大腸炎は軽度で管理可能な場合もあれば、頻繁な入院や複雑な薬物治療、さらには複数回の手術が必要となる重症例もあります。
遺伝子変異と病状予測
デンマークのオールボー大学にある「炎症性腸疾患の分子予測センター(PREDICT)」の研究者らは、重症の潰瘍性大腸炎を発症するリスクを予測できる遺伝子変異を特定しました。この研究成果は、2024年10月15日に「Journal of the American Medical Association(JAMA)」に掲載された論文「HLA-DRB1*01:03 and Severe Ulcerative Colitis」で報告されています。
研究のポイント
本研究では、遺伝子データとデンマークの健康記録を分析し、潰瘍性大腸炎患者の約3%が「HLA-DRB1*01:03」という遺伝子変異を持つことを明らかにしました。この変異を持つ患者のうち、診断後3年以内に40%以上が重度の消化器外科手術を受けており、これは変異を持たない患者の9%と比べて顕著に高い割合です。「この遺伝子の存在が、重症化する患者群を特定する重要な手がかりとなります」と、本研究の筆頭著者であるマリー・ヴィベケ・ヴェステルゴー博士(Marie Vibeke V
個別化医療への道を切り開く研究成果:潰瘍性大腸炎の重症度を予測する遺伝子変異を発見
デンマークの研究者らが、潰瘍性大腸炎患者の病状が一部で重症化する理由を解明する重要な発見をしました。この成果は、個々の患者に適した治療法を提供する「個別化医療」に向けた大きな一歩といえます。
潰瘍性大腸炎とは
腹痛、下痢、そして極度の疲労が、慢性的な腸疾患を患う何百万人もの人々の日常生活を支配しています。この疾患は、若年層で診断されることが多く、その進行には大きな個人差があり、患者には将来に対する不安がつきまといます。潰瘍性大腸炎は軽度で管理可能な場合もあれば、頻繁な入院や複雑な薬物治療、さらには複数回の手術が必要となる重症例もあります。
遺伝子変異と病状予測
デンマークのオールボー大学にある「炎症性腸疾患の分子予測センター(PREDICT)」の研究者らは、重症の潰瘍性大腸炎を発症するリスクを予測できる遺伝子変異を特定しました。この研究成果は、2024年10月15日に「Journal of the American Medical Association(JAMA)」に掲載された論文「HLA-DRB1*01:03 and Severe Ulcerative Colitis」で報告されています。
研究のポイント
本研究では、遺伝子データとデンマークの健康記録を分析し、潰瘍性大腸炎患者の約3%が「HLA-DRB1*01:03」という遺伝子変異を持つことを明らかにしました。この変異を持つ患者のうち、診断後3年以内に40%以上が重度の消化器外科手術を受けており、これは変異を持たない患者の9%と比べて顕著に高い割合です。「この遺伝子の存在が、重症化する患者群を特定する重要な手がかりとなります」と、本研究の筆頭著者であるマリー・ヴィベケ・ヴェステルゴー博士(Marie Vibeke V
植物ストレス応答を制御するlncRNAの重要性とは
 植物は、気候条件の変動や栄養制限など、成長や生産性に影響を与えるさまざまな課題に直面しています。従来の研究では、こうしたストレスに対する植物の反応を解明するため、主にタンパク質をコードする遺伝子に焦点が当てられてきました。しかし、次世代シーケンシング技術の進展により、ノンコーディングRNA、特に長鎖ノンコーディングRNA(lncRNA)が植物の基本機能の調節において重要な役割を果たすことが明らかになりました。このため、lncRNAとその調節的役割を深く探ることがますます重要視されています。
中国農業大学のリンリン・ジャン博士(Lingling Zhang, PhD)率いる研究チームは、lncRNAが植物の成長とストレス適応に果たす重要な役割をまとめたレビューを執筆しました。この研究成果は、2023年11月17日に学術誌 Horticulture Researchでオープンアクセスで公開されました(DOI: 10.1093/hr/uhad234)。レビューでは、lncRNAが小型RNAや他のノンコーディングRNAとどのように相互作用するかを探り、新しい調節メカニズムを解明しました。この研究は、lncRNAが環境ストレスに応じた植物の反応を助ける重要な役割を果たすことを強調し、植物科学における新たな視点を提供しています。論文のタイトルは「LncRNAs Exert Indispensable Roles in Orchestrating the Interaction Among Diverse Noncoding RNAs and Enrich the Regulatory Network of Plant Growth and Its Adaptive Environmental Stress Response」(「lncRNAは多様なノンコーディングRNA間の相互作
植物は、気候条件の変動や栄養制限など、成長や生産性に影響を与えるさまざまな課題に直面しています。従来の研究では、こうしたストレスに対する植物の反応を解明するため、主にタンパク質をコードする遺伝子に焦点が当てられてきました。しかし、次世代シーケンシング技術の進展により、ノンコーディングRNA、特に長鎖ノンコーディングRNA(lncRNA)が植物の基本機能の調節において重要な役割を果たすことが明らかになりました。このため、lncRNAとその調節的役割を深く探ることがますます重要視されています。
中国農業大学のリンリン・ジャン博士(Lingling Zhang, PhD)率いる研究チームは、lncRNAが植物の成長とストレス適応に果たす重要な役割をまとめたレビューを執筆しました。この研究成果は、2023年11月17日に学術誌 Horticulture Researchでオープンアクセスで公開されました(DOI: 10.1093/hr/uhad234)。レビューでは、lncRNAが小型RNAや他のノンコーディングRNAとどのように相互作用するかを探り、新しい調節メカニズムを解明しました。この研究は、lncRNAが環境ストレスに応じた植物の反応を助ける重要な役割を果たすことを強調し、植物科学における新たな視点を提供しています。論文のタイトルは「LncRNAs Exert Indispensable Roles in Orchestrating the Interaction Among Diverse Noncoding RNAs and Enrich the Regulatory Network of Plant Growth and Its Adaptive Environmental Stress Response」(「lncRNAは多様なノンコーディングRNA間の相互作
ハンチントン病の発症20年前から始まる脳変化を解明:早期治療への可能性
 ハンチントン病の発症20年前から始まる脳の微細な変化:早期治療への希望
ハンチントン病(の臨床的な運動症状が現れる約20年前に、脳内で微細な変化が始まっていることが、ユニバーシティ・カレッジ・ロンドン(UCL)を中心とした国際研究チームによる新しい研究で明らかになりました。この研究成果は、2025年1月17日に科学誌Nature Medicineに発表されました。論文のタイトルは「Somatic CAG Repeat Expansion in Blood Associates with Biomarkers of Neurodegeneration in Huntington’s Disease Decades Before Clinical Motor Diagnosis(血液中の体細胞CAGリピート拡大がハンチントン病の神経変性バイオマーカーと関連する)」です。
ハンチントン病とは
ハンチントン病は、運動、思考、行動に影響を及ぼす壊滅的な神経変性疾患です。この病気は遺伝性で、親がハンチントン病の遺伝子変異を持つ場合、その子供がその変異を受け継ぐ確率は50%です。症状は通常、中年期に発症します。
疾患の原因は、ハンチンチン遺伝子内で繰り返されるDNA塩基配列(CAG)が異常に拡大することであり、この「体細胞CAGリピート拡大」が神経変性を加速し、脳細胞を脆弱にしていきます。
研究の詳細
研究チームは、ハンチントン病遺伝子変異を持つ57人(平均発症予測23.2年前)を対象に、脳や体内の変化を5年間にわたり追跡しました。また、同年代、性別、教育レベルが一致する46人の対照群と比較しました。
研究では、以下のような重要な発見がありました:
臨床症状: 研究期間中、思考、運動、行動の臨床的機能には明確な低下が見られませんでした。脳と脊髄液の変化: しかし、脳ス
ハンチントン病の発症20年前から始まる脳の微細な変化:早期治療への希望
ハンチントン病(の臨床的な運動症状が現れる約20年前に、脳内で微細な変化が始まっていることが、ユニバーシティ・カレッジ・ロンドン(UCL)を中心とした国際研究チームによる新しい研究で明らかになりました。この研究成果は、2025年1月17日に科学誌Nature Medicineに発表されました。論文のタイトルは「Somatic CAG Repeat Expansion in Blood Associates with Biomarkers of Neurodegeneration in Huntington’s Disease Decades Before Clinical Motor Diagnosis(血液中の体細胞CAGリピート拡大がハンチントン病の神経変性バイオマーカーと関連する)」です。
ハンチントン病とは
ハンチントン病は、運動、思考、行動に影響を及ぼす壊滅的な神経変性疾患です。この病気は遺伝性で、親がハンチントン病の遺伝子変異を持つ場合、その子供がその変異を受け継ぐ確率は50%です。症状は通常、中年期に発症します。
疾患の原因は、ハンチンチン遺伝子内で繰り返されるDNA塩基配列(CAG)が異常に拡大することであり、この「体細胞CAGリピート拡大」が神経変性を加速し、脳細胞を脆弱にしていきます。
研究の詳細
研究チームは、ハンチントン病遺伝子変異を持つ57人(平均発症予測23.2年前)を対象に、脳や体内の変化を5年間にわたり追跡しました。また、同年代、性別、教育レベルが一致する46人の対照群と比較しました。
研究では、以下のような重要な発見がありました:
臨床症状: 研究期間中、思考、運動、行動の臨床的機能には明確な低下が見られませんでした。脳と脊髄液の変化: しかし、脳ス
空間プロテオミクスが中毒性表皮壊死症に新たな治療法を提案
 空間プロテオミクスが中毒性表皮壊死症の治療法を提供する – 世界初の患者でのJAK阻害剤の適応外使用により完全回復
研究者らは、空間プロテオミクスを使用して中毒性表皮壊死症の患者から採取された皮膚サンプルを解析しました。この最先端技術「ディープ・ビジュアル・プロテオミクス」は、高性能顕微鏡とAI駆動の解析、レーザー誘導マイクロダイセクション、そして超高感度質量分析を組み合わせたものです。科学者らは個々の細胞に焦点を当て、これまでにない方法で研究を行い、この致死的な皮膚反応を引き起こす数千ものタンパク質の地図を作成しました。筆頭著者であり、マックス・プランク生化学研究所の臨床科学者兼ミュンヘン大学病院(ルートヴィヒ・マクシミリアン大学ミュンヘン)の上級皮膚科医であるティエリー・ノルドマン博士(Thierry Nordmann, MD, PhD)は次のように説明しています。
「空間プロテオミクスを中毒性表皮壊死症の患者のアーカイブサンプルに適用することで、特定の細胞タイプを正確に分離し解析することができ、患者の皮膚で実際に何が起きているのかを理解することができました。我々はJAK/STAT経路の炎症性過剰活性化を特定し、既にアトピー性皮膚炎や関節リウマチなど他の炎症性疾患の治療に用いられているJAK阻害剤を用いて介入する機会を発見しました。」
中毒性表皮壊死症は、アロプリノール(痛風治療薬)や特定の抗生物質などの一般的な薬物に対する稀で非常に重篤な副作用です。この症状は広範な水疱や皮膚剥離を引き起こし、死亡率は最大30%に達します。一見無害に見える発疹が短時間で生命を脅かす状態に変わります。これまで有効な治療法は存在せず、治療は主に支持療法に限られていました。
新しい治療法への道
研究チームは、さまざまな前臨床研究でその発見を検証しました。これにはin vitro
空間プロテオミクスが中毒性表皮壊死症の治療法を提供する – 世界初の患者でのJAK阻害剤の適応外使用により完全回復
研究者らは、空間プロテオミクスを使用して中毒性表皮壊死症の患者から採取された皮膚サンプルを解析しました。この最先端技術「ディープ・ビジュアル・プロテオミクス」は、高性能顕微鏡とAI駆動の解析、レーザー誘導マイクロダイセクション、そして超高感度質量分析を組み合わせたものです。科学者らは個々の細胞に焦点を当て、これまでにない方法で研究を行い、この致死的な皮膚反応を引き起こす数千ものタンパク質の地図を作成しました。筆頭著者であり、マックス・プランク生化学研究所の臨床科学者兼ミュンヘン大学病院(ルートヴィヒ・マクシミリアン大学ミュンヘン)の上級皮膚科医であるティエリー・ノルドマン博士(Thierry Nordmann, MD, PhD)は次のように説明しています。
「空間プロテオミクスを中毒性表皮壊死症の患者のアーカイブサンプルに適用することで、特定の細胞タイプを正確に分離し解析することができ、患者の皮膚で実際に何が起きているのかを理解することができました。我々はJAK/STAT経路の炎症性過剰活性化を特定し、既にアトピー性皮膚炎や関節リウマチなど他の炎症性疾患の治療に用いられているJAK阻害剤を用いて介入する機会を発見しました。」
中毒性表皮壊死症は、アロプリノール(痛風治療薬)や特定の抗生物質などの一般的な薬物に対する稀で非常に重篤な副作用です。この症状は広範な水疱や皮膚剥離を引き起こし、死亡率は最大30%に達します。一見無害に見える発疹が短時間で生命を脅かす状態に変わります。これまで有効な治療法は存在せず、治療は主に支持療法に限られていました。
新しい治療法への道
研究チームは、さまざまな前臨床研究でその発見を検証しました。これにはin vitro
人食いライオンのDNA解析で明らかになる過去の生態
 過去の捕食行動を解明する新技術:ツァボの「人食いライオン」の食性が明らかに
1890年代ケニアの伝説的ライオンが食べた獲物をDNAで解析
2024年10月11日、Current Biology誌に掲載された論文「Compacted Hair in Broken Teeth Reveals Dietary Prey of Historic Lions(折れた歯に詰まった毛が示す歴史的ライオンの食性)」において、1890年代ケニアのツァボ地域に生息していた「人食いライオン」の食性が明らかになりました。研究者らは、シカゴのフィールド博物館に保管されている2体のライオン標本の歯に詰まった毛からDNAを抽出し、それを解析することで、これらのライオンが人間やキリン、ヌーなど多様な獲物を捕食していたことを突き止めました。
ツァボの「人食いライオン」とは?
ツァボライオンは、19世紀末にケニア・ウガンダ鉄道の建設作業員を含む数十人の人々を襲撃したことで知られる伝説的な存在です。今回の研究で対象となった標本は、歯が部分的に折れ、獲物の毛が歯の空洞に詰まっていた状態でした。この毛から抽出されたDNAにより、当時の捕食行動が詳しく解析されました。
新しい技術と発見
リパン・マリ教授(Ripan Malhi, リパン・マリ教授)(イリノイ大学アーバナ・シャンペーン校)らの研究チームは、毛のDNAを用いた新しい解析手法を開発しました。この手法により、以下のような成果が得られました。
捕食した獲物の種類: キリン(マサイキリン亜種)、人間、オリックス、ウォーターバック、ヌー、シマウマ
DNAの由来: 獲物のDNAに加え、ライオン自身のDNAも特定。特に東アフリカ(ケニアおよびタンザニア)のライオンとの遺伝的類似性が確認されました。地域分布に関する洞察: ヌーがツァボ地域にいた可能性
過去の捕食行動を解明する新技術:ツァボの「人食いライオン」の食性が明らかに
1890年代ケニアの伝説的ライオンが食べた獲物をDNAで解析
2024年10月11日、Current Biology誌に掲載された論文「Compacted Hair in Broken Teeth Reveals Dietary Prey of Historic Lions(折れた歯に詰まった毛が示す歴史的ライオンの食性)」において、1890年代ケニアのツァボ地域に生息していた「人食いライオン」の食性が明らかになりました。研究者らは、シカゴのフィールド博物館に保管されている2体のライオン標本の歯に詰まった毛からDNAを抽出し、それを解析することで、これらのライオンが人間やキリン、ヌーなど多様な獲物を捕食していたことを突き止めました。
ツァボの「人食いライオン」とは?
ツァボライオンは、19世紀末にケニア・ウガンダ鉄道の建設作業員を含む数十人の人々を襲撃したことで知られる伝説的な存在です。今回の研究で対象となった標本は、歯が部分的に折れ、獲物の毛が歯の空洞に詰まっていた状態でした。この毛から抽出されたDNAにより、当時の捕食行動が詳しく解析されました。
新しい技術と発見
リパン・マリ教授(Ripan Malhi, リパン・マリ教授)(イリノイ大学アーバナ・シャンペーン校)らの研究チームは、毛のDNAを用いた新しい解析手法を開発しました。この手法により、以下のような成果が得られました。
捕食した獲物の種類: キリン(マサイキリン亜種)、人間、オリックス、ウォーターバック、ヌー、シマウマ
DNAの由来: 獲物のDNAに加え、ライオン自身のDNAも特定。特に東アフリカ(ケニアおよびタンザニア)のライオンとの遺伝的類似性が確認されました。地域分布に関する洞察: ヌーがツァボ地域にいた可能性
ウエストナイルウイルス重症化の鍵を握る自己抗体—新たな治療への可能性
 ウエストナイルウイルス感染のリスク—自己抗体が重症化の鍵を握る
米国で現在発生中のウエストナイルウイルス(WNV)のアウトブレイクは、46州で880例が報告されています。しかし、この数は氷山の一角に過ぎず、多くの感染者は無症状で知られないまま回復しています。症状が現れるのは感染者の約20%で、そのうち19%が発熱、頭痛、関節痛、発疹、消化器系症状を経験し、1%が脳炎や髄膜炎といった重篤な症状に至ります。この1%の患者では昏睡、けいれん、視力喪失、麻痺、さらには死亡に至る場合もあります。
近年、自己抗体が重症化の原因であることが明らかになり、重症例への新たな理解が進んでいます。ロックフェラー大学のジャン=ローラン・カサノバ博士(Jean-Laurent Casanova, PhD)は、WNV重症例の約40%が「タイプIインターフェロン」に対する自己抗体に関連していることを発見しました。この発見は、WNVのみならず、インフルエンザ肺炎といった他のウイルス感染症にも応用される可能性があります。
自己抗体と免疫反応の破綻
カサノバ博士の研究によれば、自己抗体はタイプIインターフェロンに結合し、その働きを阻害します。本来、これらのインターフェロンはウイルスと戦うために重要なシグナル伝達を担いますが、自己抗体によってその機能が失われると、感染細胞がウイルス増殖を抑える能力が低下します。この結果、WNVや他のウイルスに対して免疫系が十分に対応できず、重症化リスクが高まります。
重症化のリスク層とは?
自己抗体を持つ人は全人口の約1%と推定されていますが、高齢者ではその割合が4%から6%に跳ね上がります。このため、65歳以上の人々は特に重症化リスクが高いとされています。さらに、自己免疫疾患を持つ人々もリスクが高く、これらの人々への血液検査によるスクリーニングの必要性が提言さ
ウエストナイルウイルス感染のリスク—自己抗体が重症化の鍵を握る
米国で現在発生中のウエストナイルウイルス(WNV)のアウトブレイクは、46州で880例が報告されています。しかし、この数は氷山の一角に過ぎず、多くの感染者は無症状で知られないまま回復しています。症状が現れるのは感染者の約20%で、そのうち19%が発熱、頭痛、関節痛、発疹、消化器系症状を経験し、1%が脳炎や髄膜炎といった重篤な症状に至ります。この1%の患者では昏睡、けいれん、視力喪失、麻痺、さらには死亡に至る場合もあります。
近年、自己抗体が重症化の原因であることが明らかになり、重症例への新たな理解が進んでいます。ロックフェラー大学のジャン=ローラン・カサノバ博士(Jean-Laurent Casanova, PhD)は、WNV重症例の約40%が「タイプIインターフェロン」に対する自己抗体に関連していることを発見しました。この発見は、WNVのみならず、インフルエンザ肺炎といった他のウイルス感染症にも応用される可能性があります。
自己抗体と免疫反応の破綻
カサノバ博士の研究によれば、自己抗体はタイプIインターフェロンに結合し、その働きを阻害します。本来、これらのインターフェロンはウイルスと戦うために重要なシグナル伝達を担いますが、自己抗体によってその機能が失われると、感染細胞がウイルス増殖を抑える能力が低下します。この結果、WNVや他のウイルスに対して免疫系が十分に対応できず、重症化リスクが高まります。
重症化のリスク層とは?
自己抗体を持つ人は全人口の約1%と推定されていますが、高齢者ではその割合が4%から6%に跳ね上がります。このため、65歳以上の人々は特に重症化リスクが高いとされています。さらに、自己免疫疾患を持つ人々もリスクが高く、これらの人々への血液検査によるスクリーニングの必要性が提言さ
脳内で新発見:BNC2ニューロンが飢餓を素早く抑制するメカニズム
 飢餓と満腹感の新たな調和:脳内の未知の神経細胞「BNC2ニューロン」が食欲を素早く抑制
お菓子をもう一口食べるか迷っている間、脳内では激しい攻防戦が繰り広げられています。一方の神経細胞群は飢餓を促し、もう一方は満腹感を誘発します。この攻防の勝者が決まる速度によって、あなたがそのスナックを手に取るかどうかが左右されます。今回、科学者らが発見したのは、この食欲と満腹感を制御する神経回路における「失われたピース」とも言える、新たに同定された神経細胞です。この細胞は食欲を即座に抑える役割を果たし、従来のモデルに欠けていた重要な部分を補完するものです。
研究結果は学術誌Natureに掲載され、「Leptin-Activated Hypothalamic BNC2 Neurons Acutely Suppress Food Intake(レプチン活性化視床下部BNC2ニューロンが食欲を即座に抑制する)」というタイトルのオープンアクセス論文として発表されました。
ロックフェラー大学分子遺伝学研究所で研究を行うハン・タン氏(Han Tan)は、「この新しいタイプのニューロンは、摂食の調節方法に関する概念を変える発見です」と述べています。
既存モデルを超えて:迅速な満腹感を誘発する仕組み
これまで脳内の摂食回路は、視床下部に存在する2種類のニューロンによる単純なフィードバックループとして理解されてきました。AGRP遺伝子を発現するニューロンは飢餓を引き起こし、一方、POMC遺伝子を発現するニューロンは満腹感を促します。しかし、これらがレプチン(体重調節に重要なホルモン)の主な標的とされる一方で、近年の研究はこのモデルの不完全さを示唆していました。AGRPニューロンが食欲を迅速に増加させる一方で、POMCニューロンの満腹感誘発は数時間を要するためです。
このギャップを埋める可能
飢餓と満腹感の新たな調和:脳内の未知の神経細胞「BNC2ニューロン」が食欲を素早く抑制
お菓子をもう一口食べるか迷っている間、脳内では激しい攻防戦が繰り広げられています。一方の神経細胞群は飢餓を促し、もう一方は満腹感を誘発します。この攻防の勝者が決まる速度によって、あなたがそのスナックを手に取るかどうかが左右されます。今回、科学者らが発見したのは、この食欲と満腹感を制御する神経回路における「失われたピース」とも言える、新たに同定された神経細胞です。この細胞は食欲を即座に抑える役割を果たし、従来のモデルに欠けていた重要な部分を補完するものです。
研究結果は学術誌Natureに掲載され、「Leptin-Activated Hypothalamic BNC2 Neurons Acutely Suppress Food Intake(レプチン活性化視床下部BNC2ニューロンが食欲を即座に抑制する)」というタイトルのオープンアクセス論文として発表されました。
ロックフェラー大学分子遺伝学研究所で研究を行うハン・タン氏(Han Tan)は、「この新しいタイプのニューロンは、摂食の調節方法に関する概念を変える発見です」と述べています。
既存モデルを超えて:迅速な満腹感を誘発する仕組み
これまで脳内の摂食回路は、視床下部に存在する2種類のニューロンによる単純なフィードバックループとして理解されてきました。AGRP遺伝子を発現するニューロンは飢餓を引き起こし、一方、POMC遺伝子を発現するニューロンは満腹感を促します。しかし、これらがレプチン(体重調節に重要なホルモン)の主な標的とされる一方で、近年の研究はこのモデルの不完全さを示唆していました。AGRPニューロンが食欲を迅速に増加させる一方で、POMCニューロンの満腹感誘発は数時間を要するためです。
このギャップを埋める可能
胎児期からの低砂糖生活が成人病を予防:新たな因果的証拠
 第二次世界大戦の「自然実験」を利用して明らかにされた砂糖摂取制限と成人期の健康影響
南カリフォルニア大学ドーンサイフ・カレッジ、UCバークレー、マギル大学の研究者らは、第二次世界大戦中に行われた砂糖配給制限という「自然実験」を活用し、早期の砂糖摂取が長期的な健康に与える影響を分析しました。
この研究によると、胎児期および生後2年間における低砂糖摂取が成人期の慢性疾患リスクを大幅に低減することが示されました。研究結果は科学誌Scienceに掲載され、砂糖摂取制限を受けた子どもは、2型糖尿病の発症リスクが最大35%、高血圧のリスクが最大20%低いことが明らかになりました。
母体が妊娠中に砂糖を抑えただけでも効果が見られましたが、出生後も摂取制限を継続すると効果がさらに増大しました。この研究論文は「Exposure to Sugar Rationing in the First 1000 Days of Life Protected Against Chronic Disease(人生の最初の1000日間における砂糖配給制限が慢性疾患から守る)」と題されています。
第二次世界大戦中の砂糖配給制限
研究者らは、英国が戦時中に実施した砂糖配給制限(1942年開始、1953年終了)を利用しました。この制限により、砂糖摂取量は1日平均約8ティースプーン(40グラム)に抑えられていましたが、配給制限終了後には1日約16ティースプーン(80グラム)へと急増しました。この増加は砂糖に限られており、他の食料の摂取状況には大きな変化はありませんでした。
自然実験による長期的な健康への影響評価
研究者らは、英国の医療記録データベース「UKバイオバンク」を用い、配給終了前後に妊娠または誕生した人々の健康状態を調査しました。配給終了直前と直後に生まれた人々を比較することで、砂糖摂取の違
第二次世界大戦の「自然実験」を利用して明らかにされた砂糖摂取制限と成人期の健康影響
南カリフォルニア大学ドーンサイフ・カレッジ、UCバークレー、マギル大学の研究者らは、第二次世界大戦中に行われた砂糖配給制限という「自然実験」を活用し、早期の砂糖摂取が長期的な健康に与える影響を分析しました。
この研究によると、胎児期および生後2年間における低砂糖摂取が成人期の慢性疾患リスクを大幅に低減することが示されました。研究結果は科学誌Scienceに掲載され、砂糖摂取制限を受けた子どもは、2型糖尿病の発症リスクが最大35%、高血圧のリスクが最大20%低いことが明らかになりました。
母体が妊娠中に砂糖を抑えただけでも効果が見られましたが、出生後も摂取制限を継続すると効果がさらに増大しました。この研究論文は「Exposure to Sugar Rationing in the First 1000 Days of Life Protected Against Chronic Disease(人生の最初の1000日間における砂糖配給制限が慢性疾患から守る)」と題されています。
第二次世界大戦中の砂糖配給制限
研究者らは、英国が戦時中に実施した砂糖配給制限(1942年開始、1953年終了)を利用しました。この制限により、砂糖摂取量は1日平均約8ティースプーン(40グラム)に抑えられていましたが、配給制限終了後には1日約16ティースプーン(80グラム)へと急増しました。この増加は砂糖に限られており、他の食料の摂取状況には大きな変化はありませんでした。
自然実験による長期的な健康への影響評価
研究者らは、英国の医療記録データベース「UKバイオバンク」を用い、配給終了前後に妊娠または誕生した人々の健康状態を調査しました。配給終了直前と直後に生まれた人々を比較することで、砂糖摂取の違
手のひらサイズの「トラクタービーム」デバイスで細胞操作が可能に
 MITが光を利用した「トラクタービーム」デバイスを開発
マサチューセッツ工科大学(MIT)の研究者たちは、映画「スター・ウォーズ」に登場するトラクタービームを彷彿とさせる、細胞を捕捉し操作することができる小型のチップベースデバイスを開発しました。このデバイスはDNAの研究、細胞の分類、病気のメカニズムの解明など、生物学や臨床研究の現場で応用が期待されています。手のひらに収まるほどのサイズで、シリコンフォトニクスチップから放射される光のビームを使って、チップ表面から数ミリメートル離れた場所で粒子を操作することが可能です。この光は生物学実験で使用されるサンプルを保護するガラスカバーを貫通でき、細胞を無菌環境に保つことを可能にします。
従来技術を超える新しい光学ピンセット
従来の光学ピンセットは、光を使って粒子を捕捉・操作するため、大型の顕微鏡装置が必要でしたが、新たに開発されたチップベースの光学ピンセットは、よりコンパクトで大量生産可能かつ高スループットのソリューションを提供します。これにより、生物学実験での光学操作が手軽に行えるようになります。
しかし、既存の類似デバイスは、チップ表面に非常に近い位置でしか粒子を捕捉・操作できませんでした。この制限により、チップが汚染されるリスクや細胞へのストレスが生じ、生物学実験との互換性が制限されていました。
今回、MITの研究者たちは「集積型光学フェーズドアレイ(integrated optical phased array)」と呼ばれるシステムを用いて、チップ表面から100倍以上離れた位置で細胞を捕捉・操作する新しい方法を開発しました。
研究チームと成果の詳細
研究の筆頭著者であるタル・スネ博士課程学生(Tal Sneh)を中心としたMITの研究チームには、ジェレナ・ノタロス博士(Jelena Notaros, Ph
MITが光を利用した「トラクタービーム」デバイスを開発
マサチューセッツ工科大学(MIT)の研究者たちは、映画「スター・ウォーズ」に登場するトラクタービームを彷彿とさせる、細胞を捕捉し操作することができる小型のチップベースデバイスを開発しました。このデバイスはDNAの研究、細胞の分類、病気のメカニズムの解明など、生物学や臨床研究の現場で応用が期待されています。手のひらに収まるほどのサイズで、シリコンフォトニクスチップから放射される光のビームを使って、チップ表面から数ミリメートル離れた場所で粒子を操作することが可能です。この光は生物学実験で使用されるサンプルを保護するガラスカバーを貫通でき、細胞を無菌環境に保つことを可能にします。
従来技術を超える新しい光学ピンセット
従来の光学ピンセットは、光を使って粒子を捕捉・操作するため、大型の顕微鏡装置が必要でしたが、新たに開発されたチップベースの光学ピンセットは、よりコンパクトで大量生産可能かつ高スループットのソリューションを提供します。これにより、生物学実験での光学操作が手軽に行えるようになります。
しかし、既存の類似デバイスは、チップ表面に非常に近い位置でしか粒子を捕捉・操作できませんでした。この制限により、チップが汚染されるリスクや細胞へのストレスが生じ、生物学実験との互換性が制限されていました。
今回、MITの研究者たちは「集積型光学フェーズドアレイ(integrated optical phased array)」と呼ばれるシステムを用いて、チップ表面から100倍以上離れた位置で細胞を捕捉・操作する新しい方法を開発しました。
研究チームと成果の詳細
研究の筆頭著者であるタル・スネ博士課程学生(Tal Sneh)を中心としたMITの研究チームには、ジェレナ・ノタロス博士(Jelena Notaros, Ph
断食中の血糖値を調整する免疫細胞の新たな役割を解明
 断食や運動中に血糖値を調整する免疫細胞の新たな役割を発見
免疫システムといえば感染症との戦いが思い浮かびますが、2025年1月17日に科学誌Scienceに発表されたポルトガル・シャンパリモー財団の研究が、驚くべき新しい役割を明らかにしました。この研究によれば、エネルギーが不足する断食や運動時に、免疫細胞が血糖値を調整する「郵便配達人」として働くことがわかったのです。この研究は、神経系、免疫系、ホルモン系が織りなす新たなネットワークを示し、糖尿病や肥満、がんといった疾患の治療法に新しいアプローチを提供する可能性があります。論文のタイトルは「Neuronal-ILC2 Interactions Regulate Pancreatic Glucagon and Glucose Homeostasis(神経とILC2の相互作用が膵臓のグルカゴンと血糖恒常性を調節する)」です。
免疫システムの再定義
「免疫学は長らく感染症との闘いを中心に研究されてきましたが、免疫系はそれ以上の働きを持っています」と語るのは、シャンパリモー財団免疫生理学研究室の責任者であるエンリケ・ヴェイガ=フェルナンデス博士(Henrique Veiga-Fernandes, PhD)です。私たちの脳や筋肉の主要なエネルギー源であるグルコース(ブドウ糖)の安定した供給は、生存に不可欠です。これまで血糖値の調整は、インスリンとグルカゴンという膵臓で作られるホルモンに依存していると考えられてきました。インスリンは細胞内へのグルコースの取り込みを促進し、グルカゴンは肝臓に蓄えられたグルコースを放出させます。しかし、ヴェイガ=フェルナンデス博士は、「神経系と免疫系が他の主要なプロセス、例えば血糖値の調整に協力している可能性がある」と考え、研究を進めました。
発見された新しい回路
研究チームは、特定の免疫細胞
断食や運動中に血糖値を調整する免疫細胞の新たな役割を発見
免疫システムといえば感染症との戦いが思い浮かびますが、2025年1月17日に科学誌Scienceに発表されたポルトガル・シャンパリモー財団の研究が、驚くべき新しい役割を明らかにしました。この研究によれば、エネルギーが不足する断食や運動時に、免疫細胞が血糖値を調整する「郵便配達人」として働くことがわかったのです。この研究は、神経系、免疫系、ホルモン系が織りなす新たなネットワークを示し、糖尿病や肥満、がんといった疾患の治療法に新しいアプローチを提供する可能性があります。論文のタイトルは「Neuronal-ILC2 Interactions Regulate Pancreatic Glucagon and Glucose Homeostasis(神経とILC2の相互作用が膵臓のグルカゴンと血糖恒常性を調節する)」です。
免疫システムの再定義
「免疫学は長らく感染症との闘いを中心に研究されてきましたが、免疫系はそれ以上の働きを持っています」と語るのは、シャンパリモー財団免疫生理学研究室の責任者であるエンリケ・ヴェイガ=フェルナンデス博士(Henrique Veiga-Fernandes, PhD)です。私たちの脳や筋肉の主要なエネルギー源であるグルコース(ブドウ糖)の安定した供給は、生存に不可欠です。これまで血糖値の調整は、インスリンとグルカゴンという膵臓で作られるホルモンに依存していると考えられてきました。インスリンは細胞内へのグルコースの取り込みを促進し、グルカゴンは肝臓に蓄えられたグルコースを放出させます。しかし、ヴェイガ=フェルナンデス博士は、「神経系と免疫系が他の主要なプロセス、例えば血糖値の調整に協力している可能性がある」と考え、研究を進めました。
発見された新しい回路
研究チームは、特定の免疫細胞
亜鉛が明らかにする新たなAMR対策:腸内細菌を守りながら耐性遺伝子伝播を阻止
 亜鉛サプリが抗菌薬耐性遺伝子(AMR)の拡散を抑制する可能性を発見
2024年10月3日、アイオワ州立大学の研究チームが学術誌「Applied and Environmental Microbiology」に掲載した論文で、亜鉛サプリが抗菌薬耐性遺伝子(AMR)の拡散を抑制する可能性を初めて示しました。論文のタイトルは「Dietary Zinc Supplementation Inhibits Bacterial Plasmid Conjugation in Vitro By Regulating Plasmid Replication (rep) and Transfer (tra) genes(亜鉛の食事補充がプラスミド複製遺伝子(rep)と伝達遺伝子(tra)を制御することでプラスミド接合を抑制)」です。
腸内で起こる抗菌薬耐性遺伝子(AMR)の拡散
AMR遺伝子は、プラスミドと呼ばれる環状の遺伝物質を介して細菌間で水平伝播します。この伝播は腸内で起こり、人々の健康に重大な脅威をもたらしています。アメリカ疾病予防管理センター(CDC)によると、毎年数百万人がAMR感染症と診断され、そのうち35,000人が命を落としています。これらの遺伝子は複数の薬剤耐性を一度に拡散させる可能性があり、患者は抗生物質治療を始める前から耐性菌感染に苦しむことがあります。
亜鉛がプラスミド伝播を阻止するメカニズム
研究チームは亜鉛サプリの効果を実験室でテストし、耐性プラスミドを保有する鳥病原性大腸菌がプラスミドを持たない人間由来の大腸菌に接合する際の伝播率を調査しました。その結果、亜鉛を加えた細菌では伝播率が大幅に低下しました。特に、亜鉛濃度が高いほど伝播が抑制される傾向が確認されました。
さらに、亜鉛が伝播を抑制する遺伝子的メカニズムを調べたところ、以下のことが分かりまし
亜鉛サプリが抗菌薬耐性遺伝子(AMR)の拡散を抑制する可能性を発見
2024年10月3日、アイオワ州立大学の研究チームが学術誌「Applied and Environmental Microbiology」に掲載した論文で、亜鉛サプリが抗菌薬耐性遺伝子(AMR)の拡散を抑制する可能性を初めて示しました。論文のタイトルは「Dietary Zinc Supplementation Inhibits Bacterial Plasmid Conjugation in Vitro By Regulating Plasmid Replication (rep) and Transfer (tra) genes(亜鉛の食事補充がプラスミド複製遺伝子(rep)と伝達遺伝子(tra)を制御することでプラスミド接合を抑制)」です。
腸内で起こる抗菌薬耐性遺伝子(AMR)の拡散
AMR遺伝子は、プラスミドと呼ばれる環状の遺伝物質を介して細菌間で水平伝播します。この伝播は腸内で起こり、人々の健康に重大な脅威をもたらしています。アメリカ疾病予防管理センター(CDC)によると、毎年数百万人がAMR感染症と診断され、そのうち35,000人が命を落としています。これらの遺伝子は複数の薬剤耐性を一度に拡散させる可能性があり、患者は抗生物質治療を始める前から耐性菌感染に苦しむことがあります。
亜鉛がプラスミド伝播を阻止するメカニズム
研究チームは亜鉛サプリの効果を実験室でテストし、耐性プラスミドを保有する鳥病原性大腸菌がプラスミドを持たない人間由来の大腸菌に接合する際の伝播率を調査しました。その結果、亜鉛を加えた細菌では伝播率が大幅に低下しました。特に、亜鉛濃度が高いほど伝播が抑制される傾向が確認されました。
さらに、亜鉛が伝播を抑制する遺伝子的メカニズムを調べたところ、以下のことが分かりまし
リミペードカニ毒素の創薬可能性:新発見のキシバルビン
 リミペードカニ由来の毒素に創薬の可能性:メキシコのセノーテ洞窟の生物多様性保護の重要性
近年、海洋生物の毒素研究が創薬の新たな道を切り開いています。2024年7月29日、学術誌BMC Biologyに掲載された論文「Diversely Evolved Xibalbin Variants from Remipede Venom Inhibit Potassium Channels and Activate PKA-II and Erk1/2 Signaling(リミペード毒素由来の多様なキシバルビン変異体がカリウムチャネルを阻害し、PKA-IIおよびErk1/2シグナル伝達を活性化)」では、メキシコ・ユカタン半島のセノーテ洞窟に生息するリミペードカニの毒素「キシバルビン」の特性と創薬応用の可能性が明らかになりました。
キシバルビン:海洋毒素の新たな発見
リミペードカニは、毒腺で生成された毒素を獲物に直接注入します。この毒素には、耐酵素性や耐熱性を持つ「ノッティン」と呼ばれるペプチドが含まれ、神経毒として作用することが知られています。今回の研究で注目されたペプチド「Xib1」「Xib2」「Xib13」は、哺乳類のカリウムチャネルを効果的に阻害することが実証されました。この作用は、てんかんなどの神経疾患治療薬の開発において重要とされています。また、これらのペプチドは、神経や心筋細胞に存在する電位依存性ナトリウムチャネルも阻害する特性を持っています。
さらに、「Xib1」と「Xib13」は、高等哺乳類の感覚ニューロンでシグナル伝達に関与するタンパク質「PKA-II」および「ERK1/2」を活性化させ、痛みの感作に寄与する可能性が示唆されました。これにより、痛み治療における新たなアプローチが期待されています。
海洋生物多様性と研究の課題
研究を主導したゲーテ大学フラン
リミペードカニ由来の毒素に創薬の可能性:メキシコのセノーテ洞窟の生物多様性保護の重要性
近年、海洋生物の毒素研究が創薬の新たな道を切り開いています。2024年7月29日、学術誌BMC Biologyに掲載された論文「Diversely Evolved Xibalbin Variants from Remipede Venom Inhibit Potassium Channels and Activate PKA-II and Erk1/2 Signaling(リミペード毒素由来の多様なキシバルビン変異体がカリウムチャネルを阻害し、PKA-IIおよびErk1/2シグナル伝達を活性化)」では、メキシコ・ユカタン半島のセノーテ洞窟に生息するリミペードカニの毒素「キシバルビン」の特性と創薬応用の可能性が明らかになりました。
キシバルビン:海洋毒素の新たな発見
リミペードカニは、毒腺で生成された毒素を獲物に直接注入します。この毒素には、耐酵素性や耐熱性を持つ「ノッティン」と呼ばれるペプチドが含まれ、神経毒として作用することが知られています。今回の研究で注目されたペプチド「Xib1」「Xib2」「Xib13」は、哺乳類のカリウムチャネルを効果的に阻害することが実証されました。この作用は、てんかんなどの神経疾患治療薬の開発において重要とされています。また、これらのペプチドは、神経や心筋細胞に存在する電位依存性ナトリウムチャネルも阻害する特性を持っています。
さらに、「Xib1」と「Xib13」は、高等哺乳類の感覚ニューロンでシグナル伝達に関与するタンパク質「PKA-II」および「ERK1/2」を活性化させ、痛みの感作に寄与する可能性が示唆されました。これにより、痛み治療における新たなアプローチが期待されています。
海洋生物多様性と研究の課題
研究を主導したゲーテ大学フラン
結核治療の新たな希望:アフリカニガヨモギ由来化合物
 ペンシルバニア州立大学のジョシュア・ケロッグ博士(Joshua Kellogg, PhD)らの研究チームが、伝統薬草アフリカニガヨモギ(学名:Artemisia afra)の化合物「O-メチルフラボン」が結核の治療に有効である可能性を示しました。この研究結果は、2024年7月2日にオンラインで公開され、10月発行予定の Journal of Ethnopharmacologyで発表され、「An O-Methylflavone from Artemisia afra Kills Non-Replicating Hypoxic Mycobacterium tuberculosis(アフリカニガヨモギ由来のO-メチルフラボンが非増殖性低酸素状態の結核菌を殺す)」というオープンアクセス論文として公開されています。
本研究では、アフリカニガヨモギから分離した化合物が、結核菌の増殖状態と低酸素状態(休眠状態)の両方において効果的に作用することが明らかにされました。特に低酸素状態の結核菌は治療が難しいことで知られており、この発見は新たな治療法の基盤となる可能性があります。
研究の背景:結核治療の課題
結核は世界保健機関(WHO)やアメリカ疾病予防管理センター(CDC)によると、毎年約1,000万人が感染し、約150万人が命を落とす感染症です。現在の治療法では通常6か月間の抗生物質投与が必要ですが、薬剤耐性菌に感染した場合は治療期間が2年にも及ぶことがあります。このため、治療は患者にとって高額かつ負担の大きいものとなっています。
さらに、結核菌は体内で通常の増殖形態と「休眠状態」の2つの形態をとることができます。この休眠状態では菌の細胞活動が大幅に抑えられ、薬剤や免疫の攻撃を回避するため、治療がより困難になります。ジョシュア・ケロッグ博士は、「この休眠状態の菌を攻撃できる新しい
ペンシルバニア州立大学のジョシュア・ケロッグ博士(Joshua Kellogg, PhD)らの研究チームが、伝統薬草アフリカニガヨモギ(学名:Artemisia afra)の化合物「O-メチルフラボン」が結核の治療に有効である可能性を示しました。この研究結果は、2024年7月2日にオンラインで公開され、10月発行予定の Journal of Ethnopharmacologyで発表され、「An O-Methylflavone from Artemisia afra Kills Non-Replicating Hypoxic Mycobacterium tuberculosis(アフリカニガヨモギ由来のO-メチルフラボンが非増殖性低酸素状態の結核菌を殺す)」というオープンアクセス論文として公開されています。
本研究では、アフリカニガヨモギから分離した化合物が、結核菌の増殖状態と低酸素状態(休眠状態)の両方において効果的に作用することが明らかにされました。特に低酸素状態の結核菌は治療が難しいことで知られており、この発見は新たな治療法の基盤となる可能性があります。
研究の背景:結核治療の課題
結核は世界保健機関(WHO)やアメリカ疾病予防管理センター(CDC)によると、毎年約1,000万人が感染し、約150万人が命を落とす感染症です。現在の治療法では通常6か月間の抗生物質投与が必要ですが、薬剤耐性菌に感染した場合は治療期間が2年にも及ぶことがあります。このため、治療は患者にとって高額かつ負担の大きいものとなっています。
さらに、結核菌は体内で通常の増殖形態と「休眠状態」の2つの形態をとることができます。この休眠状態では菌の細胞活動が大幅に抑えられ、薬剤や免疫の攻撃を回避するため、治療がより困難になります。ジョシュア・ケロッグ博士は、「この休眠状態の菌を攻撃できる新しい
アリと真菌の6600万年の共進化:農業の起源に迫る
 科学者たちが広大な遺伝データベースを分析:2700万年前、ある真菌作物が完全にアリに依存する進化の物語
2024年10月3日、スミソニアン国立自然史博物館の研究チームが科学誌Scienceに発表した論文で、アリと真菌の農業的共進化の詳細が明らかになりました。論文のタイトルは「The Coevolution of Fungus-Ant Agriculture(菌類とアリの農業の共進化)」です。スミソニアン国立自然史博物館の研究チームが発表したこの論文は、アリと真菌の農業的共進化の詳細を解明しました。
アリが農業を始めたのは6600万年前の小惑星衝突後
6600万年前、地球に小惑星が衝突し、大規模な絶滅が発生しました。この混乱の中、植物を分解する真菌が大量に繁殖し、その真菌を食料として利用したアリが出現しました。この革新的な行動は、アリと真菌の長い進化的パートナーシップの始まりでした。
高度な農業システムが誕生したのは2700万年前
その後、アリは真菌を湿潤な熱帯雨林から乾燥地帯に移し、孤立した真菌がアリに完全に依存する形で進化しました。この新しい農業システムは「高次農業」と呼ばれ、現在のハキリアリ(リーフカッターアント)に引き継がれています。
研究の概要
遺伝データ分析: 研究チームは、475種の真菌と276種のアリから得られた遺伝データを解析しました。この規模は、真菌農業を行うアリ研究として過去最大です。進化系統樹の作成: アリと真菌の進化的な時間軸を明確化し、特定の時期における農業発展を特定しました。
著者とその活動
主著者であるエントモロジストのテッド・シュルツ博士(Ted Schultz, PhD)は、過去35年間で30回以上南北アメリカを訪問し、真菌農業を行うアリの行動を観察してきました。彼の研究は、アリが数千万年前に農業をどのように進化させた
科学者たちが広大な遺伝データベースを分析:2700万年前、ある真菌作物が完全にアリに依存する進化の物語
2024年10月3日、スミソニアン国立自然史博物館の研究チームが科学誌Scienceに発表した論文で、アリと真菌の農業的共進化の詳細が明らかになりました。論文のタイトルは「The Coevolution of Fungus-Ant Agriculture(菌類とアリの農業の共進化)」です。スミソニアン国立自然史博物館の研究チームが発表したこの論文は、アリと真菌の農業的共進化の詳細を解明しました。
アリが農業を始めたのは6600万年前の小惑星衝突後
6600万年前、地球に小惑星が衝突し、大規模な絶滅が発生しました。この混乱の中、植物を分解する真菌が大量に繁殖し、その真菌を食料として利用したアリが出現しました。この革新的な行動は、アリと真菌の長い進化的パートナーシップの始まりでした。
高度な農業システムが誕生したのは2700万年前
その後、アリは真菌を湿潤な熱帯雨林から乾燥地帯に移し、孤立した真菌がアリに完全に依存する形で進化しました。この新しい農業システムは「高次農業」と呼ばれ、現在のハキリアリ(リーフカッターアント)に引き継がれています。
研究の概要
遺伝データ分析: 研究チームは、475種の真菌と276種のアリから得られた遺伝データを解析しました。この規模は、真菌農業を行うアリ研究として過去最大です。進化系統樹の作成: アリと真菌の進化的な時間軸を明確化し、特定の時期における農業発展を特定しました。
著者とその活動
主著者であるエントモロジストのテッド・シュルツ博士(Ted Schultz, PhD)は、過去35年間で30回以上南北アメリカを訪問し、真菌農業を行うアリの行動を観察してきました。彼の研究は、アリが数千万年前に農業をどのように進化させた
マウス実験で示された新たな記憶喪失治療の可能性
 アルツハイマー病に伴う記憶喪失の新たな治療法に道を開く発見
ジョンズ・ホプキンス医学研究所の神経科学者チームは、先進的な脳イメージング技術を用いて、マウスの特定の記憶回路を再活性化することに成功しました。この研究により、マウスは実際には存在しない避難場所を探す行動を示しました。この研究結果は、2024年9月27日付の科学雑誌Nature Neuroscienceに発表され、「Dopamine-Mediated Formation of a Memory Module in the Nucleus Accumbens for Goal-Directed Navigation(ドーパミンを介した目標指向型ナビゲーションのための記憶モジュール形成)」というオープンアクセス論文として公開されています。この発見は、哺乳類の脳における記憶の構造を理解する上で重要な進展をもたらし、アルツハイマー病などの神経変性疾患による記憶喪失を予防または遅延させる新たな方法を示唆しています。
記憶回路の再活性化に成功
研究チームは、マウスの脳内で2つの領域、すなわちドーパミン依存の行動を中継する「快感中枢」である側坐核と防御行動を司る背側中脳水道灰白質(dPAG)を刺激することで、空間記憶を再活性化しました。この刺激により、マウスは避難行動を示しましたが、実際の避難場所は存在しませんでした。
研究の責任者であるジョンズ・ホプキンス大学医学部の神経科学准教授、ヒョンベ・クォン博士(Hyungbae Kwon, PhD)は次のように述べています。「脳内の記憶回路を人工的に再活性化することで、恐怖刺激がなくても、マウスが以前自然に行った避難行動を引き起こすことができます。」
新たな脳の記憶マッピング技術
この研究では、記憶が脳内でどのように構造化されているかを探るため、研究者たちは「Cal-
アルツハイマー病に伴う記憶喪失の新たな治療法に道を開く発見
ジョンズ・ホプキンス医学研究所の神経科学者チームは、先進的な脳イメージング技術を用いて、マウスの特定の記憶回路を再活性化することに成功しました。この研究により、マウスは実際には存在しない避難場所を探す行動を示しました。この研究結果は、2024年9月27日付の科学雑誌Nature Neuroscienceに発表され、「Dopamine-Mediated Formation of a Memory Module in the Nucleus Accumbens for Goal-Directed Navigation(ドーパミンを介した目標指向型ナビゲーションのための記憶モジュール形成)」というオープンアクセス論文として公開されています。この発見は、哺乳類の脳における記憶の構造を理解する上で重要な進展をもたらし、アルツハイマー病などの神経変性疾患による記憶喪失を予防または遅延させる新たな方法を示唆しています。
記憶回路の再活性化に成功
研究チームは、マウスの脳内で2つの領域、すなわちドーパミン依存の行動を中継する「快感中枢」である側坐核と防御行動を司る背側中脳水道灰白質(dPAG)を刺激することで、空間記憶を再活性化しました。この刺激により、マウスは避難行動を示しましたが、実際の避難場所は存在しませんでした。
研究の責任者であるジョンズ・ホプキンス大学医学部の神経科学准教授、ヒョンベ・クォン博士(Hyungbae Kwon, PhD)は次のように述べています。「脳内の記憶回路を人工的に再活性化することで、恐怖刺激がなくても、マウスが以前自然に行った避難行動を引き起こすことができます。」
新たな脳の記憶マッピング技術
この研究では、記憶が脳内でどのように構造化されているかを探るため、研究者たちは「Cal-
CRISPRの新機能:分子燻蒸で細胞防御を強化する仕組みを発見
 CRISPRシステムに新たな一面――分子燻蒸の役割を発見
遺伝子編集技術で知られるCRISPR-Cas9は、これまで「遺伝子のはさみ」としての役割が注目されてきました。しかし、CRISPRシステムにはそれだけでなく、多彩な戦略が備わっていることがわかっています。2024年10月28日にCell誌で発表された研究では、ロックフェラー大学の細菌学研究所のルチアーノ・マラッフィーニ博士(Luciano Marraffini, PhD)とMSKCCの構造生物学研究所ディンショー・パテル博士( Dinshaw J. Patel, PhD)のチームが、CRISPR-Cas10システムがウイルス感染に対して分子燻蒸のような防御を行う仕組みを発見しました。この研究は、論文「The CRISPR-Associated Adenosine Deaminase Cad1 Converts ATP to ITP to Provide Antiviral Immunity(CRISPR関連アデノシンデアミナーゼCad1によるATPからITPへの変換が抗ウイルス免疫を提供)」として公開されています。
CRISPRの多様な防御戦略
CRISPRシステム(clustered regularly interspaced short palindromic repeats、規則的に間隔をあけた短い回文反復配列)は、元々細菌の適応免疫系として機能しており、ウイルス(ファージ)やその他の外来遺伝子断片から自身を守る役割を果たします。これまで知られている6種類のCRISPRシステムのうち、今回の研究ではタイプIIIに分類されるCRISPR-Cas10システムを調査しました。CRISPR-Cas9と同様に、Cas10システムでもガイドRNAが問題のある遺伝物質を特定し、酵素がそれを切り取ります。しかしCas
CRISPRシステムに新たな一面――分子燻蒸の役割を発見
遺伝子編集技術で知られるCRISPR-Cas9は、これまで「遺伝子のはさみ」としての役割が注目されてきました。しかし、CRISPRシステムにはそれだけでなく、多彩な戦略が備わっていることがわかっています。2024年10月28日にCell誌で発表された研究では、ロックフェラー大学の細菌学研究所のルチアーノ・マラッフィーニ博士(Luciano Marraffini, PhD)とMSKCCの構造生物学研究所ディンショー・パテル博士( Dinshaw J. Patel, PhD)のチームが、CRISPR-Cas10システムがウイルス感染に対して分子燻蒸のような防御を行う仕組みを発見しました。この研究は、論文「The CRISPR-Associated Adenosine Deaminase Cad1 Converts ATP to ITP to Provide Antiviral Immunity(CRISPR関連アデノシンデアミナーゼCad1によるATPからITPへの変換が抗ウイルス免疫を提供)」として公開されています。
CRISPRの多様な防御戦略
CRISPRシステム(clustered regularly interspaced short palindromic repeats、規則的に間隔をあけた短い回文反復配列)は、元々細菌の適応免疫系として機能しており、ウイルス(ファージ)やその他の外来遺伝子断片から自身を守る役割を果たします。これまで知られている6種類のCRISPRシステムのうち、今回の研究ではタイプIIIに分類されるCRISPR-Cas10システムを調査しました。CRISPR-Cas9と同様に、Cas10システムでもガイドRNAが問題のある遺伝物質を特定し、酵素がそれを切り取ります。しかしCas
精神疾患の周期表が統合失調症の新たな治療法を指し示す
 精神疾患の「周期表」を作成:統合失調症の病理と新しい治療への道を解明
スタンフォード大学医学部の科学者たちは、精神疾患における特定の細胞タイプや脳領域を特定することで、これらの病気の理解を深め、新たな治療の開発を目指す「周期表」に相当する画期的な研究を進めています。この研究は、精神疾患関連の遺伝子を示すデータベースと、脳のどの細胞がどの遺伝子をどれだけ活用しているかを示すデータベースを組み合わせ、統合失調症に関連する新たな細胞タイプを特定しました。2025年1月20日、研究成果は科学誌「Nature Neuroscience」に掲載されました。
精神疾患の周期表とは?
周期表が化学元素を体系的に分類し、その特性や行動を予測可能にしたように、この研究も脳細胞を体系化し、精神疾患の新たな理解を提供します。従来の画像診断や死後組織解析の知見を裏付けるとともに、これまで知られていなかった脳細胞の種類や、それらが精神疾患に関与している可能性を明らかにしました。
統合失調症の謎を解明する新たな手法
研究チームは、統合失調症に注力しました。この疾患は世界中で約0.5%の人々に見られ、遺伝的要因が発症リスクの70~80%を占めることが知られています。統合失調症の症状には幻覚や妄想、日常生活の困難が含まれ、多くの場合、社会的孤立や生活の困窮を招きます。
本研究は、非侵襲的な計算手法を活用し、2つの巨大なデータセットを組み合わせました。1つは、統合失調症に関連する287の遺伝子を特定したゲノムワイド関連解析(GWAS)のデータベース、もう1つは、3,369,219個の細胞を分析した脳全体の遺伝子使用データベースです。この手法により、統合失調症に特に関連する109種類の脳細胞タイプが特定されました。
統合失調症に関連する細胞タイプと脳構造
研究は、統合失調症に関連する以下の細
精神疾患の「周期表」を作成:統合失調症の病理と新しい治療への道を解明
スタンフォード大学医学部の科学者たちは、精神疾患における特定の細胞タイプや脳領域を特定することで、これらの病気の理解を深め、新たな治療の開発を目指す「周期表」に相当する画期的な研究を進めています。この研究は、精神疾患関連の遺伝子を示すデータベースと、脳のどの細胞がどの遺伝子をどれだけ活用しているかを示すデータベースを組み合わせ、統合失調症に関連する新たな細胞タイプを特定しました。2025年1月20日、研究成果は科学誌「Nature Neuroscience」に掲載されました。
精神疾患の周期表とは?
周期表が化学元素を体系的に分類し、その特性や行動を予測可能にしたように、この研究も脳細胞を体系化し、精神疾患の新たな理解を提供します。従来の画像診断や死後組織解析の知見を裏付けるとともに、これまで知られていなかった脳細胞の種類や、それらが精神疾患に関与している可能性を明らかにしました。
統合失調症の謎を解明する新たな手法
研究チームは、統合失調症に注力しました。この疾患は世界中で約0.5%の人々に見られ、遺伝的要因が発症リスクの70~80%を占めることが知られています。統合失調症の症状には幻覚や妄想、日常生活の困難が含まれ、多くの場合、社会的孤立や生活の困窮を招きます。
本研究は、非侵襲的な計算手法を活用し、2つの巨大なデータセットを組み合わせました。1つは、統合失調症に関連する287の遺伝子を特定したゲノムワイド関連解析(GWAS)のデータベース、もう1つは、3,369,219個の細胞を分析した脳全体の遺伝子使用データベースです。この手法により、統合失調症に特に関連する109種類の脳細胞タイプが特定されました。
統合失調症に関連する細胞タイプと脳構造
研究は、統合失調症に関連する以下の細
自己由来CiPSC膵島移植で1型糖尿病が逆転:世界初の成功例
 世界初、自己由来の化学的誘導多能性幹細胞(CiPSC)を用いた治療が1型糖尿病を逆転
2024年9月26日付のNature Newsの論説にて「世界初」と評された革新的な治療法により、1型糖尿病(T1D)の患者において糖尿病の完全な逆転が達成されました。この治療は、患者自身の体から作製した化学的誘導多能性幹細胞(CiPSC)由来の膵島細胞を用いた移植を基にしています。この1年間の追跡研究結果は、中国医学科学院の研究者らによって、2024年9月25日にCell誌に発表されました。論文タイトルは「Transplantation of Chemically Induced Pluripotent Stem-Cell-Derived Islets Under Abdominal Anterior Rectus Sheath in a Type 1 Diabetes Patient(化学的誘導多能性幹細胞由来の膵島を1型糖尿病患者の腹部前直筋鞘下に移植)」です。
患者の移植前の状況
研究対象となったのは、2023年に移植を受けた25歳女性。11年間T1Dを患い、体重75kg、BMI 27.3という状況でした。この患者は、過去に2度の肝移植(2014年、2016年)および膵移植(2017年)を受けましたが、膵移植後の血栓性合併症により膵臓が摘出されました。その後、厳格なインスリン療法を行っても目標血糖コントロールが達成できず、HbA1c値は7.4%~8.0%と、アメリカ糖尿病協会(ADA)が推奨する目標値(<7.0%)を超えていました。
移植前3か月間の連続血糖モニタリングによると、目標血糖範囲内に留まった時間(TIR)は43.18%(ADAの推奨値>70%)、危険な低血糖状態(<54 mg/dL)は2.01%(ADAの推奨値<1%)でした。これらの
世界初、自己由来の化学的誘導多能性幹細胞(CiPSC)を用いた治療が1型糖尿病を逆転
2024年9月26日付のNature Newsの論説にて「世界初」と評された革新的な治療法により、1型糖尿病(T1D)の患者において糖尿病の完全な逆転が達成されました。この治療は、患者自身の体から作製した化学的誘導多能性幹細胞(CiPSC)由来の膵島細胞を用いた移植を基にしています。この1年間の追跡研究結果は、中国医学科学院の研究者らによって、2024年9月25日にCell誌に発表されました。論文タイトルは「Transplantation of Chemically Induced Pluripotent Stem-Cell-Derived Islets Under Abdominal Anterior Rectus Sheath in a Type 1 Diabetes Patient(化学的誘導多能性幹細胞由来の膵島を1型糖尿病患者の腹部前直筋鞘下に移植)」です。
患者の移植前の状況
研究対象となったのは、2023年に移植を受けた25歳女性。11年間T1Dを患い、体重75kg、BMI 27.3という状況でした。この患者は、過去に2度の肝移植(2014年、2016年)および膵移植(2017年)を受けましたが、膵移植後の血栓性合併症により膵臓が摘出されました。その後、厳格なインスリン療法を行っても目標血糖コントロールが達成できず、HbA1c値は7.4%~8.0%と、アメリカ糖尿病協会(ADA)が推奨する目標値(<7.0%)を超えていました。
移植前3か月間の連続血糖モニタリングによると、目標血糖範囲内に留まった時間(TIR)は43.18%(ADAの推奨値>70%)、危険な低血糖状態(<54 mg/dL)は2.01%(ADAの推奨値<1%)でした。これらの
RSV治療の新たな一歩:高解像度画像が解明するウイルス構造の謎
 呼吸器合胞体ウイルス(RSV)の構造解明が新たな治療法の鍵に
呼吸器合胞体ウイルス(RSV)の複雑な構造が、感染による入院やそれ以上の重篤な結果を引き起こすリスクを減らす治療法の開発を妨げていると、アメリカ疾病予防管理センター(CDC)が指摘しています。この問題に対し、ウィスコンシン大学マディソン校の研究者らが発表した新しいウイルス画像が、RSV感染を予防または抑制する鍵となる可能性があります。
RSVは特に、乳幼児、高齢者、呼吸器疾患リスクの高い成人にとって深刻な脅威となっています。他の一般的な呼吸器感染症とは異なり、RSVに対する治療選択肢は非常に限られています。米国では一部の乳幼児向けに予防治療が提供され、ワクチンは妊婦と高齢者向けに承認されているのみです。
研究の背景と成果
RSVの構造は微細で柔軟性のあるフィラメント状で、その特徴が研究者にとって課題となっていました。RSVのウイルス成分のうち、関連ウイルスでも保存されている部分を特定することが難しかったため、有効な薬剤ターゲットを見出すことが困難でした。
ウィスコンシン大学の生化学教授であるエリザベス・ライト博士(Elizabeth Wright, PhD)は次のように述べています。「RSVと関連するウイルスには、麻疹など重要な人間の病原体が含まれます。これらのウイルスについての知識はRSVタンパク質構造の手がかりを提供しますが、薬剤ターゲットを特定するためには、宿主細胞膜と密接に関連するRSVタンパク質を詳細に観察する必要があります。」
ライト博士のチームは、クライオ電子トモグラフィー(cryo-ET)というイメージング技術を使用し、RSVの形状と機能に重要な分子や構造の詳細を明らかにしました。この研究結果は2024年7月14日に「Nature」にオープンアクセスで発表されました。論文のタイトル
呼吸器合胞体ウイルス(RSV)の構造解明が新たな治療法の鍵に
呼吸器合胞体ウイルス(RSV)の複雑な構造が、感染による入院やそれ以上の重篤な結果を引き起こすリスクを減らす治療法の開発を妨げていると、アメリカ疾病予防管理センター(CDC)が指摘しています。この問題に対し、ウィスコンシン大学マディソン校の研究者らが発表した新しいウイルス画像が、RSV感染を予防または抑制する鍵となる可能性があります。
RSVは特に、乳幼児、高齢者、呼吸器疾患リスクの高い成人にとって深刻な脅威となっています。他の一般的な呼吸器感染症とは異なり、RSVに対する治療選択肢は非常に限られています。米国では一部の乳幼児向けに予防治療が提供され、ワクチンは妊婦と高齢者向けに承認されているのみです。
研究の背景と成果
RSVの構造は微細で柔軟性のあるフィラメント状で、その特徴が研究者にとって課題となっていました。RSVのウイルス成分のうち、関連ウイルスでも保存されている部分を特定することが難しかったため、有効な薬剤ターゲットを見出すことが困難でした。
ウィスコンシン大学の生化学教授であるエリザベス・ライト博士(Elizabeth Wright, PhD)は次のように述べています。「RSVと関連するウイルスには、麻疹など重要な人間の病原体が含まれます。これらのウイルスについての知識はRSVタンパク質構造の手がかりを提供しますが、薬剤ターゲットを特定するためには、宿主細胞膜と密接に関連するRSVタンパク質を詳細に観察する必要があります。」
ライト博士のチームは、クライオ電子トモグラフィー(cryo-ET)というイメージング技術を使用し、RSVの形状と機能に重要な分子や構造の詳細を明らかにしました。この研究結果は2024年7月14日に「Nature」にオープンアクセスで発表されました。論文のタイトル
知的障害と進行性神経障害を結ぶ新たな遺伝子症候群
 コロンビアの研究者、知的障害と進行性神経学的悪化に関連するまれなSPAG9遺伝子変異を特定
コロンビアのメデジンにあるアンティオキア大学の研究者らは、神経発達障害と神経変性疾患の橋渡しとなる新たな遺伝子症候群を特定しました。この研究成果は2024年8月5日、査読付き学術誌「Genomic Psychiatry(ISSN: 2997-2388, Genomic Press, New York)」に発表されました。この研究では、SPAG9遺伝子におけるホモ接合変異が知的障害、言語発達の遅れ、進行性認知機能低下を特徴とする複雑な神経学的表現型を引き起こすことが示されています。
重要な発見と意義
研究の筆頭著者であるナタリア・アコスタ=バエナ博士(Natalia Acosta-Baena, PhD)は次のように述べています。「この発見は、単一の遺伝子変異が脳の発達と長期的な神経学的健康にどのように影響を与えるかを解明する上で重要な一歩です。この研究は、神経科学の2つの重要な分野が交差する貴重な研究機会を提供します。」
長期的な観察による包括的データ
研究チームは10年以上にわたりコロンビアのある家族を追跡し、3人の兄弟に現れた症候群を調査しました。この包括的なアプローチには、遺伝子解析、神経画像検査、長期的な臨床観察が含まれ、症候群の進行に関する詳細なデータが得られました。
主な研究成果:
SPAG9遺伝子のホモ接合型欠失変異(c.2742del, p.Tyr914Ter)の特定。知的障害、白内障、小脳の異常などの症状を含む詳細な臨床特性の記録。進行性認知機能低下の証拠が示す神経変性成分の存在。神経画像検査による微小頭症、海馬回転異常、脳梁構造の変化、鉄沈着、脳と小脳の萎縮などの異常。
広範な影響と次のステップ
シニア著者のカルロス・アンドレス・ビジェガス=ラ
コロンビアの研究者、知的障害と進行性神経学的悪化に関連するまれなSPAG9遺伝子変異を特定
コロンビアのメデジンにあるアンティオキア大学の研究者らは、神経発達障害と神経変性疾患の橋渡しとなる新たな遺伝子症候群を特定しました。この研究成果は2024年8月5日、査読付き学術誌「Genomic Psychiatry(ISSN: 2997-2388, Genomic Press, New York)」に発表されました。この研究では、SPAG9遺伝子におけるホモ接合変異が知的障害、言語発達の遅れ、進行性認知機能低下を特徴とする複雑な神経学的表現型を引き起こすことが示されています。
重要な発見と意義
研究の筆頭著者であるナタリア・アコスタ=バエナ博士(Natalia Acosta-Baena, PhD)は次のように述べています。「この発見は、単一の遺伝子変異が脳の発達と長期的な神経学的健康にどのように影響を与えるかを解明する上で重要な一歩です。この研究は、神経科学の2つの重要な分野が交差する貴重な研究機会を提供します。」
長期的な観察による包括的データ
研究チームは10年以上にわたりコロンビアのある家族を追跡し、3人の兄弟に現れた症候群を調査しました。この包括的なアプローチには、遺伝子解析、神経画像検査、長期的な臨床観察が含まれ、症候群の進行に関する詳細なデータが得られました。
主な研究成果:
SPAG9遺伝子のホモ接合型欠失変異(c.2742del, p.Tyr914Ter)の特定。知的障害、白内障、小脳の異常などの症状を含む詳細な臨床特性の記録。進行性認知機能低下の証拠が示す神経変性成分の存在。神経画像検査による微小頭症、海馬回転異常、脳梁構造の変化、鉄沈着、脳と小脳の萎縮などの異常。
広範な影響と次のステップ
シニア著者のカルロス・アンドレス・ビジェガス=ラ
呼吸器疾患に光を:細胞研究で明らかになる生命維持反射
 2024年エッペンドルフ&サイエンス神経生物学グランプリ受賞:呼吸器保護機構の鍵を握る細胞を発見
呼吸器への異物の侵入を防ぐ重要な防御機構を担う細胞群を明らかにした研究で、ローラ・シーホルザー博士(Laura Seeholzer, PhD)が2024年エッペンドルフ&サイエンス神経生物学グランプリを受賞しました。この研究成果は、2024年4月18日にScience誌に発表されており、シーホルザー博士は、これらの細胞が疾患でどのように影響を受けるかを解明する次のステップに挑んでいます。
研究の背景と発見
通常、吸気は肺へ、食物や液体、胃酸は消化管へと送られます。しかし、この仕組みが一瞬でも乱れると、誤嚥や肺炎、酸性の胃液による肺損傷といった深刻な問題を引き起こします。特に神経疾患や食道疾患を持つ高齢者では、これが主要な死亡原因の一つです。
従来、喉頭や気管に分布する感覚神経が異物を検知し、排除する役割を担うと考えられていました。しかし、シーホルザー博士は、これらの神経だけでなく、神経内分泌細胞(NE細胞)が気道の防御に重要な役割を果たしていることを発見しました。
主な研究成果
NE細胞は、これまで気道上皮の修復に関与する細胞として知られていましたが、防御機能との関連は不明でした。シーホルザー博士の研究は、以下の発見をもたらしました:
水や胃酸に対する応答:NE細胞は水や強酸に反応し、保護的な反射を誘発することが判明。実験方法の革新:カリウムイメージングやオプトジェネティクスを用いて、NE細胞を活性化させると、マウスで嚥下反射や咳様反射が確認されました。機能喪失実験:NE細胞を欠損させたマウスでは、気道保護能力が低下することが実証され、これらの細胞の重要性がさらに強調されました。
次の挑戦:疾患との関連性の解明
シーホルザー博士は現在、健康なヒトと疾患を持
2024年エッペンドルフ&サイエンス神経生物学グランプリ受賞:呼吸器保護機構の鍵を握る細胞を発見
呼吸器への異物の侵入を防ぐ重要な防御機構を担う細胞群を明らかにした研究で、ローラ・シーホルザー博士(Laura Seeholzer, PhD)が2024年エッペンドルフ&サイエンス神経生物学グランプリを受賞しました。この研究成果は、2024年4月18日にScience誌に発表されており、シーホルザー博士は、これらの細胞が疾患でどのように影響を受けるかを解明する次のステップに挑んでいます。
研究の背景と発見
通常、吸気は肺へ、食物や液体、胃酸は消化管へと送られます。しかし、この仕組みが一瞬でも乱れると、誤嚥や肺炎、酸性の胃液による肺損傷といった深刻な問題を引き起こします。特に神経疾患や食道疾患を持つ高齢者では、これが主要な死亡原因の一つです。
従来、喉頭や気管に分布する感覚神経が異物を検知し、排除する役割を担うと考えられていました。しかし、シーホルザー博士は、これらの神経だけでなく、神経内分泌細胞(NE細胞)が気道の防御に重要な役割を果たしていることを発見しました。
主な研究成果
NE細胞は、これまで気道上皮の修復に関与する細胞として知られていましたが、防御機能との関連は不明でした。シーホルザー博士の研究は、以下の発見をもたらしました:
水や胃酸に対する応答:NE細胞は水や強酸に反応し、保護的な反射を誘発することが判明。実験方法の革新:カリウムイメージングやオプトジェネティクスを用いて、NE細胞を活性化させると、マウスで嚥下反射や咳様反射が確認されました。機能喪失実験:NE細胞を欠損させたマウスでは、気道保護能力が低下することが実証され、これらの細胞の重要性がさらに強調されました。
次の挑戦:疾患との関連性の解明
シーホルザー博士は現在、健康なヒトと疾患を持
神経変性疾患PSPに新たな希望:史上初の効果的治療薬を目指す臨床試験
 臨床試験で治療薬への希望:進行性核上性麻痺(PSP)治療の新たな挑戦
進行性核上性麻痺(PSP)は、治療法が限られ、症状発症から約7年で致死的となる神経変性疾患です。この難病に対する治療薬開発を目的にした臨床試験が、米国カリフォルニア大学サンフランシスコ校(UCSF)を主導として最大50の研究施設で行われます。この試験は、最大75.4百万ドルのNIH国立老化研究所(NIA)からの助成金により可能となり、UCSFが最近受けた中でも最も大規模な助成の一つです。
「本試験がPSP患者のケアを根本的に変えるきっかけとなることを期待しています」と、UCSF神経学部門のフリオ・ロハス博士(Julio Rojas, MD, PhD)は述べています。ロハス博士は、このプラットフォーム試験の主要研究者の一人であり、PSPの進行をわずか20〜30%でも遅らせることが患者にとって大きな意味を持つと指摘します。
PSPの特徴と治療への課題
PSPはタウタンパク質の蓄積により脳細胞が弱まり、死滅することで引き起こされるとされています。30,000人のアメリカ人に影響を及ぼし、主に50〜70代の患者が発症します。特にリチャードソン症候群(Richardson’s syndrome)はPSPの中で最も一般的な形態であり、認知障害、動作の遅れ、硬直、後方への転倒、目の動き(特に下方向)の困難を伴います。
革新的な試験デザイン
この試験では、3種類の薬剤を同時にテストし、それ以降も新しい薬剤を加えていくプラットフォーム型試験モデルが採用されています。この手法は、筋萎縮性側索硬化症(ALS)の試験で成功を収めた方法を応用しており、治療薬の発見を迅速化するとともに、プラセボ群を最小化する利点があります。
「通常の臨床試験と異なり、プラットフォーム試験は、初期の薬剤が無効であっても新しい薬剤を継
臨床試験で治療薬への希望:進行性核上性麻痺(PSP)治療の新たな挑戦
進行性核上性麻痺(PSP)は、治療法が限られ、症状発症から約7年で致死的となる神経変性疾患です。この難病に対する治療薬開発を目的にした臨床試験が、米国カリフォルニア大学サンフランシスコ校(UCSF)を主導として最大50の研究施設で行われます。この試験は、最大75.4百万ドルのNIH国立老化研究所(NIA)からの助成金により可能となり、UCSFが最近受けた中でも最も大規模な助成の一つです。
「本試験がPSP患者のケアを根本的に変えるきっかけとなることを期待しています」と、UCSF神経学部門のフリオ・ロハス博士(Julio Rojas, MD, PhD)は述べています。ロハス博士は、このプラットフォーム試験の主要研究者の一人であり、PSPの進行をわずか20〜30%でも遅らせることが患者にとって大きな意味を持つと指摘します。
PSPの特徴と治療への課題
PSPはタウタンパク質の蓄積により脳細胞が弱まり、死滅することで引き起こされるとされています。30,000人のアメリカ人に影響を及ぼし、主に50〜70代の患者が発症します。特にリチャードソン症候群(Richardson’s syndrome)はPSPの中で最も一般的な形態であり、認知障害、動作の遅れ、硬直、後方への転倒、目の動き(特に下方向)の困難を伴います。
革新的な試験デザイン
この試験では、3種類の薬剤を同時にテストし、それ以降も新しい薬剤を加えていくプラットフォーム型試験モデルが採用されています。この手法は、筋萎縮性側索硬化症(ALS)の試験で成功を収めた方法を応用しており、治療薬の発見を迅速化するとともに、プラセボ群を最小化する利点があります。
「通常の臨床試験と異なり、プラットフォーム試験は、初期の薬剤が無効であっても新しい薬剤を継
オウムの羽の鮮やかな色彩、単一酵素による調節メカニズムを解明
 鮮やかな羽の色を調節する酵素が明らかに
カラフルな羽毛を持つことで知られるオウム。その鮮やかな赤と黄色の色素を調節する仕組みを解明した新しい研究が、2024年11月1日にScience誌で発表されました。本研究の論文タイトルは「A Molecular Mechanism for Bright Color Variation in Parrots(オウムの鮮やかな色の変化をもたらす分子メカニズム)」です。この研究は、オウムの色彩進化とその多様性の分子メカニズムに関する新たな知見を提供します。
背景:自然界における色の重要性
自然界では、色は生態学的適応やコミュニケーションにおいて重要な役割を果たします。特に鳥類は、多彩な羽毛の色とパターンで注目されており、その中でもオウムは非常にカラフルな種として知られています。オウムの羽毛の鮮やかな色は、「シトコフルビン」と呼ばれる特徴的な色素によって作り出されます。
これまで、色素生成において重要な役割を果たす「ポリケタイド合成酵素(PKS)」の存在が知られていましたが、オウムがどのようにして多様な色調を生み出しているのか、その具体的なメカニズムはよく分かっていませんでした。
研究の概要と発見
本研究を主導したワシントン大学医学部のロベルト・アルボレ博士(Roberto Arbore, PhD)らは、化学・酵素解析、遺伝子マッピング、シングルセルゲノム技術を組み合わせて、オウムの羽毛における黄色から赤、緑色の色素変化を調査しました。
研究チームは、色の変化の多くが「ALDH3A2」という単一の酵素の発現を微調整することで制御されていることを発見しました。この酵素はアルデヒド代謝を調節し、赤いアルデヒド分子を黄色いカルボキシル含有分子に酸化することで、羽毛の色素構成を変化させます。この過程により、赤と黄色のシトコフルビン色
鮮やかな羽の色を調節する酵素が明らかに
カラフルな羽毛を持つことで知られるオウム。その鮮やかな赤と黄色の色素を調節する仕組みを解明した新しい研究が、2024年11月1日にScience誌で発表されました。本研究の論文タイトルは「A Molecular Mechanism for Bright Color Variation in Parrots(オウムの鮮やかな色の変化をもたらす分子メカニズム)」です。この研究は、オウムの色彩進化とその多様性の分子メカニズムに関する新たな知見を提供します。
背景:自然界における色の重要性
自然界では、色は生態学的適応やコミュニケーションにおいて重要な役割を果たします。特に鳥類は、多彩な羽毛の色とパターンで注目されており、その中でもオウムは非常にカラフルな種として知られています。オウムの羽毛の鮮やかな色は、「シトコフルビン」と呼ばれる特徴的な色素によって作り出されます。
これまで、色素生成において重要な役割を果たす「ポリケタイド合成酵素(PKS)」の存在が知られていましたが、オウムがどのようにして多様な色調を生み出しているのか、その具体的なメカニズムはよく分かっていませんでした。
研究の概要と発見
本研究を主導したワシントン大学医学部のロベルト・アルボレ博士(Roberto Arbore, PhD)らは、化学・酵素解析、遺伝子マッピング、シングルセルゲノム技術を組み合わせて、オウムの羽毛における黄色から赤、緑色の色素変化を調査しました。
研究チームは、色の変化の多くが「ALDH3A2」という単一の酵素の発現を微調整することで制御されていることを発見しました。この酵素はアルデヒド代謝を調節し、赤いアルデヒド分子を黄色いカルボキシル含有分子に酸化することで、羽毛の色素構成を変化させます。この過程により、赤と黄色のシトコフルビン色
革新的肥満治療:脂肪組織への局所ナノ粒子療法
 ナノ粒子を用いた革新的肥満治療法:脂肪組織の炎症緩和と「褐色化」を促進
ロサンゼルスのテラサキ生体医療イノベーション研究所の研究者らは、肥満治療に向けた新しいナノ粒子ベースの治療法を開発しました。
この研究成果は2024年9月29日付のACS Nano誌に「Simvastatin-Loaded Polymeric Nanoparticles: Targeting Inflammatory Macrophages for Local Adipose Tissue Browning in Obesity Treatment(シンバスタチン搭載ポリマー粒子:炎症性マクロファージを標的とした脂肪組織の局所褐色化による肥満治療)」というタイトルで発表されました。この革新的なアプローチは、脂肪組織内の炎症細胞を標的とし、免疫システムを調節して脂肪組織の褐色化を促進します。肥満治療の限界を克服し、世界的な肥満問題に取り組むための新たな道を示しています。
炎症性マクロファージを標的とした新しい治療法
研究を主導したのは、アリレザ・ハッサニ・ナジャファバディ博士( Alireza Hassani Najafabadi, PhD)です。同氏のチームは、シンバスタチンを搭載したPLGAナノ粒子(Sim-NPs)を開発しました。このナノ粒子は脂肪組織に局所的に送達され、炎症緩和やマクロファージの極性調節を強化することが実験で確認されました。
マウスモデル(食事誘発性肥満)を用いた研究では、この治療法が以下の効果を示しました:
強力な抗炎症作用:炎症性マクロファージを抑制脂肪組織の褐色化:白色脂肪細胞をエネルギーを消費しやすい褐色脂肪細胞へ変化体重減少:肥満関連炎症を抑え、白色脂肪の生成を抑制
ナノ粒子治療の利点
ハッサニ・ナジャファバディ博士は、研究の革新性について次のように述
ナノ粒子を用いた革新的肥満治療法:脂肪組織の炎症緩和と「褐色化」を促進
ロサンゼルスのテラサキ生体医療イノベーション研究所の研究者らは、肥満治療に向けた新しいナノ粒子ベースの治療法を開発しました。
この研究成果は2024年9月29日付のACS Nano誌に「Simvastatin-Loaded Polymeric Nanoparticles: Targeting Inflammatory Macrophages for Local Adipose Tissue Browning in Obesity Treatment(シンバスタチン搭載ポリマー粒子:炎症性マクロファージを標的とした脂肪組織の局所褐色化による肥満治療)」というタイトルで発表されました。この革新的なアプローチは、脂肪組織内の炎症細胞を標的とし、免疫システムを調節して脂肪組織の褐色化を促進します。肥満治療の限界を克服し、世界的な肥満問題に取り組むための新たな道を示しています。
炎症性マクロファージを標的とした新しい治療法
研究を主導したのは、アリレザ・ハッサニ・ナジャファバディ博士( Alireza Hassani Najafabadi, PhD)です。同氏のチームは、シンバスタチンを搭載したPLGAナノ粒子(Sim-NPs)を開発しました。このナノ粒子は脂肪組織に局所的に送達され、炎症緩和やマクロファージの極性調節を強化することが実験で確認されました。
マウスモデル(食事誘発性肥満)を用いた研究では、この治療法が以下の効果を示しました:
強力な抗炎症作用:炎症性マクロファージを抑制脂肪組織の褐色化:白色脂肪細胞をエネルギーを消費しやすい褐色脂肪細胞へ変化体重減少:肥満関連炎症を抑え、白色脂肪の生成を抑制
ナノ粒子治療の利点
ハッサニ・ナジャファバディ博士は、研究の革新性について次のように述
便中代謝物が示す子宮内膜症の新診断法と治療法
 腸内細菌叢が示す子宮内膜症の新たな診断と治療法の可能性
ベイラー医科大学(Baylor College of Medicine)の研究者らが主導するチームは、子宮内膜症患者の腸内代謝物に特徴的な変化を発見しました。この研究結果は、病気のメカニズムへの新たな理解を提供するとともに、非侵襲的な診断方法や腸内細菌叢を標的とした治療の設計に繋がる可能性を示唆しています。特に、患者の便中代謝物と炎症性腸疾患(IBD)との予想外の類似性が明らかになり、両疾患の診断と治療における画期的なアプローチが期待されています。この研究成果は2024年10月11日付でMedに「Identification of Distinct Stool Metabolites in Women with Endometriosis for Non-Invasive Diagnosis and Potential for Microbiota-Based Therapies(子宮内膜症患者における特徴的な便中代謝物の同定:非侵襲的診断と腸内細菌叢に基づく治療の可能性)」として発表されました。
子宮内膜症:難解で痛みを伴う疾患
子宮内膜症は、子宮内膜様組織が子宮外に存在することを特徴とする疾患で、約1億9800万人の女性に影響を与えています。強い骨盤痛、炎症、不妊などが主な症状ですが、現在の診断は主に侵襲的な腹腔鏡検査に依存しているため、診断が遅れることが多いのが現状です。しかし、腸内細菌由来の代謝物が新しい診断方法を示唆しており、便検査による早期発見が実現する可能性があります。
腸内細菌叢と子宮内膜症の関係
研究チームは、子宮内膜症患者18人と健康な女性31人の便サンプルを対象に、高度なメタボロミクス解析と16S細菌シーケンシングを実施しました。その結果、子宮内膜症では61種類の代謝物が有意に変化し
腸内細菌叢が示す子宮内膜症の新たな診断と治療法の可能性
ベイラー医科大学(Baylor College of Medicine)の研究者らが主導するチームは、子宮内膜症患者の腸内代謝物に特徴的な変化を発見しました。この研究結果は、病気のメカニズムへの新たな理解を提供するとともに、非侵襲的な診断方法や腸内細菌叢を標的とした治療の設計に繋がる可能性を示唆しています。特に、患者の便中代謝物と炎症性腸疾患(IBD)との予想外の類似性が明らかになり、両疾患の診断と治療における画期的なアプローチが期待されています。この研究成果は2024年10月11日付でMedに「Identification of Distinct Stool Metabolites in Women with Endometriosis for Non-Invasive Diagnosis and Potential for Microbiota-Based Therapies(子宮内膜症患者における特徴的な便中代謝物の同定:非侵襲的診断と腸内細菌叢に基づく治療の可能性)」として発表されました。
子宮内膜症:難解で痛みを伴う疾患
子宮内膜症は、子宮内膜様組織が子宮外に存在することを特徴とする疾患で、約1億9800万人の女性に影響を与えています。強い骨盤痛、炎症、不妊などが主な症状ですが、現在の診断は主に侵襲的な腹腔鏡検査に依存しているため、診断が遅れることが多いのが現状です。しかし、腸内細菌由来の代謝物が新しい診断方法を示唆しており、便検査による早期発見が実現する可能性があります。
腸内細菌叢と子宮内膜症の関係
研究チームは、子宮内膜症患者18人と健康な女性31人の便サンプルを対象に、高度なメタボロミクス解析と16S細菌シーケンシングを実施しました。その結果、子宮内膜症では61種類の代謝物が有意に変化し
象と人間の共存を実現:ハチの巣フェンスの効果と課題
 ハチの巣フェンスで人と象の共存を実現:ケニアでの9年間の研究が示す成果と課題
ケニアにおける画期的な9年間の研究により、小規模農家を象の襲撃から守るために設置されたハチの巣フェンスが、象を最大86%の確率で寄せ付けない効果を持つことが確認されました。この自然を利用した防衛方法は、農家の収入増加にも寄与し、人と象の共存に向けた新たな解決策として注目されています。本研究結果は、2024年10月29日付でConservation Science and Practice誌に「Impact of Drought and Development on the Effectiveness of Beehive Fences As Elephant Deterrents Over 9 Years in Kenya(干ばつと開発がケニアにおけるハチの巣フェンスの効果に与える影響:9年間の研究)」として発表されました。
ハチの巣フェンスの仕組みと成果
ハチの巣フェンスは、Save the Elephants(STE)、ケニア野生動物サービス(KWS)、およびオックスフォード大学が共同で2007年に導入した技術です。このフェンスは、生きたハチの巣を柱の間に吊るすことで構成され、象に物理的、聴覚的、嗅覚的な威嚇効果を与えます。象は蜂に刺されることを恐れるため、ハチの巣フェンスが設置された農場に近づくことを避けます。この仕組みは農作物を守るだけでなく、蜂蜜や蜜蝋の生産を通じて農家の収入を増やす利点も持っています。
研究の概要と主な成果
調査対象:ツァボ東国立公園近くの2つの村にある26の農場。フェンスを設置した農場には365のハチの巣が使用されました。研究対象期間:2014年から2020年までの6つの主要作物成長期を含む全期間で約4,000件の象の接近を分析。成果:作物が最も栄える時
ハチの巣フェンスで人と象の共存を実現:ケニアでの9年間の研究が示す成果と課題
ケニアにおける画期的な9年間の研究により、小規模農家を象の襲撃から守るために設置されたハチの巣フェンスが、象を最大86%の確率で寄せ付けない効果を持つことが確認されました。この自然を利用した防衛方法は、農家の収入増加にも寄与し、人と象の共存に向けた新たな解決策として注目されています。本研究結果は、2024年10月29日付でConservation Science and Practice誌に「Impact of Drought and Development on the Effectiveness of Beehive Fences As Elephant Deterrents Over 9 Years in Kenya(干ばつと開発がケニアにおけるハチの巣フェンスの効果に与える影響:9年間の研究)」として発表されました。
ハチの巣フェンスの仕組みと成果
ハチの巣フェンスは、Save the Elephants(STE)、ケニア野生動物サービス(KWS)、およびオックスフォード大学が共同で2007年に導入した技術です。このフェンスは、生きたハチの巣を柱の間に吊るすことで構成され、象に物理的、聴覚的、嗅覚的な威嚇効果を与えます。象は蜂に刺されることを恐れるため、ハチの巣フェンスが設置された農場に近づくことを避けます。この仕組みは農作物を守るだけでなく、蜂蜜や蜜蝋の生産を通じて農家の収入を増やす利点も持っています。
研究の概要と主な成果
調査対象:ツァボ東国立公園近くの2つの村にある26の農場。フェンスを設置した農場には365のハチの巣が使用されました。研究対象期間:2014年から2020年までの6つの主要作物成長期を含む全期間で約4,000件の象の接近を分析。成果:作物が最も栄える時
血管内治療の進展:急性脳卒中治療における最新基準とは?
 急性脳梗塞における血管内治療の進展と患者選定基準の最新知見
急性脳梗塞のうち、大血管閉塞(LVO: large vessel occlusion)による脳卒中は、世界中で主要な障害および死亡原因の一つです。血管内治療(カテーテルを用いた最小侵襲手術)は、この疾患の治療法を劇的に変えました。2015年に行われたランダム化試験では、血管内治療が医療管理と比較して一部の患者において障害を軽減する効果があることが示され、特に発症から6時間以内に救急病院を受診し、小さな梗塞部位を持つ患者に有効でした。その後、治療の有効性は発症から24時間以内の患者や、大規模な虚血性梗塞、大脳基底動脈閉塞患者にも拡大しています。
研究の焦点
しかし、以下のような知識のギャップが依然として存在しています:
大規模虚血性梗塞を持つ患者のうち、どのような患者が血管内治療で利益を得られるか。米国国立衛生研究所脳卒中尺度(NIHSS)で低いスコアを示す軽度の脳卒中や、中程度もしくは末梢血管閉塞を持つ患者における血管内治療の役割。基礎的な脳動脈硬化性疾患を持つ患者の最適な管理方法。この課題を解明するため、ボストン大学チョバニアン・アヴェディシアン医学部の研究者らと国際的な共同研究者らが、血管内治療の役割に関する最新のランダム化試験デザインと結果を「ランセット」誌にレビュー論文として発表しました。
主な発見と臨床的意義
患者選定基準:NIHSSスコアが5以上で前大脳循環閉塞を持つ患者、またはNIHSSスコア10以上で基底動脈閉塞を持ち、画像診断で広範な梗塞が確認されない患者が、発症から24時間以内の血管内治療の有力な候補とされています。治療の進展:新世代のデバイスを用いた試験が、最善の医療管理を超える治療効果を確認しました。ケアの進化:血管内治療の適応拡大や画像診断のハードル低下が、患者ケアの最適化
急性脳梗塞における血管内治療の進展と患者選定基準の最新知見
急性脳梗塞のうち、大血管閉塞(LVO: large vessel occlusion)による脳卒中は、世界中で主要な障害および死亡原因の一つです。血管内治療(カテーテルを用いた最小侵襲手術)は、この疾患の治療法を劇的に変えました。2015年に行われたランダム化試験では、血管内治療が医療管理と比較して一部の患者において障害を軽減する効果があることが示され、特に発症から6時間以内に救急病院を受診し、小さな梗塞部位を持つ患者に有効でした。その後、治療の有効性は発症から24時間以内の患者や、大規模な虚血性梗塞、大脳基底動脈閉塞患者にも拡大しています。
研究の焦点
しかし、以下のような知識のギャップが依然として存在しています:
大規模虚血性梗塞を持つ患者のうち、どのような患者が血管内治療で利益を得られるか。米国国立衛生研究所脳卒中尺度(NIHSS)で低いスコアを示す軽度の脳卒中や、中程度もしくは末梢血管閉塞を持つ患者における血管内治療の役割。基礎的な脳動脈硬化性疾患を持つ患者の最適な管理方法。この課題を解明するため、ボストン大学チョバニアン・アヴェディシアン医学部の研究者らと国際的な共同研究者らが、血管内治療の役割に関する最新のランダム化試験デザインと結果を「ランセット」誌にレビュー論文として発表しました。
主な発見と臨床的意義
患者選定基準:NIHSSスコアが5以上で前大脳循環閉塞を持つ患者、またはNIHSSスコア10以上で基底動脈閉塞を持ち、画像診断で広範な梗塞が確認されない患者が、発症から24時間以内の血管内治療の有力な候補とされています。治療の進展:新世代のデバイスを用いた試験が、最善の医療管理を超える治療効果を確認しました。ケアの進化:血管内治療の適応拡大や画像診断のハードル低下が、患者ケアの最適化
肥満治療の新たな道:交感神経由来NPYの役割に迫る
 交感神経由来のニューロペプチドY(NPY)が熱産生性脂肪の維持を通じて肥満を予防する新たなメカニズムを解明
オックスフォード大学のアナ・I・ドミンゴス博士(Ana I. Domingos, PhD)らによる研究チームは、交感神経由来のニューロペプチドY(NPY)がエネルギー消費を維持し、食事由来肥満を防ぐ上で重要な役割を果たしていることを示しました。この研究成果は2024年8月28日付の『Nature』誌に掲載され、「Sympathetic Neuropeptide Y Protects from Obesity by Sustaining Thermogenic Fat(交感神経由来ニューロペプチドYは熱産生性脂肪を維持することで肥満を防ぐ)」というタイトルのオープンアクセス論文として公開されています。
主な発見
過去の研究では、NPY遺伝子の変異が高い体格指数(BMI)と関連するものの、食事パターンの変化とは関係がないことが示唆されていました。今回の研究では、NPYが褐色脂肪組織(BAT)および白色脂肪組織(WAT)内の血管周囲の細胞であるミューラル細胞(mural cells)の増殖を調節する重要な役割を果たすことが明らかになりました。これらの細胞は熱産生性脂肪細胞(エネルギーを燃焼して熱を生む細胞)の前駆細胞として機能します。
研究チームはまた、NPY+交感神経ニューロンが主に脂肪組織の血管構造を支配しており、これらのNPY応答性細胞が熱産生性脂肪細胞の供給源となることを発見しました。一方で、食事由来肥満はNPY+交感神経軸索の喪失とミューラル細胞の枯渇を引き起こし、熱産生機能の低下と肥満への感受性増加につながることが示されました。
動物モデルでの検証
交感神経ニューロンからNPYを選択的に除去した動物モデルでは、熱産生能力とエネルギー消費が低下しま
交感神経由来のニューロペプチドY(NPY)が熱産生性脂肪の維持を通じて肥満を予防する新たなメカニズムを解明
オックスフォード大学のアナ・I・ドミンゴス博士(Ana I. Domingos, PhD)らによる研究チームは、交感神経由来のニューロペプチドY(NPY)がエネルギー消費を維持し、食事由来肥満を防ぐ上で重要な役割を果たしていることを示しました。この研究成果は2024年8月28日付の『Nature』誌に掲載され、「Sympathetic Neuropeptide Y Protects from Obesity by Sustaining Thermogenic Fat(交感神経由来ニューロペプチドYは熱産生性脂肪を維持することで肥満を防ぐ)」というタイトルのオープンアクセス論文として公開されています。
主な発見
過去の研究では、NPY遺伝子の変異が高い体格指数(BMI)と関連するものの、食事パターンの変化とは関係がないことが示唆されていました。今回の研究では、NPYが褐色脂肪組織(BAT)および白色脂肪組織(WAT)内の血管周囲の細胞であるミューラル細胞(mural cells)の増殖を調節する重要な役割を果たすことが明らかになりました。これらの細胞は熱産生性脂肪細胞(エネルギーを燃焼して熱を生む細胞)の前駆細胞として機能します。
研究チームはまた、NPY+交感神経ニューロンが主に脂肪組織の血管構造を支配しており、これらのNPY応答性細胞が熱産生性脂肪細胞の供給源となることを発見しました。一方で、食事由来肥満はNPY+交感神経軸索の喪失とミューラル細胞の枯渇を引き起こし、熱産生機能の低下と肥満への感受性増加につながることが示されました。
動物モデルでの検証
交感神経ニューロンからNPYを選択的に除去した動物モデルでは、熱産生能力とエネルギー消費が低下しま
遺伝性網膜疾患の新発見「UBAP1L遺伝子」が治療開発に道を拓く
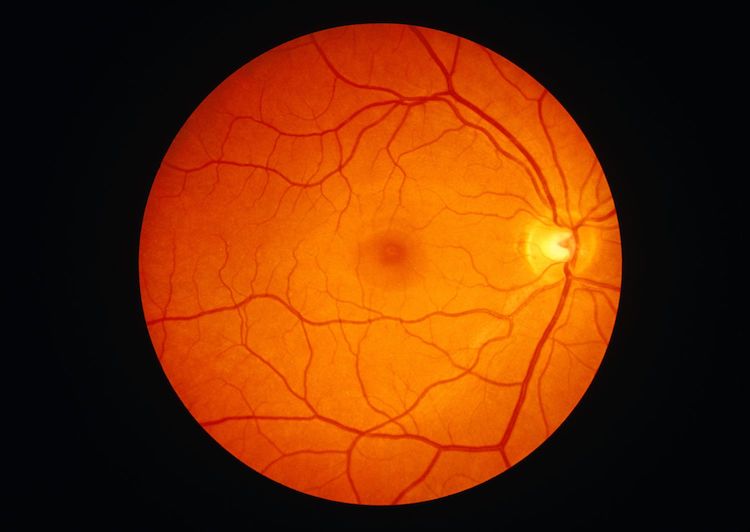 遺伝性網膜疾患に関連する新しい遺伝子「UBAP1L」の発見が治療開発の可能性を拓く
科学者らは、網膜の光を感知する組織に影響を与え、視力を脅かす「遺伝性網膜疾患(IRDs)」の一部を引き起こす新たな遺伝子を特定しました。この研究成果は、2024年9月26日にJAMA Ophthalmology誌に発表されました。論文タイトルは「Biallelic Loss-of-Function Variants in UBAP1L and Nonsyndromic Retinal Dystrophies(UBAP1L遺伝子の両アレル機能喪失変異と非症候性網膜ジストロフィー)」です。
新発見された遺伝子と疾患の詳細
6名の患者を対象とした小規模な研究で、研究者らはUBAP1L遺伝子が網膜ジストロフィーのさまざまな形態に関与していることを明らかにしました。この疾患には、中央視力(読書など)に重要な黄斑に影響を及ぼす「黄斑症」、色覚を司る円錐細胞が障害される「円錐ジストロフィー」、さらに夜間視力を担当する桿体細胞にも影響を与える「円錐桿体ジストロフィー」が含まれます。対象者は若年成人期から症状を発症し、晩年には重度の視力喪失に至るケースが確認されました。
遺伝子発見の意義
NIHの眼科遺伝学研究室長であり、論文の上席著者であるビン・グアン博士(Bin Guan, PhD)は次のように述べています。「今回の患者は、他の遺伝性網膜疾患に似た症状を示しましたが、その原因は特定されていませんでした。この遺伝子を特定したことで、疾患を引き起こす仕組みを研究し、治療法の開発を目指すことが可能になりました。」
UBAP1Lの関与が明らかになったことで、これまでに判明している280以上の疾患関連遺伝子のリストに新たな知見が加わりました。
NEIの眼科医であり、論文の共同上席著者であるラリッサ
遺伝性網膜疾患に関連する新しい遺伝子「UBAP1L」の発見が治療開発の可能性を拓く
科学者らは、網膜の光を感知する組織に影響を与え、視力を脅かす「遺伝性網膜疾患(IRDs)」の一部を引き起こす新たな遺伝子を特定しました。この研究成果は、2024年9月26日にJAMA Ophthalmology誌に発表されました。論文タイトルは「Biallelic Loss-of-Function Variants in UBAP1L and Nonsyndromic Retinal Dystrophies(UBAP1L遺伝子の両アレル機能喪失変異と非症候性網膜ジストロフィー)」です。
新発見された遺伝子と疾患の詳細
6名の患者を対象とした小規模な研究で、研究者らはUBAP1L遺伝子が網膜ジストロフィーのさまざまな形態に関与していることを明らかにしました。この疾患には、中央視力(読書など)に重要な黄斑に影響を及ぼす「黄斑症」、色覚を司る円錐細胞が障害される「円錐ジストロフィー」、さらに夜間視力を担当する桿体細胞にも影響を与える「円錐桿体ジストロフィー」が含まれます。対象者は若年成人期から症状を発症し、晩年には重度の視力喪失に至るケースが確認されました。
遺伝子発見の意義
NIHの眼科遺伝学研究室長であり、論文の上席著者であるビン・グアン博士(Bin Guan, PhD)は次のように述べています。「今回の患者は、他の遺伝性網膜疾患に似た症状を示しましたが、その原因は特定されていませんでした。この遺伝子を特定したことで、疾患を引き起こす仕組みを研究し、治療法の開発を目指すことが可能になりました。」
UBAP1Lの関与が明らかになったことで、これまでに判明している280以上の疾患関連遺伝子のリストに新たな知見が加わりました。
NEIの眼科医であり、論文の共同上席著者であるラリッサ
希少疾患の治療に革命を:AIモデル「TxGNN」の可能性
 人工知能を活用した新たな創薬モデル、希少疾患への新しい希望を提案
新たに開発された人工知能(AI)モデル「TxGNN」は、数千の未治療疾患を含む膨大な病気に対する既存薬からの治療法を提案。未学習の病気にも応用可能で、提案した治療法の説明も提供。これにより、従来の創薬よりも迅速かつ低コストで、副作用の少ない治療法の開発が期待される。現在、世界には7,000以上の希少・未診断疾患が存在し、合計で約3億人に影響を及ぼしています。しかし、FDA(米食品医薬品局)に承認された薬があるのは5~7%に過ぎず、多くの疾患は未治療または十分に治療されていません。
こうした状況を打破するため、ハーバード大学医学大学院(HMS)の研究者らが開発したAIモデル「TxGNN」が注目されています。このモデルは、既存薬を利用して新たな治療法を発見し、特に希少疾患や未治療疾患の治療に貢献することを目指しています。
TxGNNモデルの特長と成果
2024年9月25日にNature Medicine誌に発表されたこの研究では、TxGNNが既存薬8,000種類から17,080の疾患に対する治療候補を特定しました。その多くは未治療の疾患であり、これまでのAIモデルの中で最も多くの疾患をカバーしています。また、TxGNNは、既存の薬が特定の病気に対してどのような副作用や禁忌があるかを予測する能力も持ち、従来の試行錯誤的な薬物評価方法を改善します。
研究チームはこのツールを無料で公開し、特に治療オプションの少ない疾患に取り組む臨床研究者らに活用してもらいたいと考えています。
既存薬の再利用が持つ可能性
既存薬を利用する創薬手法は、開発コストや時間を削減できる魅力的な方法です。FDAが承認した薬の約30%が承認後に新たな適応症を取得しており、長年の使用を経て意外な効果が発見されるケースも少なくありませ
人工知能を活用した新たな創薬モデル、希少疾患への新しい希望を提案
新たに開発された人工知能(AI)モデル「TxGNN」は、数千の未治療疾患を含む膨大な病気に対する既存薬からの治療法を提案。未学習の病気にも応用可能で、提案した治療法の説明も提供。これにより、従来の創薬よりも迅速かつ低コストで、副作用の少ない治療法の開発が期待される。現在、世界には7,000以上の希少・未診断疾患が存在し、合計で約3億人に影響を及ぼしています。しかし、FDA(米食品医薬品局)に承認された薬があるのは5~7%に過ぎず、多くの疾患は未治療または十分に治療されていません。
こうした状況を打破するため、ハーバード大学医学大学院(HMS)の研究者らが開発したAIモデル「TxGNN」が注目されています。このモデルは、既存薬を利用して新たな治療法を発見し、特に希少疾患や未治療疾患の治療に貢献することを目指しています。
TxGNNモデルの特長と成果
2024年9月25日にNature Medicine誌に発表されたこの研究では、TxGNNが既存薬8,000種類から17,080の疾患に対する治療候補を特定しました。その多くは未治療の疾患であり、これまでのAIモデルの中で最も多くの疾患をカバーしています。また、TxGNNは、既存の薬が特定の病気に対してどのような副作用や禁忌があるかを予測する能力も持ち、従来の試行錯誤的な薬物評価方法を改善します。
研究チームはこのツールを無料で公開し、特に治療オプションの少ない疾患に取り組む臨床研究者らに活用してもらいたいと考えています。
既存薬の再利用が持つ可能性
既存薬を利用する創薬手法は、開発コストや時間を削減できる魅力的な方法です。FDAが承認した薬の約30%が承認後に新たな適応症を取得しており、長年の使用を経て意外な効果が発見されるケースも少なくありませ
RNAウイルス防御の鍵:TRIM25の役割に迫る最新研究
 人間の身体は毎秒のように外部からの攻撃を受けています。その攻撃者たちは、ウイルス、細菌、寄生虫、毒素など、生物および非生物の存在であり、私たちの身体の機能に悪影響を与える可能性があります。この攻撃から私たちを守るのが、パトロール隊のように働くタンパク質群です。これらは、体内で最初の防衛線を形成する自然免疫系の重要な構成要素です。今回、EMBLハイデルベルクの研究者らとその共同研究者による新たな研究により、こうした防御の「ヒーロー」の一つであるTRIM25というタンパク質が、ウイルスに立ち向かう「スーパーパワー」を発揮する仕組みが明らかになりました。
「TRIM25はインフルエンザウイルスやジカウイルスのようなRNAウイルスに対する自然免疫応答において極めて重要な役割を果たすため、私たちはその研究を行うことにしました」と述べたのは、EMBLのヘニグ研究グループでEIPOD4ポスドクフェローを務める研究の第一著者、ルシア・アルバレス博士(Lucía Álvarez, PhD)です。「TRIM25がRNAを結合することで抗ウイルス防御にどのような役割を果たすのかを理解したかったのです。」
TRIM25は、細胞内で他のタンパク質にユビキチンという小さなタンパク質をタグ付けしてその機能を変化させる大規模な酵素ファミリーに属しています。その「スーパーパワー」は、一連のシグナル伝達を引き起こし、外来の攻撃者が特定され無力化されるプロセスを促進する能力にあります。過去の研究で、TRIM25がRNAを結合することは判明していましたが、この動作が免疫活性にとってなぜ重要なのかは明確ではありませんでした。さらにTRIM25には、大量のRNAが存在する細胞内で、友好的なRNAと敵対的なRNAを見分けるという、いわば「干し草の山から針を探す」ような課題があります。では、TRIM25はウイルス
人間の身体は毎秒のように外部からの攻撃を受けています。その攻撃者たちは、ウイルス、細菌、寄生虫、毒素など、生物および非生物の存在であり、私たちの身体の機能に悪影響を与える可能性があります。この攻撃から私たちを守るのが、パトロール隊のように働くタンパク質群です。これらは、体内で最初の防衛線を形成する自然免疫系の重要な構成要素です。今回、EMBLハイデルベルクの研究者らとその共同研究者による新たな研究により、こうした防御の「ヒーロー」の一つであるTRIM25というタンパク質が、ウイルスに立ち向かう「スーパーパワー」を発揮する仕組みが明らかになりました。
「TRIM25はインフルエンザウイルスやジカウイルスのようなRNAウイルスに対する自然免疫応答において極めて重要な役割を果たすため、私たちはその研究を行うことにしました」と述べたのは、EMBLのヘニグ研究グループでEIPOD4ポスドクフェローを務める研究の第一著者、ルシア・アルバレス博士(Lucía Álvarez, PhD)です。「TRIM25がRNAを結合することで抗ウイルス防御にどのような役割を果たすのかを理解したかったのです。」
TRIM25は、細胞内で他のタンパク質にユビキチンという小さなタンパク質をタグ付けしてその機能を変化させる大規模な酵素ファミリーに属しています。その「スーパーパワー」は、一連のシグナル伝達を引き起こし、外来の攻撃者が特定され無力化されるプロセスを促進する能力にあります。過去の研究で、TRIM25がRNAを結合することは判明していましたが、この動作が免疫活性にとってなぜ重要なのかは明確ではありませんでした。さらにTRIM25には、大量のRNAが存在する細胞内で、友好的なRNAと敵対的なRNAを見分けるという、いわば「干し草の山から針を探す」ような課題があります。では、TRIM25はウイルス
若年性パーキンソン病治療の可能性、新薬分子が神経保護を実現
 新薬分子が若年患者における神経細胞の喪失を防ぐ可能性を発見
パーキンソン病の新しい治療法への道を切り開く可能性がある新薬分子についての研究成果が発表されました。研究の主導者であるマギル大学生化学科教授で、神経変性疾患の構造研究に関するカナダ研究チェアを務めるカレ・ゲーリング博士(Kalle Gehring, PhD)は、「この化合物を用いることで、少なくとも一部の患者に対して初のパーキンソン病治療薬を開発できる可能性がある」と述べています。
パーキンソン病の症状は通常60代以降に現れますが、患者の5〜10%は40歳未満で診断されます。この退行性疾患はカナダで10万人以上に影響を与えているとされています。
今回の研究では、バイオジェン社が開発した分子が、重要なタンパク質「パーキン」を再活性化させる仕組みを調査しました。パーキンは、細胞のエネルギー供給源であるミトコンドリアの損傷を取り除き、健康な脳細胞を維持する役割を果たします。しかし、一部の若年患者ではパーキンの変異により、このプロセスが妨げられ、損傷したミトコンドリアの蓄積がパーキンソン病の原因となっています。
最先端技術で発見
研究チームは、サスカチュワン大学にあるカナダ光源施設(Canadian Light Source: CLS)で最先端技術を活用し、この化合物がパーキンと細胞内の自然な活性化因子を結び付けることで、パーキンの機能を回復させることを明らかにしました。
この研究成果は、2024年9月19日付でNature Communicationsに掲載されました。論文タイトルは「Activation of Parkin by a Molecular Glue(分子接着剤によるパーキンの活性化)」です。この研究は、特定の変異を持つ若年患者向けに個別化された治療法を設計する基盤を提供するものです。
将
新薬分子が若年患者における神経細胞の喪失を防ぐ可能性を発見
パーキンソン病の新しい治療法への道を切り開く可能性がある新薬分子についての研究成果が発表されました。研究の主導者であるマギル大学生化学科教授で、神経変性疾患の構造研究に関するカナダ研究チェアを務めるカレ・ゲーリング博士(Kalle Gehring, PhD)は、「この化合物を用いることで、少なくとも一部の患者に対して初のパーキンソン病治療薬を開発できる可能性がある」と述べています。
パーキンソン病の症状は通常60代以降に現れますが、患者の5〜10%は40歳未満で診断されます。この退行性疾患はカナダで10万人以上に影響を与えているとされています。
今回の研究では、バイオジェン社が開発した分子が、重要なタンパク質「パーキン」を再活性化させる仕組みを調査しました。パーキンは、細胞のエネルギー供給源であるミトコンドリアの損傷を取り除き、健康な脳細胞を維持する役割を果たします。しかし、一部の若年患者ではパーキンの変異により、このプロセスが妨げられ、損傷したミトコンドリアの蓄積がパーキンソン病の原因となっています。
最先端技術で発見
研究チームは、サスカチュワン大学にあるカナダ光源施設(Canadian Light Source: CLS)で最先端技術を活用し、この化合物がパーキンと細胞内の自然な活性化因子を結び付けることで、パーキンの機能を回復させることを明らかにしました。
この研究成果は、2024年9月19日付でNature Communicationsに掲載されました。論文タイトルは「Activation of Parkin by a Molecular Glue(分子接着剤によるパーキンの活性化)」です。この研究は、特定の変異を持つ若年患者向けに個別化された治療法を設計する基盤を提供するものです。
将
農薬リスクと栄養の力:ミツバチの新たな生存戦略
 ハチの生存における栄養とストレスの重要性:イリノイ大学研究
米国イリノイ大学アーバナ・シャンペーン校の研究者らは、ミツバチの生存に影響を及ぼす栄養不足、ウイルス感染、農薬曝露という3つの要因の相互作用を解明する研究を行いました。この研究は、栄養状態の良し悪しが他の要因による影響を大きく左右することを明らかにし、2024年8月2日に「Science of the Total Environment」誌に掲載されました。論文タイトルは「Nutrition, Pesticide Exposure and Virus Infection Interact to Produce Context-Dependent Effects in Honey Bees(栄養、農薬曝露、ウイルス感染が相互作用してミツバチに文脈依存的な影響を及ぼす)」です。
多因子が生存に与える影響
研究を主導した大学院生エドワード・シエ氏(Edward Hsieh)とイリノイ大学昆虫学教授アダム・ドレザル博士(Adam Dolezal, PhD)は、ミツバチの生存率における複数のストレス要因の影響が状況に依存することを発見しました。「複数のストレス要因は通常生存に悪影響を及ぼしますが、その影響は常に文脈依存的です」とシエ氏は述べています。
従来の研究では、栄養不足と農薬、または農薬とウイルス感染といった1~2要因の相互作用に焦点が当てられることが一般的でしたが、本研究は3要因すべてを一度に検討する初の試みとなります。
栄養がもたらす抵抗力の向上
研究チームは、アイオワ州の農地周辺の復元された草原から採取した花粉を使用し、実験室で飼育されたミツバチを用いた実験を行いました。農薬として有機リン系のクロルピリホス、ピレスロイド系のラムダ-シハロスリン、ネオニコチノイド系のチアメトキサムが使用されました。
ハチの生存における栄養とストレスの重要性:イリノイ大学研究
米国イリノイ大学アーバナ・シャンペーン校の研究者らは、ミツバチの生存に影響を及ぼす栄養不足、ウイルス感染、農薬曝露という3つの要因の相互作用を解明する研究を行いました。この研究は、栄養状態の良し悪しが他の要因による影響を大きく左右することを明らかにし、2024年8月2日に「Science of the Total Environment」誌に掲載されました。論文タイトルは「Nutrition, Pesticide Exposure and Virus Infection Interact to Produce Context-Dependent Effects in Honey Bees(栄養、農薬曝露、ウイルス感染が相互作用してミツバチに文脈依存的な影響を及ぼす)」です。
多因子が生存に与える影響
研究を主導した大学院生エドワード・シエ氏(Edward Hsieh)とイリノイ大学昆虫学教授アダム・ドレザル博士(Adam Dolezal, PhD)は、ミツバチの生存率における複数のストレス要因の影響が状況に依存することを発見しました。「複数のストレス要因は通常生存に悪影響を及ぼしますが、その影響は常に文脈依存的です」とシエ氏は述べています。
従来の研究では、栄養不足と農薬、または農薬とウイルス感染といった1~2要因の相互作用に焦点が当てられることが一般的でしたが、本研究は3要因すべてを一度に検討する初の試みとなります。
栄養がもたらす抵抗力の向上
研究チームは、アイオワ州の農地周辺の復元された草原から採取した花粉を使用し、実験室で飼育されたミツバチを用いた実験を行いました。農薬として有機リン系のクロルピリホス、ピレスロイド系のラムダ-シハロスリン、ネオニコチノイド系のチアメトキサムが使用されました。
多発性硬化症の進行を予測する新しいバイオマーカー発見
 多発性硬化症の予後を予測するバイオマーカーを特定
欧州多発性硬化症治療研究委員会(ECTRIMS 2024)で、2024年9月19日に発表された画期的な研究が、多発性硬化症(MS)の障害進行を予測する重要なバイオマーカーを明らかにしました。この研究は、世界中のMS患者に対して、より個別化された効果的な治療計画の提供を可能にする画期的な成果です。
研究概要と主要な発見
スペインとイタリアの13病院で実施された多施設観察研究で、ラモン・イ・カハル大学病院のエンリク・モンレアル博士(Dr. Enric Monreal)らが、発症初期の患者において血中神経フィラメント軽鎖(sNfL)濃度が高い場合、再発関連悪化(RAW: Relapse-Associated Worsening)および再発とは無関係な進行(PIRA: Progression Independent of Relapse Activity)を予測できることを示しました。また、アストロサイト由来の血中グリア線維酸性タンパク質(sGFAP)の濃度は、sNfL濃度が低い患者においてPIRAと相関があることが判明しました。
この研究では、発症後12カ月以内に採取された725人のMS患者の血液サンプルを、シングル分子アレイ(SIMOA: Single Molecule Array)技術を用いて分析し、sNfLおよびsGFAP濃度の予測的価値を評価しました。
主な結果
sNfL濃度が高い場合: CNS(中枢神経系)における急性炎症を示し、RAWリスクが45%、PIRAリスクが43%増加。標準的な疾患修飾治療(DMT)には反応しにくいものの、高効率DMT(Natalizumab、Alemtuzumab、Ocrelizumab、Rituximab、Ofatumumab)により顕著な効果が確認されました。
sGFA
多発性硬化症の予後を予測するバイオマーカーを特定
欧州多発性硬化症治療研究委員会(ECTRIMS 2024)で、2024年9月19日に発表された画期的な研究が、多発性硬化症(MS)の障害進行を予測する重要なバイオマーカーを明らかにしました。この研究は、世界中のMS患者に対して、より個別化された効果的な治療計画の提供を可能にする画期的な成果です。
研究概要と主要な発見
スペインとイタリアの13病院で実施された多施設観察研究で、ラモン・イ・カハル大学病院のエンリク・モンレアル博士(Dr. Enric Monreal)らが、発症初期の患者において血中神経フィラメント軽鎖(sNfL)濃度が高い場合、再発関連悪化(RAW: Relapse-Associated Worsening)および再発とは無関係な進行(PIRA: Progression Independent of Relapse Activity)を予測できることを示しました。また、アストロサイト由来の血中グリア線維酸性タンパク質(sGFAP)の濃度は、sNfL濃度が低い患者においてPIRAと相関があることが判明しました。
この研究では、発症後12カ月以内に採取された725人のMS患者の血液サンプルを、シングル分子アレイ(SIMOA: Single Molecule Array)技術を用いて分析し、sNfLおよびsGFAP濃度の予測的価値を評価しました。
主な結果
sNfL濃度が高い場合: CNS(中枢神経系)における急性炎症を示し、RAWリスクが45%、PIRAリスクが43%増加。標準的な疾患修飾治療(DMT)には反応しにくいものの、高効率DMT(Natalizumab、Alemtuzumab、Ocrelizumab、Rituximab、Ofatumumab)により顕著な効果が確認されました。
sGFA
長期抗ウイルス治療で帯状疱疹の痛みと再発リスクを軽減
 帯状疱疹による目の炎症や感染症を抑える長期低用量抗ウイルス治療:新しい研究成果
アメリカ眼科学会(AAO)の年次総会(2023年10月19日、シカゴ)および角膜・眼バンクフォーラム(同年10月18日)で発表された新しい研究によると、帯状疱疹が目に影響を及ぼす場合の炎症や感染症、さらに痛みのリスクを低減するために、長期の低用量抗ウイルス治療が有効であることが明らかになりました。
帯状疱疹とその影響
帯状疱疹は、水痘の原因となる水痘帯状疱疹ウイルスが神経細胞内で何十年も休眠状態を保ち、その後何らかの理由で再活性化することで発生します。この病気は主に50歳以上の人々や、免疫機能が低下している成人に多く見られ、神経経路に沿って広がり、神経が支配する皮膚領域に痛みを伴う水疱性発疹を引き起こします。
アメリカでは毎年100万人以上が帯状疱疹にかかり、そのうち約8%が額と目を支配する神経に影響を及ぼします。この状態は「眼性帯状疱疹(herpes zoster ophthalmicus, HZO)」と呼ばれ、角膜が影響を受けると角膜炎、眼内部が影響を受けると虹彩炎を引き起こします。これらは痛み、赤み、視力低下、さらには緑内障を伴い、慢性眼疾患や瘢痕、視力喪失に繋がることがあります。
研究の概要
8年間にわたるZoster Eye Disease Study(ZEDS)では、1年間の低用量抗ウイルス薬「バラシクロビル(valacyclovir)」を投与された参加者は、新たな眼疾患のリスクが18カ月時点で26%減少したことが報告されました。また、12カ月時点で30%、18カ月時点で28%の多発性疾患再発の減少が見られました。
さらに、バラシクロビルを服用した参加者は、痛みの持続期間が短縮し、神経痛用薬の使用量が大幅に減少しました。これらの薬(例:プレガバリン、ガバペンチン)は
帯状疱疹による目の炎症や感染症を抑える長期低用量抗ウイルス治療:新しい研究成果
アメリカ眼科学会(AAO)の年次総会(2023年10月19日、シカゴ)および角膜・眼バンクフォーラム(同年10月18日)で発表された新しい研究によると、帯状疱疹が目に影響を及ぼす場合の炎症や感染症、さらに痛みのリスクを低減するために、長期の低用量抗ウイルス治療が有効であることが明らかになりました。
帯状疱疹とその影響
帯状疱疹は、水痘の原因となる水痘帯状疱疹ウイルスが神経細胞内で何十年も休眠状態を保ち、その後何らかの理由で再活性化することで発生します。この病気は主に50歳以上の人々や、免疫機能が低下している成人に多く見られ、神経経路に沿って広がり、神経が支配する皮膚領域に痛みを伴う水疱性発疹を引き起こします。
アメリカでは毎年100万人以上が帯状疱疹にかかり、そのうち約8%が額と目を支配する神経に影響を及ぼします。この状態は「眼性帯状疱疹(herpes zoster ophthalmicus, HZO)」と呼ばれ、角膜が影響を受けると角膜炎、眼内部が影響を受けると虹彩炎を引き起こします。これらは痛み、赤み、視力低下、さらには緑内障を伴い、慢性眼疾患や瘢痕、視力喪失に繋がることがあります。
研究の概要
8年間にわたるZoster Eye Disease Study(ZEDS)では、1年間の低用量抗ウイルス薬「バラシクロビル(valacyclovir)」を投与された参加者は、新たな眼疾患のリスクが18カ月時点で26%減少したことが報告されました。また、12カ月時点で30%、18カ月時点で28%の多発性疾患再発の減少が見られました。
さらに、バラシクロビルを服用した参加者は、痛みの持続期間が短縮し、神経痛用薬の使用量が大幅に減少しました。これらの薬(例:プレガバリン、ガバペンチン)は
微生物療法の未来:抗生物質に頼らない腸内細菌制御
 腸内細菌叢の健康を守る18種の有益微生物:炎症と抗生物質耐性細菌を抑制
抗生物質耐性を持つ細菌感染症は、炎症性腸疾患(IBD)の患者や、長期間抗生物質を服用した患者によく見られます。この問題の一因となるのがグラム陰性細菌であるエンテロバクテリア科です。これらの細菌は治療が難しく、感染症対策において大きな課題となっています。
慶應義塾大学医学部と米国のブロード研究所の研究チームは、健康な人の便から分離した18種の細菌株を用いて、有害な腸内細菌の抑制に成功しました。この細菌群は、炭水化物をめぐる競争を通じてエンテロバクテリア科細菌の腸内定着を防ぎ、腸の炎症を軽減することが示されました。
この研究成果は、2024年9月18日にNature誌に掲載され、「Commensal Consortia Decolonize Enterobacteriaceae Via Ecological Control(共生細菌コンソーシアが生態学的制御によりエンテロバクテリア科細菌を排除する)」というタイトルで発表されました。
健康な腸内環境を目指して:細菌の選抜と効果の検証
研究チームは、5人の健康なドナーから採取した便サンプルを基に約40種の細菌株を分離しました。それらを異なる組み合わせで用い、エンテロバクテリア科細菌(大腸菌やクレブシエラ菌など)に感染したマウスに投与する実験を実施しました。その結果、特定の18種の細菌が最も有効に有害細菌を抑制することが確認されました。
慶應義塾大学の本田 賢也博士(Kenya Honda, PhD)を中心とするチームは、これらの細菌株がクレブシエラ菌感染マウスの腸内で、炭水化物代謝に関連する遺伝子(グルコン酸キナーゼや輸送体遺伝子)の発現を抑制し、腸内の栄養競争を増大させていることを発見しました。一方、ブロード研究所のラムニク・ザビエル博士(R
腸内細菌叢の健康を守る18種の有益微生物:炎症と抗生物質耐性細菌を抑制
抗生物質耐性を持つ細菌感染症は、炎症性腸疾患(IBD)の患者や、長期間抗生物質を服用した患者によく見られます。この問題の一因となるのがグラム陰性細菌であるエンテロバクテリア科です。これらの細菌は治療が難しく、感染症対策において大きな課題となっています。
慶應義塾大学医学部と米国のブロード研究所の研究チームは、健康な人の便から分離した18種の細菌株を用いて、有害な腸内細菌の抑制に成功しました。この細菌群は、炭水化物をめぐる競争を通じてエンテロバクテリア科細菌の腸内定着を防ぎ、腸の炎症を軽減することが示されました。
この研究成果は、2024年9月18日にNature誌に掲載され、「Commensal Consortia Decolonize Enterobacteriaceae Via Ecological Control(共生細菌コンソーシアが生態学的制御によりエンテロバクテリア科細菌を排除する)」というタイトルで発表されました。
健康な腸内環境を目指して:細菌の選抜と効果の検証
研究チームは、5人の健康なドナーから採取した便サンプルを基に約40種の細菌株を分離しました。それらを異なる組み合わせで用い、エンテロバクテリア科細菌(大腸菌やクレブシエラ菌など)に感染したマウスに投与する実験を実施しました。その結果、特定の18種の細菌が最も有効に有害細菌を抑制することが確認されました。
慶應義塾大学の本田 賢也博士(Kenya Honda, PhD)を中心とするチームは、これらの細菌株がクレブシエラ菌感染マウスの腸内で、炭水化物代謝に関連する遺伝子(グルコン酸キナーゼや輸送体遺伝子)の発現を抑制し、腸内の栄養競争を増大させていることを発見しました。一方、ブロード研究所のラムニク・ザビエル博士(R
オプトジェネティクス治療の新たな展望:網膜色素変性症に対する革新療法
 網膜変性疾患治療の新たなブレークスルー:ナノスコープ・セラピューティクス社の革新的研究成果
2024年10月21日、網膜変性疾患に対する遺伝子治療を開発する後期臨床段階のバイオテクノロジー企業であるナノスコープ・セラピューティクス社(Nanoscope Therapeutics Inc.)は、同社が手掛けるAAV2-MCO-010オプトジェネティクス治療が動物モデルにおいて網膜のさらなる変性を抑制するという画期的な発見を発表しました。この成果は、眼科学研究の権威ある学術誌である「Translational Vision Science & Technology(TVST, ARVOジャーナル)」に掲載されており、光干渉断層撮影法(OCT)および免疫組織化学分析による評価を通じて明らかにされました。公開された論文のタイトルは「Multi-Characteristic Opsin Therapy to Functionalize Retina, Attenuate Retinal Degeneration, and Restore Vision in Mouse Models of Retinitis Pigmentosa(多特性オプシン療法による網膜の機能化、網膜変性の抑制、および視力回復:網膜色素変性症マウスモデルにおける研究)」です。
MCO-010治療法の特徴と動物モデルでの成果
AAV2-MCO-010(商品名:sonpiretigene isteparvovec)の硝子体内投与を受けた動物モデルでは、網膜の双極細胞の約80%が遺伝子導入されました。この処置を受けたグループでは網膜の厚みに変化が見られず、コントロール群と比較して網膜のさらなる変性が抑制され、網膜細胞層の乱れも防がれていることが確認されました。本研究の結果は、光受容体の変性を経験してい
網膜変性疾患治療の新たなブレークスルー:ナノスコープ・セラピューティクス社の革新的研究成果
2024年10月21日、網膜変性疾患に対する遺伝子治療を開発する後期臨床段階のバイオテクノロジー企業であるナノスコープ・セラピューティクス社(Nanoscope Therapeutics Inc.)は、同社が手掛けるAAV2-MCO-010オプトジェネティクス治療が動物モデルにおいて網膜のさらなる変性を抑制するという画期的な発見を発表しました。この成果は、眼科学研究の権威ある学術誌である「Translational Vision Science & Technology(TVST, ARVOジャーナル)」に掲載されており、光干渉断層撮影法(OCT)および免疫組織化学分析による評価を通じて明らかにされました。公開された論文のタイトルは「Multi-Characteristic Opsin Therapy to Functionalize Retina, Attenuate Retinal Degeneration, and Restore Vision in Mouse Models of Retinitis Pigmentosa(多特性オプシン療法による網膜の機能化、網膜変性の抑制、および視力回復:網膜色素変性症マウスモデルにおける研究)」です。
MCO-010治療法の特徴と動物モデルでの成果
AAV2-MCO-010(商品名:sonpiretigene isteparvovec)の硝子体内投与を受けた動物モデルでは、網膜の双極細胞の約80%が遺伝子導入されました。この処置を受けたグループでは網膜の厚みに変化が見られず、コントロール群と比較して網膜のさらなる変性が抑制され、網膜細胞層の乱れも防がれていることが確認されました。本研究の結果は、光受容体の変性を経験してい
コウモリの免疫の秘密:多様性の高い抗体応答を食事で改善
 果物コウモリはマウスに比べて抗体応答が弱い一方で、抗体の多様性はより高い―このことが新たに発見されました。2023年9月24日にオープンアクセスジャーナルPLOS Biologyに発表されたこの研究は、ダン・クロウリー博士(Dan Crowley, PhD)を中心とする米国コーネル大学の研究チームによるものです。論文のタイトルは「Bats Generate Lower Affinity But Higher Diversity Antibody Responses Than Those of Mice, But Pathogen-Binding Capacity Increases If Protein Is Restricted in Their Diet(「コウモリは低親和性だが多様性の高い抗体応答を生成し、タンパク質摂取が制限されると病原体結合能力が向上する)」です。
コウモリは、パンデミックを引き起こす可能性を秘めたウイルスの貯蔵庫として知られています。これらのウイルスは通常、コウモリ自身には病気を引き起こしませんが、人間に感染した場合、深刻な健康被害を及ぼす可能性があります。コウモリから人間へウイルスが伝播する「スピルオーバー」と呼ばれる現象は、食糧不足などの環境変化に起因し、コウモリの免疫応答に影響を与えることが指摘されています。
これまでの研究では、コウモリの抗体応答が他の哺乳類と比べて弱いことが明らかにされてきました。しかし、これらの研究の多くは、コウモリと共進化してきたウイルスを対象にしていました。今回の研究では、免疫応答をより深く理解するため、果物コウモリとマウスを用い、既知の抗原に対する抗体応答を比較しました。その結果、果物コウモリの抗体応答は、親和性(病原体への結合の強さ)が低い一方で、多様性(抗体の種類)が高いことが判明しました。
さらに
果物コウモリはマウスに比べて抗体応答が弱い一方で、抗体の多様性はより高い―このことが新たに発見されました。2023年9月24日にオープンアクセスジャーナルPLOS Biologyに発表されたこの研究は、ダン・クロウリー博士(Dan Crowley, PhD)を中心とする米国コーネル大学の研究チームによるものです。論文のタイトルは「Bats Generate Lower Affinity But Higher Diversity Antibody Responses Than Those of Mice, But Pathogen-Binding Capacity Increases If Protein Is Restricted in Their Diet(「コウモリは低親和性だが多様性の高い抗体応答を生成し、タンパク質摂取が制限されると病原体結合能力が向上する)」です。
コウモリは、パンデミックを引き起こす可能性を秘めたウイルスの貯蔵庫として知られています。これらのウイルスは通常、コウモリ自身には病気を引き起こしませんが、人間に感染した場合、深刻な健康被害を及ぼす可能性があります。コウモリから人間へウイルスが伝播する「スピルオーバー」と呼ばれる現象は、食糧不足などの環境変化に起因し、コウモリの免疫応答に影響を与えることが指摘されています。
これまでの研究では、コウモリの抗体応答が他の哺乳類と比べて弱いことが明らかにされてきました。しかし、これらの研究の多くは、コウモリと共進化してきたウイルスを対象にしていました。今回の研究では、免疫応答をより深く理解するため、果物コウモリとマウスを用い、既知の抗原に対する抗体応答を比較しました。その結果、果物コウモリの抗体応答は、親和性(病原体への結合の強さ)が低い一方で、多様性(抗体の種類)が高いことが判明しました。
さらに
自己免疫疾患への突破口:cGAS経路が示す治療の可能性
 cGAS酵素の発見により免疫応答の新たな扉を開く:2024年ラスカー基礎医学研究賞を受賞
2024年のアルバート・ラスカー基礎医学研究賞は、外部および自己DNAを感知するcGAS酵素の発見に対して、テキサス大学サウスウェスタン医学センターのチージアン(ジェームズ)・チェン博士(Zhijian "James" Chen, PhD)に授与されました。革新的な思考と卓越した実験によって、チェン博士はDNAがどのようにして免疫および炎症応答を刺激するのかという謎を解明しました。cGASは哺乳類が微生物の侵入者と戦い、抗腫瘍免疫を促進する主要なメカニズムの基盤となる一方で、不適切な活性が自己免疫疾患や炎症性疾患に関与することも明らかにされています。この酵素は、感染症や癌治療を含む幅広い人間の疾患における治療ターゲットとして期待されています。
DNAの役割を超えた発見:細胞質内DNAが警報を発する仕組み
通常、DNAは細胞の核とミトコンドリア内に限定されていますが、それ以外の場所、特に細胞質内に存在するDNAは、微生物の侵入、悪性細胞の存在、または他の病理的プロセスを警告するシグナルとなります。この現象は、1908年にノーベル賞を受賞したイリヤ・メチニコフが初めて言及しましたが、長らくその詳細は不明でした。
2006年、細胞質に二本鎖DNA(dsDNA)が導入されると、インターフェロンβなどの免疫応答分子が急増することが発見されました。この発見を契機に、dsDNAを感知してインターフェロンを産生する経路の解明が競われましたが、真のセンサーを突き止めるには至りませんでした。
cGAS発見への道:画期的な研究
2008年、マイアミ大学と武漢大学の研究者が、インターフェロン産生を制御する重要なタンパク質STINGを発見しましたが、STING自体はDNAを直接感知しません。チェ
cGAS酵素の発見により免疫応答の新たな扉を開く:2024年ラスカー基礎医学研究賞を受賞
2024年のアルバート・ラスカー基礎医学研究賞は、外部および自己DNAを感知するcGAS酵素の発見に対して、テキサス大学サウスウェスタン医学センターのチージアン(ジェームズ)・チェン博士(Zhijian "James" Chen, PhD)に授与されました。革新的な思考と卓越した実験によって、チェン博士はDNAがどのようにして免疫および炎症応答を刺激するのかという謎を解明しました。cGASは哺乳類が微生物の侵入者と戦い、抗腫瘍免疫を促進する主要なメカニズムの基盤となる一方で、不適切な活性が自己免疫疾患や炎症性疾患に関与することも明らかにされています。この酵素は、感染症や癌治療を含む幅広い人間の疾患における治療ターゲットとして期待されています。
DNAの役割を超えた発見:細胞質内DNAが警報を発する仕組み
通常、DNAは細胞の核とミトコンドリア内に限定されていますが、それ以外の場所、特に細胞質内に存在するDNAは、微生物の侵入、悪性細胞の存在、または他の病理的プロセスを警告するシグナルとなります。この現象は、1908年にノーベル賞を受賞したイリヤ・メチニコフが初めて言及しましたが、長らくその詳細は不明でした。
2006年、細胞質に二本鎖DNA(dsDNA)が導入されると、インターフェロンβなどの免疫応答分子が急増することが発見されました。この発見を契機に、dsDNAを感知してインターフェロンを産生する経路の解明が競われましたが、真のセンサーを突き止めるには至りませんでした。
cGAS発見への道:画期的な研究
2008年、マイアミ大学と武漢大学の研究者が、インターフェロン産生を制御する重要なタンパク質STINGを発見しましたが、STING自体はDNAを直接感知しません。チェ
水生トカゲの驚くべき適応:水中で呼吸するバブルの役割を解明
 新たな発見:水生トカゲの「呼吸バブル」が機能的役割を果たす
ビンガムトン大学(ニューヨーク州立大学)の新しい研究によると、水中で呼吸するために特殊な「バブル」を鼻孔に生成する半水生トカゲが発見されました。この研究を主導したのは、ビンガムトン大学の生物学助教授、リンジー・スワーク博士(Lindsey Swierk, PhD)です。スワーク博士は、南コスタリカの熱帯雨林に生息する水生アノールを研究しており、これらのトカゲが水中でバブルを利用する行動をこれまでに観察していました。
「これまで、トカゲが長時間水中に留まれることや、このバブルから酸素を得ていることは分かっていましたが、このバブルが呼吸において実際に機能的な役割を果たしているかどうかは不明でした」とスワーク博士は述べています。
実験で明らかになったバブルの役割
スワーク博士は、このバブルが呼吸に役立つのか、それとも皮膚の性質の副産物に過ぎないのかを検証するため、トカゲの皮膚表面にバブル形成を防ぐ物質を塗布する実験を行いました。通常、トカゲの皮膚は疎水性であり、空気が皮膚に密着してバブルが形成されます。しかし、この物質を塗布すると空気が皮膚に付着せず、バブルが形成されなくなります。
この結果、通常の方法で呼吸する対照群のトカゲは、バブル形成が阻害されたトカゲよりも水中に32%長く留まれることが分かりました。
「この結果は非常に重要です。今回の実験は、バブルが適応的な意義を持つことを初めて実証したものです。バブルを再利用することで、トカゲはより長時間水中に留まれることが分かりました」とスワーク博士は語りました。
捕食者からの逃避手段としてのバブル
アノールトカゲは多くの捕食者から狙われる存在で、鳥やヘビの標的になることが多いといいます。「アノールは森の中では『チキンナゲット』のような存在です」とスワーク
新たな発見:水生トカゲの「呼吸バブル」が機能的役割を果たす
ビンガムトン大学(ニューヨーク州立大学)の新しい研究によると、水中で呼吸するために特殊な「バブル」を鼻孔に生成する半水生トカゲが発見されました。この研究を主導したのは、ビンガムトン大学の生物学助教授、リンジー・スワーク博士(Lindsey Swierk, PhD)です。スワーク博士は、南コスタリカの熱帯雨林に生息する水生アノールを研究しており、これらのトカゲが水中でバブルを利用する行動をこれまでに観察していました。
「これまで、トカゲが長時間水中に留まれることや、このバブルから酸素を得ていることは分かっていましたが、このバブルが呼吸において実際に機能的な役割を果たしているかどうかは不明でした」とスワーク博士は述べています。
実験で明らかになったバブルの役割
スワーク博士は、このバブルが呼吸に役立つのか、それとも皮膚の性質の副産物に過ぎないのかを検証するため、トカゲの皮膚表面にバブル形成を防ぐ物質を塗布する実験を行いました。通常、トカゲの皮膚は疎水性であり、空気が皮膚に密着してバブルが形成されます。しかし、この物質を塗布すると空気が皮膚に付着せず、バブルが形成されなくなります。
この結果、通常の方法で呼吸する対照群のトカゲは、バブル形成が阻害されたトカゲよりも水中に32%長く留まれることが分かりました。
「この結果は非常に重要です。今回の実験は、バブルが適応的な意義を持つことを初めて実証したものです。バブルを再利用することで、トカゲはより長時間水中に留まれることが分かりました」とスワーク博士は語りました。
捕食者からの逃避手段としてのバブル
アノールトカゲは多くの捕食者から狙われる存在で、鳥やヘビの標的になることが多いといいます。「アノールは森の中では『チキンナゲット』のような存在です」とスワーク
次世代ゲノム編集技術「TnpB」で高コレステロール血症治療に進展
 遺伝性高コレステロール血症の将来的な治療法に向けた研究
高コレステロール血症の原因となる遺伝子変異を修正するため、最新のゲノム編集技術「TnpB」を活用する研究が進展しました。この技術は従来のCRISPR-Casシステムを超える効率性と適応力を持ち、動物実験で80%近いコレステロール低下が確認されています。
CRISPR-Casシステムの進化と背景
CRISPR-Casシステムは、元々細菌がウイルス感染に対抗するために進化させた防御機構です。この「遺伝子ハサミ」は、特定のDNA配列を正確に編集できる能力を持ち、過去10年間で医学と科学に革命をもたらしました。
小型化されたゲノム編集ツールの可能性
今回の研究では、従来のCasタンパク質より小型であるTnpBタンパク質に注目。チューリッヒ大学(University of Zurich, UZH)のジェラルド・シュヴァンク博士(Gerald Schwank PhD)率いる研究チームは、効率性を4.4倍向上させた改良型TnpBを開発しました。この進化により、小型であるがゆえに従来のCasシステムよりも体内での輸送が容易になります。
研究で使用されたTnpBは、極限環境に適応する細菌デイノコッカス・ラジオデュランス由来のものです。この菌は放射線や真空などに耐性を持つことで知られています。しかしながら、これまでのTnpBは効率性が低く、標的DNAへの結合能力が限られていました。
改良型TnpBの特性とAIによる予測モデル
シュヴァンク博士の研究チームは、TnpBを核へ効率的に輸送し、より幅広いDNA配列を標的とできるように改良しました。また、10,211箇所の標的サイトで編集効率を検証し、AIモデルを開発。これにより、TnpBが特定の状況でどの程度効率的に機能するかを予測できるようになり、マウス肝臓で75.3%、脳
遺伝性高コレステロール血症の将来的な治療法に向けた研究
高コレステロール血症の原因となる遺伝子変異を修正するため、最新のゲノム編集技術「TnpB」を活用する研究が進展しました。この技術は従来のCRISPR-Casシステムを超える効率性と適応力を持ち、動物実験で80%近いコレステロール低下が確認されています。
CRISPR-Casシステムの進化と背景
CRISPR-Casシステムは、元々細菌がウイルス感染に対抗するために進化させた防御機構です。この「遺伝子ハサミ」は、特定のDNA配列を正確に編集できる能力を持ち、過去10年間で医学と科学に革命をもたらしました。
小型化されたゲノム編集ツールの可能性
今回の研究では、従来のCasタンパク質より小型であるTnpBタンパク質に注目。チューリッヒ大学(University of Zurich, UZH)のジェラルド・シュヴァンク博士(Gerald Schwank PhD)率いる研究チームは、効率性を4.4倍向上させた改良型TnpBを開発しました。この進化により、小型であるがゆえに従来のCasシステムよりも体内での輸送が容易になります。
研究で使用されたTnpBは、極限環境に適応する細菌デイノコッカス・ラジオデュランス由来のものです。この菌は放射線や真空などに耐性を持つことで知られています。しかしながら、これまでのTnpBは効率性が低く、標的DNAへの結合能力が限られていました。
改良型TnpBの特性とAIによる予測モデル
シュヴァンク博士の研究チームは、TnpBを核へ効率的に輸送し、より幅広いDNA配列を標的とできるように改良しました。また、10,211箇所の標的サイトで編集効率を検証し、AIモデルを開発。これにより、TnpBが特定の状況でどの程度効率的に機能するかを予測できるようになり、マウス肝臓で75.3%、脳
黄色ブドウ球菌を制する鍵:IgM抗体の重要性を発見
 MRSAから守る新たな抗体メカニズムを発見
メチシリン耐性黄色ブドウ球菌(MRSA)は、コミュニティや病院での感染症の主要な原因の1つとして知られており、2022年には全世界で約12万人の命を奪いました。それ以外の抗生物質感受性株による死者数はさらに多いとされています。しかし、これまでに黄色ブドウ球菌に対する効果的なワクチンの開発は成功していません。アムステルダムUMCを中心とした研究チームは、感染防御に重要な免疫成分を発見し、将来のワクチン開発に新しい方向性を示しました。この研究結果は2024年9月17日付けでCell Reports Medicine誌に発表されました。オープンアクセス論文「Glycan-Specific IgM Is Critical for Human Immunity to Staphylococcus aureus」(グリカン特異的IgMは黄色ブドウ球菌に対する人の免疫において重要である)」に掲載されています。
IgM抗体の重要性:従来の常識に挑戦
アムステルダムUMCのトランスレーショナル微生物学教授、ニーナ・ファン・ソルヘ博士(Nina van Sorge, PhD)は、「従来の考え方では、IgG抗体が黄色ブドウ球菌を認識し、免疫細胞が細菌を殺すのを助けると考えられてきました。しかし、私たちの研究は、この前提に異議を唱えます。感染中の黄色ブドウ球菌を排除するには、IgGではなくIgM抗体が必要であることを示しました」と述べています。
糖鎖を標的とする抗体が鍵
研究チームは健康な人々の血液中に含まれる黄色ブドウ球菌を認識する抗体を調査しました。特に注目したのは、細菌を包む「糖鎖」です。調査の結果、ほとんどの健康な人がこの糖鎖を認識するIgGおよびIgM抗体を持っていることがわかりました。しかし、実験室での検証では、IgM抗体が細菌
MRSAから守る新たな抗体メカニズムを発見
メチシリン耐性黄色ブドウ球菌(MRSA)は、コミュニティや病院での感染症の主要な原因の1つとして知られており、2022年には全世界で約12万人の命を奪いました。それ以外の抗生物質感受性株による死者数はさらに多いとされています。しかし、これまでに黄色ブドウ球菌に対する効果的なワクチンの開発は成功していません。アムステルダムUMCを中心とした研究チームは、感染防御に重要な免疫成分を発見し、将来のワクチン開発に新しい方向性を示しました。この研究結果は2024年9月17日付けでCell Reports Medicine誌に発表されました。オープンアクセス論文「Glycan-Specific IgM Is Critical for Human Immunity to Staphylococcus aureus」(グリカン特異的IgMは黄色ブドウ球菌に対する人の免疫において重要である)」に掲載されています。
IgM抗体の重要性:従来の常識に挑戦
アムステルダムUMCのトランスレーショナル微生物学教授、ニーナ・ファン・ソルヘ博士(Nina van Sorge, PhD)は、「従来の考え方では、IgG抗体が黄色ブドウ球菌を認識し、免疫細胞が細菌を殺すのを助けると考えられてきました。しかし、私たちの研究は、この前提に異議を唱えます。感染中の黄色ブドウ球菌を排除するには、IgGではなくIgM抗体が必要であることを示しました」と述べています。
糖鎖を標的とする抗体が鍵
研究チームは健康な人々の血液中に含まれる黄色ブドウ球菌を認識する抗体を調査しました。特に注目したのは、細菌を包む「糖鎖」です。調査の結果、ほとんどの健康な人がこの糖鎖を認識するIgGおよびIgM抗体を持っていることがわかりました。しかし、実験室での検証では、IgM抗体が細菌
冬眠動物の研究から学ぶ白内障治療の革新
 冬眠動物の研究が示す手術不要の白内障治療法の可能性
アメリカ国立衛生研究所(NIH)とその共同研究者らは、白内障を動物モデルで逆転させるタンパク質「RNF114」を発見しました。この研究は、加齢によって一般的に発生する目の水晶体の濁りである白内障に対し、手術を伴わない治療法の可能性を示唆しています。本研究は「Journal of Clinical Investigation」誌に2024年9月17日に掲載され、論文タイトルは「Reversible Cold-Induced Lens Opacity in a Hibernator Reveals a Molecular Target for Treating Cataracts(冬眠動物における可逆的な低温誘発性水晶体混濁が示す白内障治療の分子標的)」です。
浙江大学(中国)の白内障外科医で共同研究責任者のシンタオ・シェントゥ医師(Xingchao Shentu, MD)は「白内障手術は効果的ですが、リスクが伴います。また、手術へのアクセスが困難な地域では、白内障が未治療のまま視力喪失の主要因となっています」と述べました。
研究概要
この発見は、NIHの国立眼研究所(NEI)が13線リスという冬眠哺乳類を対象に行っている研究の一環として行われました。13線リスは、網膜の光感受性細胞が主に錐体細胞であるため、色覚の研究に適しています。また、冬眠中に寒冷や代謝ストレスに耐える能力から、さまざまな眼疾患のモデルとしても注目されています。
研究者らは、冬眠中の13線リスの水晶体が摂氏4度で濁る一方、再加熱後に透明に戻ることを発見しました。これに対し、非冬眠動物(この研究ではラット)の水晶体は低温で白内障を発症しましたが、再加熱しても回復しませんでした。
冬眠動物での白内障形成は、低温ストレスに対する細胞の反応であり、
冬眠動物の研究が示す手術不要の白内障治療法の可能性
アメリカ国立衛生研究所(NIH)とその共同研究者らは、白内障を動物モデルで逆転させるタンパク質「RNF114」を発見しました。この研究は、加齢によって一般的に発生する目の水晶体の濁りである白内障に対し、手術を伴わない治療法の可能性を示唆しています。本研究は「Journal of Clinical Investigation」誌に2024年9月17日に掲載され、論文タイトルは「Reversible Cold-Induced Lens Opacity in a Hibernator Reveals a Molecular Target for Treating Cataracts(冬眠動物における可逆的な低温誘発性水晶体混濁が示す白内障治療の分子標的)」です。
浙江大学(中国)の白内障外科医で共同研究責任者のシンタオ・シェントゥ医師(Xingchao Shentu, MD)は「白内障手術は効果的ですが、リスクが伴います。また、手術へのアクセスが困難な地域では、白内障が未治療のまま視力喪失の主要因となっています」と述べました。
研究概要
この発見は、NIHの国立眼研究所(NEI)が13線リスという冬眠哺乳類を対象に行っている研究の一環として行われました。13線リスは、網膜の光感受性細胞が主に錐体細胞であるため、色覚の研究に適しています。また、冬眠中に寒冷や代謝ストレスに耐える能力から、さまざまな眼疾患のモデルとしても注目されています。
研究者らは、冬眠中の13線リスの水晶体が摂氏4度で濁る一方、再加熱後に透明に戻ることを発見しました。これに対し、非冬眠動物(この研究ではラット)の水晶体は低温で白内障を発症しましたが、再加熱しても回復しませんでした。
冬眠動物での白内障形成は、低温ストレスに対する細胞の反応であり、
新種寄生バチが明らかにする生物学の未踏領域
 新種寄生バチの発見で基礎生物学研究の新たな道を切り開く
ミシシッピ州立大学のマシュー・バリンジャー准教授(Matthew Ballinger, PhD)とそのチームが、新種の寄生バチを発見しました。この研究成果は、2024年9月11日付けのNatureに掲載された論文「Drosophila Are Hosts to the First Described Parasitoid Wasp of Adult Flies(ショウジョウバエの成虫を寄主とする初の寄生バチの記述)」に詳しく紹介されています。この新種は、成虫ショウジョウバエに寄生するという、200年以上の寄生バチ研究の中でも非常に珍しい生物学的特性を持っています。
バリンジャー博士は、「これまで、ハエの寄生バチはすべて幼虫期に寄生すると考えられていました。しかし今回、成虫に寄生する種を初めて発見しました」と語り、この発見を「目に見える場所に隠れていた驚くべき未記載の生物学」と評しました。
バックヤードから発見された新種
この発見は、博士課程の学生ローガン・ムーア氏(Logan Moore)による、ミシシッピ州スタークビルの自宅裏庭での感染ショウジョウバエ採集から始まりました。その後、フィールド調査と公的データを組み合わせて、新種が米国東部全域に生息し、生物学研究で最も広く用いられるショウジョウバエに寄生することを明らかにしました。
寄生バチ研究の新たな可能性
バリンジャー博士は、「寄生虫や病原体がショウジョウバエの生物学や行動に与える影響を研究することは、免疫や生殖といった基礎的な生物学的プロセスの解明に役立つ」と述べています。今回の研究では、新種寄生バチの完全な生活史が記録され、実験室で成虫を飼育するための手順も公開されました。
この研究には、ワイオミング大学の寄生バチ専門家スコット・ショー氏(Sc
新種寄生バチの発見で基礎生物学研究の新たな道を切り開く
ミシシッピ州立大学のマシュー・バリンジャー准教授(Matthew Ballinger, PhD)とそのチームが、新種の寄生バチを発見しました。この研究成果は、2024年9月11日付けのNatureに掲載された論文「Drosophila Are Hosts to the First Described Parasitoid Wasp of Adult Flies(ショウジョウバエの成虫を寄主とする初の寄生バチの記述)」に詳しく紹介されています。この新種は、成虫ショウジョウバエに寄生するという、200年以上の寄生バチ研究の中でも非常に珍しい生物学的特性を持っています。
バリンジャー博士は、「これまで、ハエの寄生バチはすべて幼虫期に寄生すると考えられていました。しかし今回、成虫に寄生する種を初めて発見しました」と語り、この発見を「目に見える場所に隠れていた驚くべき未記載の生物学」と評しました。
バックヤードから発見された新種
この発見は、博士課程の学生ローガン・ムーア氏(Logan Moore)による、ミシシッピ州スタークビルの自宅裏庭での感染ショウジョウバエ採集から始まりました。その後、フィールド調査と公的データを組み合わせて、新種が米国東部全域に生息し、生物学研究で最も広く用いられるショウジョウバエに寄生することを明らかにしました。
寄生バチ研究の新たな可能性
バリンジャー博士は、「寄生虫や病原体がショウジョウバエの生物学や行動に与える影響を研究することは、免疫や生殖といった基礎的な生物学的プロセスの解明に役立つ」と述べています。今回の研究では、新種寄生バチの完全な生活史が記録され、実験室で成虫を飼育するための手順も公開されました。
この研究には、ワイオミング大学の寄生バチ専門家スコット・ショー氏(Sc
320種の新種微生物が明らかに!食品安全性への影響
 2024年8月29日付でCell誌に掲載された研究によると、普段私たちが摂取する食品に含まれる微生物群とそれがヒトの腸内細菌叢に与える影響について、これまでにない幅広い知見が示されました。この多機関による研究チームは、3つの異なる糞便サンプルコレクションから計2,500以上のメタゲノムサンプルを解析し、特定の食品の摂取に関連する腸内微生物を特定しました。この結果は食品の安全性や公衆衛生、さらなる研究の指針となる重要な意義を持っています。
食品微生物の網羅的調査
本研究は、イタリア・トレント大学のニッコロ・カルリーノ博士(Niccolò Carlino, PhD)を中心に行われ、新たに配列解析された食品メタゲノムデータを統合して「食品メタゲノムデータ(cFMD: curated Food Metagenomic Data)」というリソースを作成しました。
このデータベースには、食品関連の主要な2つの細菌ドメインと30の属に関するメタデータ、解析ツール、可視化機能が含まれており、食品科学分野の研究に大きく貢献します。
興味深いことに、この研究で特定された微生物種のうち320種はこれまでのいかなるデータベースにも記載されていない新種でした。さらに、半数近くの微生物は参照ゲノムを持たず、食品中の微生物の全容解明にはまだ課題が残されていることが示唆されています。
食品微生物とヒト腸内細菌叢の関連
研究の中でも特に注目すべきは、食品に含まれる微生物がヒト腸内細菌叢に与える潜在的な影響に関する結果です。食品由来の微生物は平均的な成人の腸内細菌叢において約3%を占めています。この割合は一見少なく見えるかもしれませんが、腸内細菌の多様性や機能性を維持する上で重要な役割を果たします。
また、ラクトカセイバチルス・パラカセイのような特定の細菌は、ヒトの腸内で効率的に定着できるこ
2024年8月29日付でCell誌に掲載された研究によると、普段私たちが摂取する食品に含まれる微生物群とそれがヒトの腸内細菌叢に与える影響について、これまでにない幅広い知見が示されました。この多機関による研究チームは、3つの異なる糞便サンプルコレクションから計2,500以上のメタゲノムサンプルを解析し、特定の食品の摂取に関連する腸内微生物を特定しました。この結果は食品の安全性や公衆衛生、さらなる研究の指針となる重要な意義を持っています。
食品微生物の網羅的調査
本研究は、イタリア・トレント大学のニッコロ・カルリーノ博士(Niccolò Carlino, PhD)を中心に行われ、新たに配列解析された食品メタゲノムデータを統合して「食品メタゲノムデータ(cFMD: curated Food Metagenomic Data)」というリソースを作成しました。
このデータベースには、食品関連の主要な2つの細菌ドメインと30の属に関するメタデータ、解析ツール、可視化機能が含まれており、食品科学分野の研究に大きく貢献します。
興味深いことに、この研究で特定された微生物種のうち320種はこれまでのいかなるデータベースにも記載されていない新種でした。さらに、半数近くの微生物は参照ゲノムを持たず、食品中の微生物の全容解明にはまだ課題が残されていることが示唆されています。
食品微生物とヒト腸内細菌叢の関連
研究の中でも特に注目すべきは、食品に含まれる微生物がヒト腸内細菌叢に与える潜在的な影響に関する結果です。食品由来の微生物は平均的な成人の腸内細菌叢において約3%を占めています。この割合は一見少なく見えるかもしれませんが、腸内細菌の多様性や機能性を維持する上で重要な役割を果たします。
また、ラクトカセイバチルス・パラカセイのような特定の細菌は、ヒトの腸内で効率的に定着できるこ
セロトニン受容体の光操作で視覚情報の抑制メカニズムを解明
 セロトニン受容体と脳内情報伝達の謎に迫る
ルール大学ボーフムのディルク・ヤンケ博士(Dirk Jancke, PhD)は、神経細胞間の情報伝達を媒介するセロトニン受容体の役割について解明しました。彼が執筆したオープンアクセス論文「Gain Control of Sensory Input Across Polysynaptic Circuitries in Mouse Visual Cortex by a Single G Protein-Coupled Receptor Type (5-HT2A)」(「単一のGタンパク質共役型受容体タイプ(5-HT2A)によるマウス視覚皮質内の多シナプス回路を介した感覚入力の制御」)が、2024年9月14日にNature Communications誌に掲載されました。
受容体の多様性とセロトニンの複雑な作用
セロトニンは少なくとも14種類の受容体を介して脳全体の神経細胞活動を調節します。しかし、これらの受容体は抑制的にも活性化的にも作用し、異なる細胞タイプ間での相互作用も絡むため、研究が困難とされています。
光遺伝学による新たな手法で解明
ステファン・ヘルリッツェ教授(Stefan Herlitze)の研究チームは、光遺伝学を活用してこの問題にアプローチしました。ウイルスを用いて神経細胞に光感受性の受容体タンパク質を導入し、特定の受容体を精密に操作可能な方法を開発しました。これにより、5-HT2A受容体が視覚情報の強度を選択的に抑制することを発見しました。
精神疾患治療への可能性
この研究成果は、LSDによる幻覚作用を含む、セロトニン受容体の異常活性化が引き起こす脳内メカニズムの解明に寄与するとされています。また、特定の受容体をターゲットにした新しい治療法の開発が期待されます。
モデル化と多角的研究
人工知能を活用
セロトニン受容体と脳内情報伝達の謎に迫る
ルール大学ボーフムのディルク・ヤンケ博士(Dirk Jancke, PhD)は、神経細胞間の情報伝達を媒介するセロトニン受容体の役割について解明しました。彼が執筆したオープンアクセス論文「Gain Control of Sensory Input Across Polysynaptic Circuitries in Mouse Visual Cortex by a Single G Protein-Coupled Receptor Type (5-HT2A)」(「単一のGタンパク質共役型受容体タイプ(5-HT2A)によるマウス視覚皮質内の多シナプス回路を介した感覚入力の制御」)が、2024年9月14日にNature Communications誌に掲載されました。
受容体の多様性とセロトニンの複雑な作用
セロトニンは少なくとも14種類の受容体を介して脳全体の神経細胞活動を調節します。しかし、これらの受容体は抑制的にも活性化的にも作用し、異なる細胞タイプ間での相互作用も絡むため、研究が困難とされています。
光遺伝学による新たな手法で解明
ステファン・ヘルリッツェ教授(Stefan Herlitze)の研究チームは、光遺伝学を活用してこの問題にアプローチしました。ウイルスを用いて神経細胞に光感受性の受容体タンパク質を導入し、特定の受容体を精密に操作可能な方法を開発しました。これにより、5-HT2A受容体が視覚情報の強度を選択的に抑制することを発見しました。
精神疾患治療への可能性
この研究成果は、LSDによる幻覚作用を含む、セロトニン受容体の異常活性化が引き起こす脳内メカニズムの解明に寄与するとされています。また、特定の受容体をターゲットにした新しい治療法の開発が期待されます。
モデル化と多角的研究
人工知能を活用
クマムシの耐性タンパク質がヒト細胞保存の未来を切り開く
 クマムシは、乾燥、高放射線、極端な温度などの過酷な環境にも耐えうる微小な生物で、その驚異的な耐久性は長年にわたり科学者らの関心を引いてきました。ワイオミング大学のシルビア・サンチェス=マルティネス博士(Silvia Sanchez-Martinez, PhD)率いる最近の研究は、クマムシの卓越した耐久性の生物学的メカニズムが、人間の細胞保存やストレス管理に大きな可能性を秘めていることを明らかにしました。このオープンアクセス研究は、2024年3月19日付でProtein Scienceに掲載されました。
この研究は、細胞質豊富熱可溶性(CAHS: cytoplasmic abundant heat soluble)タンパク質として知られる特定のクラスのタンパク質に焦点を当てています。これらのタンパク質は、クマムシが環境ストレス、例えば脱水時に休眠状態(生体静止)に入ることを可能にする重要な役割を果たしています。この状態では、クマムシは代謝プロセスを効果的に停止し、通常なら致命的な環境条件を生き延びることができます。
研究チームは、CAHSタンパク質をヒト細胞に導入したところ、これらのタンパク質がゲル状の構造を形成し、細胞代謝を遅らせると同時にストレス耐性を高めることを確認しました。この研究の論文タイトルは、「Labile Assembly of a Tardigrade Protein Induces Biostasis(クマムシタンパク質の不安定な集合が生体静止を誘発する)」です。
CAHSタンパク質がヒト細胞において生体静止を誘発する能力は、一連の実験を通じて確認されました。これらの実験では、CAHSタンパク質の導入により、細胞の代謝活動が低下するだけでなく、温度変化や脱水といった外的ストレス因子に対する抵抗性も向上しました。この研究によると、これらのゲル状構造
クマムシは、乾燥、高放射線、極端な温度などの過酷な環境にも耐えうる微小な生物で、その驚異的な耐久性は長年にわたり科学者らの関心を引いてきました。ワイオミング大学のシルビア・サンチェス=マルティネス博士(Silvia Sanchez-Martinez, PhD)率いる最近の研究は、クマムシの卓越した耐久性の生物学的メカニズムが、人間の細胞保存やストレス管理に大きな可能性を秘めていることを明らかにしました。このオープンアクセス研究は、2024年3月19日付でProtein Scienceに掲載されました。
この研究は、細胞質豊富熱可溶性(CAHS: cytoplasmic abundant heat soluble)タンパク質として知られる特定のクラスのタンパク質に焦点を当てています。これらのタンパク質は、クマムシが環境ストレス、例えば脱水時に休眠状態(生体静止)に入ることを可能にする重要な役割を果たしています。この状態では、クマムシは代謝プロセスを効果的に停止し、通常なら致命的な環境条件を生き延びることができます。
研究チームは、CAHSタンパク質をヒト細胞に導入したところ、これらのタンパク質がゲル状の構造を形成し、細胞代謝を遅らせると同時にストレス耐性を高めることを確認しました。この研究の論文タイトルは、「Labile Assembly of a Tardigrade Protein Induces Biostasis(クマムシタンパク質の不安定な集合が生体静止を誘発する)」です。
CAHSタンパク質がヒト細胞において生体静止を誘発する能力は、一連の実験を通じて確認されました。これらの実験では、CAHSタンパク質の導入により、細胞の代謝活動が低下するだけでなく、温度変化や脱水といった外的ストレス因子に対する抵抗性も向上しました。この研究によると、これらのゲル状構造
AI技術が創薬に革命を:仮想環境での遺伝子実験の新境地
 AIを活用した仮想実験室「CREME」が遺伝子研究に新たな可能性を開く
遺伝子変異の中には、治療法として活用できるものが隠れているかもしれません。しかし、その可能性を証明するためには、膨大な時間とコストを要する実験が必要です。Cold Spring Harbor Laboratory(CSHL)のピーター・クー博士(Peter Koo, PhD)とその研究チームは、この課題に革新的なアプローチを提供しました。新たに開発されたAI搭載の仮想実験室「CREME(cis-regulatory element model explanations)」は、わずかな操作で数千の仮想実験を実行できるプラットフォームです。このツールを活用することで、遺伝子研究者はゲノムの重要領域を特定し、その機能を理解する第一歩を踏み出すことが可能になります。
CREMEの基本原理とCRISPRiとの関連性
CREMEは、CRISPR干渉法(CRISPRi)に基づいて設計されています。CRISPRiは、特定の遺伝子の活性を抑制する技術ですが、実験室で実施するには非常に手間がかかり、スケールも限られています。一方、CREMEは仮想環境で同様の遺伝子操作を行い、その影響を予測します。この点について、クー博士は次のように述べています。
「現実の実験では、CRISPRiの規模や範囲に制約があります。しかし仮想実験では、この制約を超えることができ、前例のない規模で数十万の実験を行うことが可能です。」
CREMEの応用とAIツール「Enformer」の解析
CREMEの初期試験として、研究チームはAI駆動のゲノム解析ツール「Enformer」を使用しました。EnformerはDNA配列から遺伝子発現を予測する強力なアルゴリズムを備えていますが、その内部プロセスについては十分に理解されていません。クー博
AIを活用した仮想実験室「CREME」が遺伝子研究に新たな可能性を開く
遺伝子変異の中には、治療法として活用できるものが隠れているかもしれません。しかし、その可能性を証明するためには、膨大な時間とコストを要する実験が必要です。Cold Spring Harbor Laboratory(CSHL)のピーター・クー博士(Peter Koo, PhD)とその研究チームは、この課題に革新的なアプローチを提供しました。新たに開発されたAI搭載の仮想実験室「CREME(cis-regulatory element model explanations)」は、わずかな操作で数千の仮想実験を実行できるプラットフォームです。このツールを活用することで、遺伝子研究者はゲノムの重要領域を特定し、その機能を理解する第一歩を踏み出すことが可能になります。
CREMEの基本原理とCRISPRiとの関連性
CREMEは、CRISPR干渉法(CRISPRi)に基づいて設計されています。CRISPRiは、特定の遺伝子の活性を抑制する技術ですが、実験室で実施するには非常に手間がかかり、スケールも限られています。一方、CREMEは仮想環境で同様の遺伝子操作を行い、その影響を予測します。この点について、クー博士は次のように述べています。
「現実の実験では、CRISPRiの規模や範囲に制約があります。しかし仮想実験では、この制約を超えることができ、前例のない規模で数十万の実験を行うことが可能です。」
CREMEの応用とAIツール「Enformer」の解析
CREMEの初期試験として、研究チームはAI駆動のゲノム解析ツール「Enformer」を使用しました。EnformerはDNA配列から遺伝子発現を予測する強力なアルゴリズムを備えていますが、その内部プロセスについては十分に理解されていません。クー博
抗NMDA受容体脳炎の発見と治療の新たな展開
 病院で目覚め、過去1か月の記憶が一切ない状況を想像してみてください。医師によると、その間に暴力的な発作や被害妄想に苦しみ、自身が双極性障害を患っていると信じ込んでいたといいます。しかし、特別な検査の結果、神経内科医によって「抗NMDA受容体脳炎(anti-NMDAR encephalitis)」という稀な自己免疫疾患であると診断されました。これは、ニューヨーク・ポスト紙の記者スザンナ・キャハラン(Susannah Cahalan)が経験したことであり、彼女はその体験をベストセラー回顧録「Brain on Fire: My Month of Madness(邦題:炎に包まれた脳)」として執筆しました。
抗NMDA受容体脳炎は、幻覚や記憶喪失、精神病を引き起こす可能性があると、コールド・スプリング・ハーバー研究所のヒロ・フルカワ博士(Hiro Furukawa, PhD, ヒロ・フルカワ博士)は述べています。この病気は主に25~35歳の女性に影響を与えますが、それは統合失調症が発症する年齢とほぼ同じです。しかし、抗NMDA受容体脳炎で起きているのは、まったく別のことです。フルカワ博士は、認知や記憶において重要な役割を果たすNMDA受容体(NMDAR: N-methyl-D-aspartate receptor)の専門家です。「抗NMDA受容体脳炎では、抗体がこれらの受容体に結合し、その機能を阻害します」と彼は説明します。この自己免疫反応により脳が炎症を起こし、「炎に包まれた脳」と表現されるのです。
治療法はいくつか存在しますが、その効果は症状の重さによって異なります。フルカワ博士の研究室による新たな研究が、その理由を説明するかもしれません。最近の研究で、フルカワ博士と同僚らは3人の患者の抗体がどのようにNMDA受容体に結合するかをマッピングしました。その結果、それぞれの
病院で目覚め、過去1か月の記憶が一切ない状況を想像してみてください。医師によると、その間に暴力的な発作や被害妄想に苦しみ、自身が双極性障害を患っていると信じ込んでいたといいます。しかし、特別な検査の結果、神経内科医によって「抗NMDA受容体脳炎(anti-NMDAR encephalitis)」という稀な自己免疫疾患であると診断されました。これは、ニューヨーク・ポスト紙の記者スザンナ・キャハラン(Susannah Cahalan)が経験したことであり、彼女はその体験をベストセラー回顧録「Brain on Fire: My Month of Madness(邦題:炎に包まれた脳)」として執筆しました。
抗NMDA受容体脳炎は、幻覚や記憶喪失、精神病を引き起こす可能性があると、コールド・スプリング・ハーバー研究所のヒロ・フルカワ博士(Hiro Furukawa, PhD, ヒロ・フルカワ博士)は述べています。この病気は主に25~35歳の女性に影響を与えますが、それは統合失調症が発症する年齢とほぼ同じです。しかし、抗NMDA受容体脳炎で起きているのは、まったく別のことです。フルカワ博士は、認知や記憶において重要な役割を果たすNMDA受容体(NMDAR: N-methyl-D-aspartate receptor)の専門家です。「抗NMDA受容体脳炎では、抗体がこれらの受容体に結合し、その機能を阻害します」と彼は説明します。この自己免疫反応により脳が炎症を起こし、「炎に包まれた脳」と表現されるのです。
治療法はいくつか存在しますが、その効果は症状の重さによって異なります。フルカワ博士の研究室による新たな研究が、その理由を説明するかもしれません。最近の研究で、フルカワ博士と同僚らは3人の患者の抗体がどのようにNMDA受容体に結合するかをマッピングしました。その結果、それぞれの
くしゃみと咳の独立した神経経路を発見!呼吸器疾患治療に新たな道
 くしゃみと咳の神経回路を解明:ワシントン大学医学部の研究が呼吸器治療の未来を切り拓く
ワシントン大学医学部セントルイス校の研究者らは、呼吸器疾患治療に革命をもたらす可能性のある画期的な発見を発表しました。同校の研究によれば、通常一緒に起こると考えられていた「くしゃみ」と「咳」の反射が、全く異なる神経経路によって制御されていることが明らかになりました。この発見は2024年9月6日付のオープンアクセスジャーナルCellに掲載され、「Divergent Sensory Pathways of Sneezing and Coughing(くしゃみと咳の異なる感覚経路)」というタイトルで発表されました。
研究を主導したのは秦柳博士(Qin Liu, PhD)です。彼女らの研究チームは、くしゃみを引き起こす神経細胞「MrgprC11+」と、咳を制御する「SST+」神経細胞という2種類の感覚ニューロンを特定しました。この発見は、くしゃみと咳が同じ感覚経路を共有しているという従来の考え方を根本から覆し、新たな医療研究や治療法の道を開くものです。
発見の影響
くしゃみや咳は、鼻や肺から異物や病原体を排出する重要な防御反射です。しかし、これらが慢性的または過剰に発生すると、不快感や睡眠障害、身体的負担を引き起こす可能性があります。現在の治療法では、抗ヒスタミン剤や咳止め薬などの幅広いアプローチが一般的ですが、これらはくしゃみや咳の原因となる特定のニューロンをターゲットにしていないため、副作用が生じることがあります。
今回の研究で明らかになった個別の神経経路を活用することで、より安全かつ効果的な治療法の開発が期待されています。例えば、MrgprC11+ニューロンを抑制する薬は、他の身体機能に影響を与えることなくくしゃみを止める可能性があります。一方で、SST+ニューロンを標的にした
くしゃみと咳の神経回路を解明:ワシントン大学医学部の研究が呼吸器治療の未来を切り拓く
ワシントン大学医学部セントルイス校の研究者らは、呼吸器疾患治療に革命をもたらす可能性のある画期的な発見を発表しました。同校の研究によれば、通常一緒に起こると考えられていた「くしゃみ」と「咳」の反射が、全く異なる神経経路によって制御されていることが明らかになりました。この発見は2024年9月6日付のオープンアクセスジャーナルCellに掲載され、「Divergent Sensory Pathways of Sneezing and Coughing(くしゃみと咳の異なる感覚経路)」というタイトルで発表されました。
研究を主導したのは秦柳博士(Qin Liu, PhD)です。彼女らの研究チームは、くしゃみを引き起こす神経細胞「MrgprC11+」と、咳を制御する「SST+」神経細胞という2種類の感覚ニューロンを特定しました。この発見は、くしゃみと咳が同じ感覚経路を共有しているという従来の考え方を根本から覆し、新たな医療研究や治療法の道を開くものです。
発見の影響
くしゃみや咳は、鼻や肺から異物や病原体を排出する重要な防御反射です。しかし、これらが慢性的または過剰に発生すると、不快感や睡眠障害、身体的負担を引き起こす可能性があります。現在の治療法では、抗ヒスタミン剤や咳止め薬などの幅広いアプローチが一般的ですが、これらはくしゃみや咳の原因となる特定のニューロンをターゲットにしていないため、副作用が生じることがあります。
今回の研究で明らかになった個別の神経経路を活用することで、より安全かつ効果的な治療法の開発が期待されています。例えば、MrgprC11+ニューロンを抑制する薬は、他の身体機能に影響を与えることなくくしゃみを止める可能性があります。一方で、SST+ニューロンを標的にした
チベット野生シャクヤクのゲノム研究で進化の謎に迫る
 チベット野生シャクヤク(は、その巨大なゲノムと特定の環境条件で知られ、青海チベット高原の高地で生育する植物です。これまでシャクヤクのゲノムを解読する試みがありましたが、ゲノムの質を向上させることや野生種のリソースを拡充する課題が残されていました。このため、ゲノム支援型育種戦略を樹立するために、さらに詳細な研究が必要とされてきました。
2023年11月10日に公開された論文「High-Quality Assembly and Methylome of a Tibetan Wild Tree Peony Genome (Paeonia ludlowii) Reveal the Evolution of Giant Genome Architecture(高品質なチベット野生シャクヤクゲノムのアセンブリとメチロームに基づく巨大ゲノム構造の進化)」は、この課題に取り組んでいます。本研究は華中農業大学およびチベット農牧科学研究院の研究者らによって行われ、Horticulture Research誌にオープンアクセスで掲載されました(DOI: 10.1093/hr/uhad241)。
本研究は、P. ludlowii のゲノムにおける最も包括的なアセンブリを提供し、染色体の変動、トランスポゾン活性、DNAメチル化がどのように種の進化を促進したかを明らかにしています。
本研究により、P. ludlowii は頻繁な染色体減少やセントロメアの再配列など、重要なゲノム変化を経験してきたことが判明しました。これらの変化やトランスポゾンの活性化は、青海チベット高原の過酷な環境条件に適応するのを可能にしたと考えられます。他の多くの植物種と異なり、P. ludlowii には最近の全ゲノム重複の証拠が見られず、独特の進化経路を示しています。
さらに、解析の結果、油脂生合成や花の特性に関連
チベット野生シャクヤク(は、その巨大なゲノムと特定の環境条件で知られ、青海チベット高原の高地で生育する植物です。これまでシャクヤクのゲノムを解読する試みがありましたが、ゲノムの質を向上させることや野生種のリソースを拡充する課題が残されていました。このため、ゲノム支援型育種戦略を樹立するために、さらに詳細な研究が必要とされてきました。
2023年11月10日に公開された論文「High-Quality Assembly and Methylome of a Tibetan Wild Tree Peony Genome (Paeonia ludlowii) Reveal the Evolution of Giant Genome Architecture(高品質なチベット野生シャクヤクゲノムのアセンブリとメチロームに基づく巨大ゲノム構造の進化)」は、この課題に取り組んでいます。本研究は華中農業大学およびチベット農牧科学研究院の研究者らによって行われ、Horticulture Research誌にオープンアクセスで掲載されました(DOI: 10.1093/hr/uhad241)。
本研究は、P. ludlowii のゲノムにおける最も包括的なアセンブリを提供し、染色体の変動、トランスポゾン活性、DNAメチル化がどのように種の進化を促進したかを明らかにしています。
本研究により、P. ludlowii は頻繁な染色体減少やセントロメアの再配列など、重要なゲノム変化を経験してきたことが判明しました。これらの変化やトランスポゾンの活性化は、青海チベット高原の過酷な環境条件に適応するのを可能にしたと考えられます。他の多くの植物種と異なり、P. ludlowii には最近の全ゲノム重複の証拠が見られず、独特の進化経路を示しています。
さらに、解析の結果、油脂生合成や花の特性に関連
細胞の言語を解読:プロテオミクスツールが拓く新時代
 細胞間の会話を解読する新技術—細胞表面プロテオミクスの革新
約何億年も前、単細胞生物が結集し、多細胞生物として進化しました。その多細胞世界の土台となっているのが細胞表面です。細胞を取り囲む細胞膜(プラズマ膜)は、個々の細胞が出会い、相互にコミュニケーションをとる場であり、タンパク質やその他の分子を通じて行われる独自の「言語」で成り立っています。この細胞間の会話を理解すること—どのタンパク質が存在し、どのように相互作用し、どのように変化しているのかを把握すること—は、生物の機能や病気のメカニズムを解明するための重要な鍵とされています。
現在、HHMIのジャネリア研究キャンパス、スタンフォード大学、ブロード研究所の研究者たちが、細胞間のコミュニケーションを解明し、新たな知見を引き出すためのユーザーフレンドリーなツールを開発しています。これにより、科学者は細胞の「言語」を翻訳し、細胞がどのように情報を交換しているのかを明らかにすることが可能になります。
「人体を細胞社会と捉えると、その社会の中で使われている言語を解読し、細胞同士がどのようにコミュニケーションをとっているのかを理解することが私たちの目標です」と語るのは、ジャネリア研究キャンパスのグループリーダーであり、本研究の主要著者の一人であるジエフ・リー博士(Jiefu Li, PhD)です。「この言語を段階的に解明するための手法を開発し、その情報を基にさらなる発見を目指しています。」
プロテオミクスの力を活かす
新しい研究は、細胞間コミュニケーションに関する革新的な知見を提供するだけでなく、生物学の重要な謎を解き明かすための基盤として「プロテオミクス」(生細胞や生物全体のタンパク質を研究する分野)の可能性を示しています。
「まずプロテオミクスのツールを構築し、それを特定の生物学的疑問に適用して発見を行いまし
細胞間の会話を解読する新技術—細胞表面プロテオミクスの革新
約何億年も前、単細胞生物が結集し、多細胞生物として進化しました。その多細胞世界の土台となっているのが細胞表面です。細胞を取り囲む細胞膜(プラズマ膜)は、個々の細胞が出会い、相互にコミュニケーションをとる場であり、タンパク質やその他の分子を通じて行われる独自の「言語」で成り立っています。この細胞間の会話を理解すること—どのタンパク質が存在し、どのように相互作用し、どのように変化しているのかを把握すること—は、生物の機能や病気のメカニズムを解明するための重要な鍵とされています。
現在、HHMIのジャネリア研究キャンパス、スタンフォード大学、ブロード研究所の研究者たちが、細胞間のコミュニケーションを解明し、新たな知見を引き出すためのユーザーフレンドリーなツールを開発しています。これにより、科学者は細胞の「言語」を翻訳し、細胞がどのように情報を交換しているのかを明らかにすることが可能になります。
「人体を細胞社会と捉えると、その社会の中で使われている言語を解読し、細胞同士がどのようにコミュニケーションをとっているのかを理解することが私たちの目標です」と語るのは、ジャネリア研究キャンパスのグループリーダーであり、本研究の主要著者の一人であるジエフ・リー博士(Jiefu Li, PhD)です。「この言語を段階的に解明するための手法を開発し、その情報を基にさらなる発見を目指しています。」
プロテオミクスの力を活かす
新しい研究は、細胞間コミュニケーションに関する革新的な知見を提供するだけでなく、生物学の重要な謎を解き明かすための基盤として「プロテオミクス」(生細胞や生物全体のタンパク質を研究する分野)の可能性を示しています。
「まずプロテオミクスのツールを構築し、それを特定の生物学的疑問に適用して発見を行いまし
再生医療の新時代:脂肪由来幹細胞を活用した骨再生技術
 骨再生の新しいフロンティア
華南理工大学生物医学工学部の研究者らが、電気紡糸膜を使用した画期的な管状足場材料を開発しました。この足場は、自然の骨構造を模倣し、ラットの脂肪由来幹細胞(rADSCs)が最適に機能する環境を提供します。この研究により、頭蓋骨の重大な骨欠損部分における骨再生が大幅に向上しました。この成果は、骨欠損修復における新しい治療法の可能性を示し、再生医療および組織工学の分野において大きな進歩をもたらします。
骨組織工学への新しいアプローチ
骨欠損の治療では、伝統的な方法である自家移植片や異種移植片は、ドナー不足や適合性の問題、免疫拒絶反応などの課題があり、広範囲での応用が難しいとされています。一方、骨組織工学は、細胞と生体材料を組み合わせた新たな治療法として注目されています。
脂肪由来幹細胞(ADSCs)は、骨分化能力に優れ、骨再生研究の分野で特に関心を集めています。ただし、ADSCsを単独で注入する方法では生存率が低く、足場材料と組み合わせることで骨再生効果が大幅に向上することが分かっています。
研究チームは、電気紡糸や3Dプリンティング技術を用いて骨を模倣する足場を開発し、化学的信号(成長因子)を物理的な構造に統合することで、ADSCsの骨分化をさらに促進する手法を模索しました。
研究のブレイクスルー
研究者らは、電気紡糸技術を用いて作製した多層複合ナノファイバー膜を用い、管状足場を開発しました。この材料には、以下の成分が含まれています。
ポリカプロラクトン(PCL)ポリ(乳酸-グリコール酸)(PLGA)ナノハイドロキシアパタイト(HAp)
特定の条件下でこれらの多層膜は、3次元の足場に自発的に変形し、骨を模倣する微小環境を形成します。この環境がrADSCsの増殖と骨分化を大幅に促進することが確認されました。
骨再生効果の確認と未
骨再生の新しいフロンティア
華南理工大学生物医学工学部の研究者らが、電気紡糸膜を使用した画期的な管状足場材料を開発しました。この足場は、自然の骨構造を模倣し、ラットの脂肪由来幹細胞(rADSCs)が最適に機能する環境を提供します。この研究により、頭蓋骨の重大な骨欠損部分における骨再生が大幅に向上しました。この成果は、骨欠損修復における新しい治療法の可能性を示し、再生医療および組織工学の分野において大きな進歩をもたらします。
骨組織工学への新しいアプローチ
骨欠損の治療では、伝統的な方法である自家移植片や異種移植片は、ドナー不足や適合性の問題、免疫拒絶反応などの課題があり、広範囲での応用が難しいとされています。一方、骨組織工学は、細胞と生体材料を組み合わせた新たな治療法として注目されています。
脂肪由来幹細胞(ADSCs)は、骨分化能力に優れ、骨再生研究の分野で特に関心を集めています。ただし、ADSCsを単独で注入する方法では生存率が低く、足場材料と組み合わせることで骨再生効果が大幅に向上することが分かっています。
研究チームは、電気紡糸や3Dプリンティング技術を用いて骨を模倣する足場を開発し、化学的信号(成長因子)を物理的な構造に統合することで、ADSCsの骨分化をさらに促進する手法を模索しました。
研究のブレイクスルー
研究者らは、電気紡糸技術を用いて作製した多層複合ナノファイバー膜を用い、管状足場を開発しました。この材料には、以下の成分が含まれています。
ポリカプロラクトン(PCL)ポリ(乳酸-グリコール酸)(PLGA)ナノハイドロキシアパタイト(HAp)
特定の条件下でこれらの多層膜は、3次元の足場に自発的に変形し、骨を模倣する微小環境を形成します。この環境がrADSCsの増殖と骨分化を大幅に促進することが確認されました。
骨再生効果の確認と未
胆汁酸と肝障害:ミトコンドリア機能への影響を探る最新研究
 胆汁酸が肝障害に与える影響を探る新たな知見:ミトコンドリア機能、炎症、自食作用の役割
胆汁酸(BAs)は、肝臓でコレステロール代謝から生成される重要なシグナル分子であり、脂質の消化吸収に不可欠です。しかし、胆汁うっ滞(cholestasis)と呼ばれる胆汁の流れが阻害される状態では、肝臓や血流に疎水性の胆汁酸が病的に蓄積します。この蓄積は、肝臓への損傷を悪化させるだけでなく、細胞プロセスに重大な影響を与えます。本レビューでは、胆汁酸がミトコンドリア機能、エンドプラスミックレチiculum(ER)ストレス、炎症、自食作用(オートファジー)を通じて肝障害に寄与する仕組みに関する最新の知見を紹介しています。
肝細胞アポトーシスの経路
ミトコンドリアは、アポトーシス(プログラム化された細胞死)の調節において中心的な役割を果たします。胆汁うっ滞性肝障害では、胆汁酸が以下の2つの主要なアポトーシス経路に影響を与えることが知られています。
受容体非依存性経路
胆汁酸は、ミトコンドリア電子伝達系(ETC)を直接的に損傷し、活性酸素種(ROS)の生成を促進します。これにより酸化ストレスが引き起こされ、ミトコンドリア透過性遷移孔(mPTP)が開き、細胞死が進行します。この際、ミトコンドリアから放出されたシトクロムCは細胞質に移行し、内因性アポトーシス経路を活性化してカスパーゼ酵素を作動させます。
受容体依存性経路
胆汁酸は、FAS受容体などの細胞膜上の死受容体と相互作用し、アポトーシスを引き起こします。この相互作用は、細胞死誘導シグナル複合体の形成をもたらし、下流のカスパーゼを活性化します。さらに、BAXやBAKなどのBcl-2ファミリータンパク質がミトコンドリア膜の透過性を促進します。
ERストレスと炎症反応
エンドプラスミックレチiculum(ER)は、タンパク質合成
胆汁酸が肝障害に与える影響を探る新たな知見:ミトコンドリア機能、炎症、自食作用の役割
胆汁酸(BAs)は、肝臓でコレステロール代謝から生成される重要なシグナル分子であり、脂質の消化吸収に不可欠です。しかし、胆汁うっ滞(cholestasis)と呼ばれる胆汁の流れが阻害される状態では、肝臓や血流に疎水性の胆汁酸が病的に蓄積します。この蓄積は、肝臓への損傷を悪化させるだけでなく、細胞プロセスに重大な影響を与えます。本レビューでは、胆汁酸がミトコンドリア機能、エンドプラスミックレチiculum(ER)ストレス、炎症、自食作用(オートファジー)を通じて肝障害に寄与する仕組みに関する最新の知見を紹介しています。
肝細胞アポトーシスの経路
ミトコンドリアは、アポトーシス(プログラム化された細胞死)の調節において中心的な役割を果たします。胆汁うっ滞性肝障害では、胆汁酸が以下の2つの主要なアポトーシス経路に影響を与えることが知られています。
受容体非依存性経路
胆汁酸は、ミトコンドリア電子伝達系(ETC)を直接的に損傷し、活性酸素種(ROS)の生成を促進します。これにより酸化ストレスが引き起こされ、ミトコンドリア透過性遷移孔(mPTP)が開き、細胞死が進行します。この際、ミトコンドリアから放出されたシトクロムCは細胞質に移行し、内因性アポトーシス経路を活性化してカスパーゼ酵素を作動させます。
受容体依存性経路
胆汁酸は、FAS受容体などの細胞膜上の死受容体と相互作用し、アポトーシスを引き起こします。この相互作用は、細胞死誘導シグナル複合体の形成をもたらし、下流のカスパーゼを活性化します。さらに、BAXやBAKなどのBcl-2ファミリータンパク質がミトコンドリア膜の透過性を促進します。
ERストレスと炎症反応
エンドプラスミックレチiculum(ER)は、タンパク質合成
RNAコドン拡張で非標準アミノ酸を活用:革新的タンパク質設計
 新たなRNAコドンの拡張:合成アミノ酸を活用したタンパク質設計
生物学の基本原則である「タンパク質は20種類のアミノ酸から構成される」という枠を超え、タンパク質工学の分野に革新がもたらされました。スクリプス研究所の科学者らは、RNAのコドンを4つのヌクレオチドで構成する新手法を用いて、非標準アミノ酸(non-canonical amino acids)をタンパク質に簡単に組み込む方法を開発しました。この研究結果は、2024年9月11日にNature Biotechnologyに発表されました。
従来の課題を克服する新手法
タンパク質を合成する際、RNAの3つのヌクレオチド(コドン)が1つのアミノ酸に対応します。しかし、これを改変し、新たなアミノ酸を加えるには、通常、ゲノム全体を編集する必要がありました。この方法は時間やコストがかかり、細胞の安定性やタンパク質合成に影響を及ぼすリスクがありました。
本研究を主導したアフメド・バドラン博士(Ahmed Badran, PhD)は、「今回の方法は、細胞のゲノムを編集せずに、特定の遺伝子だけを操作して非標準アミノ酸を組み込む効率的な手法です」と述べています。
新しい4ヌクレオチドコドンの特性
研究チームは、自然界で細菌が薬剤耐性を獲得する際に4ヌクレオチドコドンが進化することに注目し、これをタンパク質設計に応用しました。コドン周辺の配列や頻繁に使用される3文字コドンが、4文字コドンの読み取り効率を向上させる鍵であることを発見しました。
さらに、チームは12種類の4ヌクレオチドコドンを利用し、100種類以上の環状ペプチド(マクロサイクル)を設計。その中には最大3つの非標準アミノ酸が含まれるものもありました。
実用性と応用の可能性
バドラン博士は、「この方法により、新しい小分子医薬品の開発やタンパク質再設計が容易に
新たなRNAコドンの拡張:合成アミノ酸を活用したタンパク質設計
生物学の基本原則である「タンパク質は20種類のアミノ酸から構成される」という枠を超え、タンパク質工学の分野に革新がもたらされました。スクリプス研究所の科学者らは、RNAのコドンを4つのヌクレオチドで構成する新手法を用いて、非標準アミノ酸(non-canonical amino acids)をタンパク質に簡単に組み込む方法を開発しました。この研究結果は、2024年9月11日にNature Biotechnologyに発表されました。
従来の課題を克服する新手法
タンパク質を合成する際、RNAの3つのヌクレオチド(コドン)が1つのアミノ酸に対応します。しかし、これを改変し、新たなアミノ酸を加えるには、通常、ゲノム全体を編集する必要がありました。この方法は時間やコストがかかり、細胞の安定性やタンパク質合成に影響を及ぼすリスクがありました。
本研究を主導したアフメド・バドラン博士(Ahmed Badran, PhD)は、「今回の方法は、細胞のゲノムを編集せずに、特定の遺伝子だけを操作して非標準アミノ酸を組み込む効率的な手法です」と述べています。
新しい4ヌクレオチドコドンの特性
研究チームは、自然界で細菌が薬剤耐性を獲得する際に4ヌクレオチドコドンが進化することに注目し、これをタンパク質設計に応用しました。コドン周辺の配列や頻繁に使用される3文字コドンが、4文字コドンの読み取り効率を向上させる鍵であることを発見しました。
さらに、チームは12種類の4ヌクレオチドコドンを利用し、100種類以上の環状ペプチド(マクロサイクル)を設計。その中には最大3つの非標準アミノ酸が含まれるものもありました。
実用性と応用の可能性
バドラン博士は、「この方法により、新しい小分子医薬品の開発やタンパク質再設計が容易に
次世代カプシドが筋疾患治療を変革:AIを活用した画期的手法
 次世代の筋疾患向け遺伝子治療を可能にする新しいカプシド設計を発表
ジェネトンの進行性筋ジストロフィーチームを率いるイザベル・リチャード博士(Isabelle Richard, PhD)は、人工知能(AI)を活用して遺伝子治療ベクターのカプシドを新たに設計する革新的手法を確立しました。この新しいカプシドは、自然のアデノ随伴ウイルス(AAV)カプシドに比べて20分の1の量で高い効果を発揮し、筋組織を正確に標的化しながら肝臓への影響を軽減します。さらに、他の臓器をターゲットとした新しいカプシドの開発にも取り組んでいます。
2024年9月12日、フランスの先進的な研究所ジェネトンは、人工知能を用いた新世代のAAVカプシド設計に関する研究をNature Communicationsに発表しました。この研究では、筋疾患に対する遺伝子治療を改善するためのカプシド設計の成果を紹介しています。このカプシドは、筋組織を効果的に標的化しながら肝臓を回避し、ベクター使用量の削減を可能にします。この成果は、筋疾患を含む神経筋疾患の治療における有効性の向上と副作用や生産コストの削減に貢献します。論文のタイトルは「An Engineered AAV Targeting Integrin Alpha V Beta 6 Presents Improved Myotropism Across Species(インテグリンαVβ6を標的とするエンジニアードAAVは、種を超えた筋肉嗜好性を改善)」です。
リチャード博士は次のように述べています。「神経筋疾患における遺伝子治療の時代が始まりました。この新世代の遺伝子治療ベクターは、有効性と安全性の両面で画期的な進歩です。現在、この技術を様々な神経筋疾患に対して試験しています。」
ジェネトンのCEOであるフレデリック・レヴァ博士(Frederic Reva
次世代の筋疾患向け遺伝子治療を可能にする新しいカプシド設計を発表
ジェネトンの進行性筋ジストロフィーチームを率いるイザベル・リチャード博士(Isabelle Richard, PhD)は、人工知能(AI)を活用して遺伝子治療ベクターのカプシドを新たに設計する革新的手法を確立しました。この新しいカプシドは、自然のアデノ随伴ウイルス(AAV)カプシドに比べて20分の1の量で高い効果を発揮し、筋組織を正確に標的化しながら肝臓への影響を軽減します。さらに、他の臓器をターゲットとした新しいカプシドの開発にも取り組んでいます。
2024年9月12日、フランスの先進的な研究所ジェネトンは、人工知能を用いた新世代のAAVカプシド設計に関する研究をNature Communicationsに発表しました。この研究では、筋疾患に対する遺伝子治療を改善するためのカプシド設計の成果を紹介しています。このカプシドは、筋組織を効果的に標的化しながら肝臓を回避し、ベクター使用量の削減を可能にします。この成果は、筋疾患を含む神経筋疾患の治療における有効性の向上と副作用や生産コストの削減に貢献します。論文のタイトルは「An Engineered AAV Targeting Integrin Alpha V Beta 6 Presents Improved Myotropism Across Species(インテグリンαVβ6を標的とするエンジニアードAAVは、種を超えた筋肉嗜好性を改善)」です。
リチャード博士は次のように述べています。「神経筋疾患における遺伝子治療の時代が始まりました。この新世代の遺伝子治療ベクターは、有効性と安全性の両面で画期的な進歩です。現在、この技術を様々な神経筋疾患に対して試験しています。」
ジェネトンのCEOであるフレデリック・レヴァ博士(Frederic Reva
北極圏そり犬の遺伝史を解明:シベリアン・ハスキーの起源と血統
 コーネル大学が共同主導:北極圏そり犬の何千年もの遺伝史を明らかに
コーネル大学が共同で主導した新たな研究により、シベリアおよびアラスカのそり犬のDNAがどのように混じり合ったのか、その時期や背景が解明されました。この研究の一環として、特にシベリアン・ハスキーの系譜について大規模な遺伝子調査が行われました。
遺伝子解析が示す新たな発見
研究を主導したのは、コーネル大学動物科学部のヘザー・ヒューソン博士(Heather Huson, PhD)です。元そり犬レーサーである彼女は、シベリアの犬種を育てるブリーダーたちが自身の犬が100%シベリアン・ハスキーではないという系譜情報を遺伝子分析の結果から知らされることに懸念を抱いていたことを指摘しました。
これにより、従来のシベリアン・ハスキーがアラスカン・ハスキーやアラスカのそり犬の血統を一定割合含むことが示唆されています。
本研究は、遺伝子の多様性が犬の健康に与える影響をも探るもので、シベリアン・ハスキーが2つの異なる北極圏犬系統に由来していることを明らかにしました。研究ではさらに、レース用に繁殖されたシベリアン・ハスキーの約半数にヨーロッパ犬種の遺伝情報が混在していることも判明しました。
北極犬系統の複雑な歴史
「北極犬には単一の系統があると考えられていましたが、実際には2つ存在することを突き止めました。一つは小柄なシベリアン・ハスキーへ、もう一つは大型のグリーンランドそり犬やアラスカン・マラミュートに繋がります」とヒューソン博士は述べています。
共同責任著者のトレイシー・スミス博士(Tracy Smith, PhD)は、メリーランド大学ボルチモア校生物科学部のシニア講師として、遺伝情報を基にした品種管理政策の重要性を強調しました。この研究成果は、北東シベリアの北極圏で人間がそり犬を使役していた時代が従来考えら
コーネル大学が共同主導:北極圏そり犬の何千年もの遺伝史を明らかに
コーネル大学が共同で主導した新たな研究により、シベリアおよびアラスカのそり犬のDNAがどのように混じり合ったのか、その時期や背景が解明されました。この研究の一環として、特にシベリアン・ハスキーの系譜について大規模な遺伝子調査が行われました。
遺伝子解析が示す新たな発見
研究を主導したのは、コーネル大学動物科学部のヘザー・ヒューソン博士(Heather Huson, PhD)です。元そり犬レーサーである彼女は、シベリアの犬種を育てるブリーダーたちが自身の犬が100%シベリアン・ハスキーではないという系譜情報を遺伝子分析の結果から知らされることに懸念を抱いていたことを指摘しました。
これにより、従来のシベリアン・ハスキーがアラスカン・ハスキーやアラスカのそり犬の血統を一定割合含むことが示唆されています。
本研究は、遺伝子の多様性が犬の健康に与える影響をも探るもので、シベリアン・ハスキーが2つの異なる北極圏犬系統に由来していることを明らかにしました。研究ではさらに、レース用に繁殖されたシベリアン・ハスキーの約半数にヨーロッパ犬種の遺伝情報が混在していることも判明しました。
北極犬系統の複雑な歴史
「北極犬には単一の系統があると考えられていましたが、実際には2つ存在することを突き止めました。一つは小柄なシベリアン・ハスキーへ、もう一つは大型のグリーンランドそり犬やアラスカン・マラミュートに繋がります」とヒューソン博士は述べています。
共同責任著者のトレイシー・スミス博士(Tracy Smith, PhD)は、メリーランド大学ボルチモア校生物科学部のシニア講師として、遺伝情報を基にした品種管理政策の重要性を強調しました。この研究成果は、北東シベリアの北極圏で人間がそり犬を使役していた時代が従来考えら
ALS診断の新血液検査、98%の精度を達成:早期診断が可能に
 ALS診断の新たな血液検査、2年以内に広く利用可能に:ワイオミング州ジャクソンの研究所が開発
現在、筋萎縮性側索硬化症(ALS、別名「ルー・ゲーリッグ病」)の診断には神経内科医による臨床検査が必要です。しかし、他の神経疾患と区別するには症状の進行を追跡する必要があり、診断が遅れることが多くあります。ALS患者の平均生存期間は約3年であるため、診断が遅れることで治療の機会が大幅に失われる可能性があります。さらに、最初の誤診率は最大68%にも達し、患者は複数の専門医を転々とすることがあり、不安の増大、不必要な医療処置、および費用の増加につながります。
2024年9月13日、Brain Chemistry Labs(ワイオミング州ジャクソン)の研究者らは、血漿中の細胞外小胞(EV)からALS特異的バイオマーカー「ALSフィンガープリント」を特定したことを、オープンアクセス論文「A microRNA Diagnostic Biomarker for Amyotrophic Lateral Sclerosis」(筋萎縮性側索硬化症のためのマイクロRNA診断バイオマーカー)で発表しました。このフィンガープリントは、血液検査によって検出可能で、診断の迅速化に大きく貢献する可能性があります。
研究内容と成果
研究チームは、次世代シーケンシングとリアルタイムPCRを用いて、ALS、原発性側索硬化症(PLS)、パーキンソン病(PD)、および健常者の血液サンプルを分析しました。その結果、以下が明らかになりました:
8つのマイクロRNAからなるALSフィンガープリント:
このバイオマーカーはALSを98%の精度で検出可能。ALSをPLSやPDと高い精度で区別する能力も持つ。
信頼性の確認:
4つの異なる患者グループ、2つの研究室、複数の技術者、および異なるサンプル収集方法で検証
ALS診断の新たな血液検査、2年以内に広く利用可能に:ワイオミング州ジャクソンの研究所が開発
現在、筋萎縮性側索硬化症(ALS、別名「ルー・ゲーリッグ病」)の診断には神経内科医による臨床検査が必要です。しかし、他の神経疾患と区別するには症状の進行を追跡する必要があり、診断が遅れることが多くあります。ALS患者の平均生存期間は約3年であるため、診断が遅れることで治療の機会が大幅に失われる可能性があります。さらに、最初の誤診率は最大68%にも達し、患者は複数の専門医を転々とすることがあり、不安の増大、不必要な医療処置、および費用の増加につながります。
2024年9月13日、Brain Chemistry Labs(ワイオミング州ジャクソン)の研究者らは、血漿中の細胞外小胞(EV)からALS特異的バイオマーカー「ALSフィンガープリント」を特定したことを、オープンアクセス論文「A microRNA Diagnostic Biomarker for Amyotrophic Lateral Sclerosis」(筋萎縮性側索硬化症のためのマイクロRNA診断バイオマーカー)で発表しました。このフィンガープリントは、血液検査によって検出可能で、診断の迅速化に大きく貢献する可能性があります。
研究内容と成果
研究チームは、次世代シーケンシングとリアルタイムPCRを用いて、ALS、原発性側索硬化症(PLS)、パーキンソン病(PD)、および健常者の血液サンプルを分析しました。その結果、以下が明らかになりました:
8つのマイクロRNAからなるALSフィンガープリント:
このバイオマーカーはALSを98%の精度で検出可能。ALSをPLSやPDと高い精度で区別する能力も持つ。
信頼性の確認:
4つの異なる患者グループ、2つの研究室、複数の技術者、および異なるサンプル収集方法で検証
アカホシテントウムシのゲノム解読:植物毒への耐性の秘密を解明
 宿主特化型のアカホシテントウムシのゲノムと広食性の近縁種との比較
一般的なアカホシテントウムシ(Cerambycidae科のカミキリムシ科の一員)が、有毒な植物であるトウワタを安全に摂食できる秘密を解明する研究は、生態学、進化、経済的な観点から昆虫と植物の相互作用に関する理解をゲノムの視点から深めるものです。トウワタとアカホシテントウムシの関係は約150年にわたり研究されてきましたが、アーカンソー農業実験局の科学者がメンフィス大学やウィスコンシン大学オシュコシュ校の同僚と協力し、初めてこの昆虫のゲノムを編纂し、植物摂食やその他の生物学的特性に関連する遺伝子の研究を行いました。
研究の背景と手法
この研究は米国国立科学財団(NSF)の支援を受け、宿主特化型のアカホシテントウムシの全ゲノムをシークエンスし組み立てたものです。その後、ゲノム生物学の側面を、林業に重要な多様な樹木を摂食する外来種である広食性のアジアカミキリと比較しました。研究は、「Functional and Evolutionary Insights Into Chemosensation and Specialized Herbivory from the Genome of the Red Milkweed Beetle, Tetraopes tetrophthalmus (Cerambycidae: Lamiinae)(アカホシテントウムシのゲノムから得られる化学感覚と特化型植食の機能的および進化的洞察)」という論文名で2024年8月30日に米国遺伝学会のジャーナルJournal of Heredityに発表されました。
「生物学的観点から、長期的な相互作用がトウワタムシとその有毒な宿主であるトウワタの生物学に影響を与えるべきであるという多くの対応関係が示唆されています」と、本研究の主著者である
宿主特化型のアカホシテントウムシのゲノムと広食性の近縁種との比較
一般的なアカホシテントウムシ(Cerambycidae科のカミキリムシ科の一員)が、有毒な植物であるトウワタを安全に摂食できる秘密を解明する研究は、生態学、進化、経済的な観点から昆虫と植物の相互作用に関する理解をゲノムの視点から深めるものです。トウワタとアカホシテントウムシの関係は約150年にわたり研究されてきましたが、アーカンソー農業実験局の科学者がメンフィス大学やウィスコンシン大学オシュコシュ校の同僚と協力し、初めてこの昆虫のゲノムを編纂し、植物摂食やその他の生物学的特性に関連する遺伝子の研究を行いました。
研究の背景と手法
この研究は米国国立科学財団(NSF)の支援を受け、宿主特化型のアカホシテントウムシの全ゲノムをシークエンスし組み立てたものです。その後、ゲノム生物学の側面を、林業に重要な多様な樹木を摂食する外来種である広食性のアジアカミキリと比較しました。研究は、「Functional and Evolutionary Insights Into Chemosensation and Specialized Herbivory from the Genome of the Red Milkweed Beetle, Tetraopes tetrophthalmus (Cerambycidae: Lamiinae)(アカホシテントウムシのゲノムから得られる化学感覚と特化型植食の機能的および進化的洞察)」という論文名で2024年8月30日に米国遺伝学会のジャーナルJournal of Heredityに発表されました。
「生物学的観点から、長期的な相互作用がトウワタムシとその有毒な宿主であるトウワタの生物学に影響を与えるべきであるという多くの対応関係が示唆されています」と、本研究の主著者である
絶滅危惧種ホシガメのゲノムを初解読!保全への新たな一歩
 再発見!地中海の代表種ホシガメのゲノムを初解読
スペインのミゲル・エルナンデス大学(UMH)とアリカンテ大学(UA)の生態学部の研究者らが、地中海地域で象徴的な陸生カメ「ホシガメ(学名: Testudo graeca)」のゲノムを初めて解読しました。この研究成果は、2024年8月9日に学術誌PLoS Oneで発表されました。論文のタイトルは「Taking Advantage of Reference-Guided Assembly in a Slowly-Evolving Lineage: Application to Testudo graeca(参照ゲノムを活用した組み立て法の応用:ホシガメの場合)」です。
研究の背景
ホシガメは地中海沿岸で最も特徴的な陸生カメの一種で、イベリア半島では主に南東部(アルメリア北部からムルシア南部)とドニャーナ国立公園内に生息しています。しかし、アンダルシア地方では絶滅危惧種に指定されており、ムルシア州およびスペイン環境省の「絶滅危惧種カタログ」に登録されています。
「ホシガメのような動物の遺伝的多様性を理解することは、気候変動や環境適応能力を把握し、保全に役立てるために非常に重要です」と、UMHの研究者で本研究の主著者であるアンドレア・ミラ・ホベル氏(Andrea Mira Jover)は説明しています。
ゲノム解析の重要性
ゲノム解析とは、生物種の全遺伝情報を読み取り、特定の遺伝子を特定し、染色体として構成することです。本研究では、約22億塩基対からなるホシガメのゲノムを解析し、約26,000の遺伝子を特定しました。これは他の手法による先行研究とも一致する進化パターンを示しています。
「この研究成果は、ホシガメの進化の歴史やその長寿の秘密など、今後の研究で解明するための出発点となります」と、UAの生態学部研究者で共同
再発見!地中海の代表種ホシガメのゲノムを初解読
スペインのミゲル・エルナンデス大学(UMH)とアリカンテ大学(UA)の生態学部の研究者らが、地中海地域で象徴的な陸生カメ「ホシガメ(学名: Testudo graeca)」のゲノムを初めて解読しました。この研究成果は、2024年8月9日に学術誌PLoS Oneで発表されました。論文のタイトルは「Taking Advantage of Reference-Guided Assembly in a Slowly-Evolving Lineage: Application to Testudo graeca(参照ゲノムを活用した組み立て法の応用:ホシガメの場合)」です。
研究の背景
ホシガメは地中海沿岸で最も特徴的な陸生カメの一種で、イベリア半島では主に南東部(アルメリア北部からムルシア南部)とドニャーナ国立公園内に生息しています。しかし、アンダルシア地方では絶滅危惧種に指定されており、ムルシア州およびスペイン環境省の「絶滅危惧種カタログ」に登録されています。
「ホシガメのような動物の遺伝的多様性を理解することは、気候変動や環境適応能力を把握し、保全に役立てるために非常に重要です」と、UMHの研究者で本研究の主著者であるアンドレア・ミラ・ホベル氏(Andrea Mira Jover)は説明しています。
ゲノム解析の重要性
ゲノム解析とは、生物種の全遺伝情報を読み取り、特定の遺伝子を特定し、染色体として構成することです。本研究では、約22億塩基対からなるホシガメのゲノムを解析し、約26,000の遺伝子を特定しました。これは他の手法による先行研究とも一致する進化パターンを示しています。
「この研究成果は、ホシガメの進化の歴史やその長寿の秘密など、今後の研究で解明するための出発点となります」と、UAの生態学部研究者で共同
ミトコンドリア病に新たな光—父性DNAとATPの謎
 父親由来のミトコンドリアが及ぼす影響—進化が排除を選んだ理由とビタミンK2の可能性
ミトコンドリアDNAは母親からのみ受け継がれる、というのは生物学の基本ですが、なぜ父親由来のミトコンドリアが排除されるのか、その理由は長らく謎でした。コロラド大学ボルダー校の研究者らは、2024年10月4日付のScience Advances誌に発表した研究で、この現象に新たな光を当てました。論文タイトルは「Moderate Embryonic Delay of Paternal Mitochondrial Elimination Impairs Mating and Cognition and Alters Behaviors of Adult Animals(父性ミトコンドリア除去の胚性遅延が交尾や認知を損ない、成体の行動を変化させる)」です。
この研究では、父親由来のミトコンドリアが胚に残存すると、成体で神経学的、行動的、生殖的な問題を引き起こす可能性があることが示されました。また、これらの問題を解決する可能性を持つ簡単な治療法として、ビタミンK2が提案されています。
父性ミトコンドリアの排除とその重要性
ミトコンドリアは細胞内の「バッテリー」と呼ばれ、アデノシン三リン酸(ATP)を生成して細胞の機能を支える重要な役割を果たしています。しかし、ミトコンドリアDNAは通常、母親からのみ受け継がれます。2016年、研究リーダーのシュー・ディン博士(Ding Xue, PhD)は、父性ミトコンドリアが自己破壊する「父性ミトコンドリア除去(PME)」という多面的なメカニズムを解明しました。この現象は線虫、げっ歯類、人間でも確認されています。
シュー博士は「進化は、父性ミトコンドリアを完全に排除するために複数のメカニズムを採用しているのです」と述べています。父性ミトコンドリアは受精
父親由来のミトコンドリアが及ぼす影響—進化が排除を選んだ理由とビタミンK2の可能性
ミトコンドリアDNAは母親からのみ受け継がれる、というのは生物学の基本ですが、なぜ父親由来のミトコンドリアが排除されるのか、その理由は長らく謎でした。コロラド大学ボルダー校の研究者らは、2024年10月4日付のScience Advances誌に発表した研究で、この現象に新たな光を当てました。論文タイトルは「Moderate Embryonic Delay of Paternal Mitochondrial Elimination Impairs Mating and Cognition and Alters Behaviors of Adult Animals(父性ミトコンドリア除去の胚性遅延が交尾や認知を損ない、成体の行動を変化させる)」です。
この研究では、父親由来のミトコンドリアが胚に残存すると、成体で神経学的、行動的、生殖的な問題を引き起こす可能性があることが示されました。また、これらの問題を解決する可能性を持つ簡単な治療法として、ビタミンK2が提案されています。
父性ミトコンドリアの排除とその重要性
ミトコンドリアは細胞内の「バッテリー」と呼ばれ、アデノシン三リン酸(ATP)を生成して細胞の機能を支える重要な役割を果たしています。しかし、ミトコンドリアDNAは通常、母親からのみ受け継がれます。2016年、研究リーダーのシュー・ディン博士(Ding Xue, PhD)は、父性ミトコンドリアが自己破壊する「父性ミトコンドリア除去(PME)」という多面的なメカニズムを解明しました。この現象は線虫、げっ歯類、人間でも確認されています。
シュー博士は「進化は、父性ミトコンドリアを完全に排除するために複数のメカニズムを採用しているのです」と述べています。父性ミトコンドリアは受精
細胞内タンパク質の液液相分離を物理学で解明:疾患治療への応用可能性
 サンパウロ州立大学の研究:凝縮系物理学の応用でタンパク質の細胞内分離を解明
サンパウロ州立大学の研究者らが、凝縮系物理学の概念を用いて、細胞内のタンパク質区画化を説明し、新しい「細胞的グリフィス相」を提唱しました。この研究は、2024年8月15日に学術誌「Heliyon」に掲載され、論文タイトルは「Cellular Griffiths-Like Phase(細胞的グリフィス相)」です。主著者はルーカス・スクイランテ(Lucas Squillante)博士課程学生、責任著者は同大学地球科学・精密科学研究所(IGCE-UNESP)の教授、マリアノ・デ・ソウザ博士(Mariano de Souza, PhD)です。
研究概要と背景
物理学における二物質系モデルでは、各構成要素の比率や相互作用を考慮する古典的混合理論が使用されます。この理論は、過冷却水における高密度相と低密度相の共存や、モット転移における金属相と絶縁体相の共存などを説明します。このアプローチに基づき、研究者らは磁気グリフィス相(magnetic Griffiths phase)を細胞環境に適用。細胞内タンパク質の液液相分離によって形成される「レア領域」を解析し、タンパク質ドロップレット形成の動態が著しく低下するメカニズムを明らかにしました。
研究の方法と発見
研究では以下の熱力学的ツールを活用しました:
グリューナイゼンパラメーターフローリー・ヒギンズモデルアヴラモフ=カサリーニモデルこれらを用いて、タンパク質/溶媒濃度の変化や相分離近傍での動態遅延を解明しました。また、研究者らは細胞的グリフィス相を、生命の起源や初期生物の出現に関連付けました。特にアレクサンドル・オパーリン(Aleksandr Oparin)の理論を引用し、動的に安定なコアセルベートだけが進化する可能性を示唆しました。
疾患との
サンパウロ州立大学の研究:凝縮系物理学の応用でタンパク質の細胞内分離を解明
サンパウロ州立大学の研究者らが、凝縮系物理学の概念を用いて、細胞内のタンパク質区画化を説明し、新しい「細胞的グリフィス相」を提唱しました。この研究は、2024年8月15日に学術誌「Heliyon」に掲載され、論文タイトルは「Cellular Griffiths-Like Phase(細胞的グリフィス相)」です。主著者はルーカス・スクイランテ(Lucas Squillante)博士課程学生、責任著者は同大学地球科学・精密科学研究所(IGCE-UNESP)の教授、マリアノ・デ・ソウザ博士(Mariano de Souza, PhD)です。
研究概要と背景
物理学における二物質系モデルでは、各構成要素の比率や相互作用を考慮する古典的混合理論が使用されます。この理論は、過冷却水における高密度相と低密度相の共存や、モット転移における金属相と絶縁体相の共存などを説明します。このアプローチに基づき、研究者らは磁気グリフィス相(magnetic Griffiths phase)を細胞環境に適用。細胞内タンパク質の液液相分離によって形成される「レア領域」を解析し、タンパク質ドロップレット形成の動態が著しく低下するメカニズムを明らかにしました。
研究の方法と発見
研究では以下の熱力学的ツールを活用しました:
グリューナイゼンパラメーターフローリー・ヒギンズモデルアヴラモフ=カサリーニモデルこれらを用いて、タンパク質/溶媒濃度の変化や相分離近傍での動態遅延を解明しました。また、研究者らは細胞的グリフィス相を、生命の起源や初期生物の出現に関連付けました。特にアレクサンドル・オパーリン(Aleksandr Oparin)の理論を引用し、動的に安定なコアセルベートだけが進化する可能性を示唆しました。
疾患との
シングルセル解析が明らかにしたダウン症胎児の血液細胞発生の異常
 ダウン症における染色体21の過剰がDNAパッケージングと血液幹細胞の過剰ミトコンドリアを変化させ、白血病リスク増加の理由を解明
スタンフォード大学、ケンブリッジ大学、MIT・ハーバード大学ブロード研究所、コペンハーゲン大学の共同研究により、ダウン症の子どもたちが白血病を発症しやすい理由が明らかになりました。この研究では、ダウン症(DS)を有するおよび持たない胎児の肝臓と骨髄から採取された100万個以上の個別細胞を解析し、DSにおける血液発生の初の包括的なシングルセルマルチオミクスマップを作成しました。
主な発見:ミトコンドリアの増加とDNAパッケージングの変化
研究者らは、DS胎児の血液幹細胞が過剰なミトコンドリアを持ち、これが白血病を引き起こす変異を誘発する可能性があることを突き止めました。また、余分な染色体21が細胞内でDNAのパッケージング方法を変化させ、新生児の血液細胞生成を乱すことも確認されました。
この研究結果は、2024年9月25日付でオープンアクセス誌Natureに「Single-Cell Multi-Omics Map of Human Fetal Blood in Down Syndrome(ダウン症におけるヒト胎児血液のシングルセルマルチオミクスマップ)」というタイトルで発表されました。
ダウン症と白血病:新たな洞察
ダウン症(トリソミー21、Ts21)は、特に生後5年以内に髄様白血病を発症するリスクが約150倍に増加することが知られています。一般的なモデルでは、胎児期の肝臓に存在する血液幹細胞(HSCs)でのGATA1転写因子の変異が前白血病状態を引き起こし、出生後にさらなる変異が蓄積して白血病を発症すると考えられています。
また、新生児の赤血球(RBC)異常も報告されています。これには、赤血球数の増加や異常に大きな赤血球が含まれ、
ダウン症における染色体21の過剰がDNAパッケージングと血液幹細胞の過剰ミトコンドリアを変化させ、白血病リスク増加の理由を解明
スタンフォード大学、ケンブリッジ大学、MIT・ハーバード大学ブロード研究所、コペンハーゲン大学の共同研究により、ダウン症の子どもたちが白血病を発症しやすい理由が明らかになりました。この研究では、ダウン症(DS)を有するおよび持たない胎児の肝臓と骨髄から採取された100万個以上の個別細胞を解析し、DSにおける血液発生の初の包括的なシングルセルマルチオミクスマップを作成しました。
主な発見:ミトコンドリアの増加とDNAパッケージングの変化
研究者らは、DS胎児の血液幹細胞が過剰なミトコンドリアを持ち、これが白血病を引き起こす変異を誘発する可能性があることを突き止めました。また、余分な染色体21が細胞内でDNAのパッケージング方法を変化させ、新生児の血液細胞生成を乱すことも確認されました。
この研究結果は、2024年9月25日付でオープンアクセス誌Natureに「Single-Cell Multi-Omics Map of Human Fetal Blood in Down Syndrome(ダウン症におけるヒト胎児血液のシングルセルマルチオミクスマップ)」というタイトルで発表されました。
ダウン症と白血病:新たな洞察
ダウン症(トリソミー21、Ts21)は、特に生後5年以内に髄様白血病を発症するリスクが約150倍に増加することが知られています。一般的なモデルでは、胎児期の肝臓に存在する血液幹細胞(HSCs)でのGATA1転写因子の変異が前白血病状態を引き起こし、出生後にさらなる変異が蓄積して白血病を発症すると考えられています。
また、新生児の赤血球(RBC)異常も報告されています。これには、赤血球数の増加や異常に大きな赤血球が含まれ、
ヒト脳発達における遺伝子調節の進化を解明:精神疾患の原因解明へ
 UCLAを中心とした研究チームが、人間の脳発達における遺伝子調節の進化を前例のない詳細さで明らかにしました。この研究は、DNAとタンパク質からなる「クロマチン」の3D構造が脳の発達に重要な役割を果たしていることを示し、生涯の精神的健康にどのように影響するかについて新たな知見を提供しています。この研究は2024年10月9日にNatureに発表され、UCLAのチョンユアン・ロー博士(Chongyuan Luo, PhD)とUCサンフランシスコのメルセデス・パレデス博士(Mercedes Paredes MD, PhD)により主導されました。共同研究者には、ソーク研究所、UCサンディエゴ、ソウル大学の研究者らが含まれます。
論文のタイトルは「「Temporally Distinct 3D Multi-Omic Dynamics in the Developing Human Brain」(発達中のヒト脳における時間的に異なる3D多オミクス動態)」です。この研究では、学習、記憶、感情調節に重要な海馬と前頭前野という脳領域でのDNA修飾の地図を初めて作成しました。これらの領域は、自閉症スペクトラム症(ASD)や統合失調症などの障害にしばしば関連しています。
研究の概要
研究チームはこのデータをオンラインプラットフォームを通じて公開し、科学者が遺伝子変異を特定の遺伝子や細胞、発達時期と結びつけるための貴重なツールとして活用できるようにしています。ロー博士は「神経精神疾患は成人期に現れることが多いですが、その多くは脳の早期発達を阻害する遺伝的要因に起因します。このマップは疾患影響を受けた脳の遺伝子研究と比較するための基盤を提供し、分子変化が発生する時期と場所を特定するのに役立ちます」と述べています。
研究チームは、UCLAの幹細胞研究センターフローサイトメトリーコアで開発・拡
UCLAを中心とした研究チームが、人間の脳発達における遺伝子調節の進化を前例のない詳細さで明らかにしました。この研究は、DNAとタンパク質からなる「クロマチン」の3D構造が脳の発達に重要な役割を果たしていることを示し、生涯の精神的健康にどのように影響するかについて新たな知見を提供しています。この研究は2024年10月9日にNatureに発表され、UCLAのチョンユアン・ロー博士(Chongyuan Luo, PhD)とUCサンフランシスコのメルセデス・パレデス博士(Mercedes Paredes MD, PhD)により主導されました。共同研究者には、ソーク研究所、UCサンディエゴ、ソウル大学の研究者らが含まれます。
論文のタイトルは「「Temporally Distinct 3D Multi-Omic Dynamics in the Developing Human Brain」(発達中のヒト脳における時間的に異なる3D多オミクス動態)」です。この研究では、学習、記憶、感情調節に重要な海馬と前頭前野という脳領域でのDNA修飾の地図を初めて作成しました。これらの領域は、自閉症スペクトラム症(ASD)や統合失調症などの障害にしばしば関連しています。
研究の概要
研究チームはこのデータをオンラインプラットフォームを通じて公開し、科学者が遺伝子変異を特定の遺伝子や細胞、発達時期と結びつけるための貴重なツールとして活用できるようにしています。ロー博士は「神経精神疾患は成人期に現れることが多いですが、その多くは脳の早期発達を阻害する遺伝的要因に起因します。このマップは疾患影響を受けた脳の遺伝子研究と比較するための基盤を提供し、分子変化が発生する時期と場所を特定するのに役立ちます」と述べています。
研究チームは、UCLAの幹細胞研究センターフローサイトメトリーコアで開発・拡
野生コアラの未来が危機に瀕している—豪州獣医病院での診察データ分析
 クイーンズランド大学の研究によると、南東クイーンズランドの獣医病院に搬送されたコアラの多くが安楽死という結果に至っていることが明らかになりました。この研究は、UQ科学部の博士課程候補生であるレネー・カラランブス氏(Renae Charalambous)らによって行われ、1997年から2019年の間に記録された5万件以上のコアラ目撃情報および病院への入院データを分析しました。
「コアラが病院に搬送される原因の約30%はクラミジア感染症によるもので、その次に多いのは生息地の喪失に起因する犬の襲撃や自動車との衝突といった多様な脅威です」とカラランブス氏は述べています。
「病院に搬送されたコアラのうち、適切な生息地に再び放されたのは25%に過ぎませんでした。」搬送された多くのコアラは病院に到着する前に死亡し、到着できた場合でも、獣医師や介護者が最善を尽くしても安楽死を余儀なくされるケースが多いとされています。
特に、自動車事故による搬送は全体の約20%を占め、治療を受けた後に自然に戻された割合よりも4倍高い確率で搬送前に死亡していました。また、病院に到着したコアラは、自然に戻されるよりも安楽死となる確率が約3倍高かったとのことです。
犬による襲撃を受けたコアラも7%に達しており、救出時に死亡している確率が倍近く、治療後も自然に戻される確率よりも安楽死となる確率が2倍高いとされています。「これらのデータは非常に厳しい現実を示しており、コアラの将来は暗いものに見えます」とカラランブス氏は語ります。さらに、成体やメスのコアラ、クラミジア感染症を患う個体は安楽死となるリスクが特に高いことも判明しました。2022年2月、コアラの保全状況は「脆弱」から「絶滅危惧」へと変更されました。この決定は、過去10年間で推定個体数が半減したという報告を受けたものです。カラランブス氏は、こうした
クイーンズランド大学の研究によると、南東クイーンズランドの獣医病院に搬送されたコアラの多くが安楽死という結果に至っていることが明らかになりました。この研究は、UQ科学部の博士課程候補生であるレネー・カラランブス氏(Renae Charalambous)らによって行われ、1997年から2019年の間に記録された5万件以上のコアラ目撃情報および病院への入院データを分析しました。
「コアラが病院に搬送される原因の約30%はクラミジア感染症によるもので、その次に多いのは生息地の喪失に起因する犬の襲撃や自動車との衝突といった多様な脅威です」とカラランブス氏は述べています。
「病院に搬送されたコアラのうち、適切な生息地に再び放されたのは25%に過ぎませんでした。」搬送された多くのコアラは病院に到着する前に死亡し、到着できた場合でも、獣医師や介護者が最善を尽くしても安楽死を余儀なくされるケースが多いとされています。
特に、自動車事故による搬送は全体の約20%を占め、治療を受けた後に自然に戻された割合よりも4倍高い確率で搬送前に死亡していました。また、病院に到着したコアラは、自然に戻されるよりも安楽死となる確率が約3倍高かったとのことです。
犬による襲撃を受けたコアラも7%に達しており、救出時に死亡している確率が倍近く、治療後も自然に戻される確率よりも安楽死となる確率が2倍高いとされています。「これらのデータは非常に厳しい現実を示しており、コアラの将来は暗いものに見えます」とカラランブス氏は語ります。さらに、成体やメスのコアラ、クラミジア感染症を患う個体は安楽死となるリスクが特に高いことも判明しました。2022年2月、コアラの保全状況は「脆弱」から「絶滅危惧」へと変更されました。この決定は、過去10年間で推定個体数が半減したという報告を受けたものです。カラランブス氏は、こうした
GBP1タンパク質が細菌を撃退!免疫研究の新発見
 抗菌作用を持つGBP1タンパク質の仕組みを解明
オランダ・デルフト工科大学の研究者らが、私たちの自然免疫の重要な構成要素である「GBP1(guanylate binding protein 1)」タンパク質の働き方を初めて明らかにしました。この研究成果は、2024年10月11日にNature Structural & Molecular Biologyに公開されたオープンアクセス論文「Structural Basis of Antimicrobial Membrane Coat Assembly by Human GBP1(ヒトGBP1による抗菌膜コート形成の構造基盤)」に詳述されています。この知見は、免疫力が弱い人々のための治療法や薬剤の開発に役立つ可能性があります。
GBP1の役割と免疫への貢献
GBP1は、細菌や寄生虫といった病原体に対して私たちの体が持つ自然免疫の「最前線」で働くタンパク質です。デルフト工科大学の生物物理学者アルイェン・ヤコビ博士(Arjen Jakobi, PhD)は、「GBPは赤痢やチフス、結核といった細菌性疾患のほか、妊娠中や胎児に危険なトキソプラズマ症や性感染症のクラミジアに対しても重要な役割を果たします」と説明しています。
細菌を包み込むタンパク質のコート
ヤコビ博士の研究グループの大学院生であり、本論文の筆頭著者であるターニャ・クーム氏(Tanja Kuhm)は、GBP1がどのように細菌を攻撃するのかを次のように解説します。「このタンパク質は細菌を『コート』で包み込み、そのコートを締め付けて細菌の膜を破壊します。この膜は侵入者を保護する層ですが、破壊されると免疫細胞が感染を除去できるようになります。」
防御メカニズムの解明
研究者たちは、クライオ電子顕微鏡を用いてGBP1タンパク質が細菌の膜にどのように結合するの
抗菌作用を持つGBP1タンパク質の仕組みを解明
オランダ・デルフト工科大学の研究者らが、私たちの自然免疫の重要な構成要素である「GBP1(guanylate binding protein 1)」タンパク質の働き方を初めて明らかにしました。この研究成果は、2024年10月11日にNature Structural & Molecular Biologyに公開されたオープンアクセス論文「Structural Basis of Antimicrobial Membrane Coat Assembly by Human GBP1(ヒトGBP1による抗菌膜コート形成の構造基盤)」に詳述されています。この知見は、免疫力が弱い人々のための治療法や薬剤の開発に役立つ可能性があります。
GBP1の役割と免疫への貢献
GBP1は、細菌や寄生虫といった病原体に対して私たちの体が持つ自然免疫の「最前線」で働くタンパク質です。デルフト工科大学の生物物理学者アルイェン・ヤコビ博士(Arjen Jakobi, PhD)は、「GBPは赤痢やチフス、結核といった細菌性疾患のほか、妊娠中や胎児に危険なトキソプラズマ症や性感染症のクラミジアに対しても重要な役割を果たします」と説明しています。
細菌を包み込むタンパク質のコート
ヤコビ博士の研究グループの大学院生であり、本論文の筆頭著者であるターニャ・クーム氏(Tanja Kuhm)は、GBP1がどのように細菌を攻撃するのかを次のように解説します。「このタンパク質は細菌を『コート』で包み込み、そのコートを締め付けて細菌の膜を破壊します。この膜は侵入者を保護する層ですが、破壊されると免疫細胞が感染を除去できるようになります。」
防御メカニズムの解明
研究者たちは、クライオ電子顕微鏡を用いてGBP1タンパク質が細菌の膜にどのように結合するの
新生児の代謝シグナルからSIDSの予防策を探る
 カリフォルニア大学サンフランシスコ校(UCSF)の研究者らが、乳幼児突然死症候群(SIDS)のリスクを予測する方法の解明に一歩近づきました。2024年9月3日付けでJAMA Pediatricsに掲載された新たな研究「Early Newborn Metabolic Patterning and Sudden Infant Death Syndrome(新生児の早期代謝パターンと乳幼児突然死症候群)」では、SIDSで亡くなった乳児に特有の代謝パターンが特定されました。この研究は、SIDS予防のための具体的な手がかりとなる可能性を秘めています。
SIDSの現状と課題:原因不明の乳児死亡
SIDSは、1歳未満の乳児約1,300人が毎年死亡する原因不明の疾患であり、両親や医療従事者にとって大きな課題です。これまでの研究から、SIDSには単一の原因があるわけではなく、いくつかの要因が重なることで発生する可能性があると考えられています。
例えば、不十分な出生前ケア、妊娠中の喫煙や飲酒、大気汚染、構造的人種差別がリスクを高めるとされています。また、男児の発症率が女児より高いことも明らかになっています。これらの社会的・環境的要因に加え、生物学的要因がSIDSの重要な原因である可能性が示唆されており、今回の研究はその点に焦点を当てています。
研究の目的と方法:代謝パターンに注目
研究チームは、代謝システムにおける特異なパターンがSIDSのリスクに関連している可能性を探るため、カリフォルニア州で行われた新生児スクリーニングデータを分析しました。このスクリーニングは、生まれたばかりの赤ちゃんの血液サンプルを用いて代謝異常を早期発見するためのもので、今回の研究では、SIDSで亡くなった乳児354人と、同年代で健康に育った乳児を比較対象としました。
発見された代謝バイオマーカーとその
カリフォルニア大学サンフランシスコ校(UCSF)の研究者らが、乳幼児突然死症候群(SIDS)のリスクを予測する方法の解明に一歩近づきました。2024年9月3日付けでJAMA Pediatricsに掲載された新たな研究「Early Newborn Metabolic Patterning and Sudden Infant Death Syndrome(新生児の早期代謝パターンと乳幼児突然死症候群)」では、SIDSで亡くなった乳児に特有の代謝パターンが特定されました。この研究は、SIDS予防のための具体的な手がかりとなる可能性を秘めています。
SIDSの現状と課題:原因不明の乳児死亡
SIDSは、1歳未満の乳児約1,300人が毎年死亡する原因不明の疾患であり、両親や医療従事者にとって大きな課題です。これまでの研究から、SIDSには単一の原因があるわけではなく、いくつかの要因が重なることで発生する可能性があると考えられています。
例えば、不十分な出生前ケア、妊娠中の喫煙や飲酒、大気汚染、構造的人種差別がリスクを高めるとされています。また、男児の発症率が女児より高いことも明らかになっています。これらの社会的・環境的要因に加え、生物学的要因がSIDSの重要な原因である可能性が示唆されており、今回の研究はその点に焦点を当てています。
研究の目的と方法:代謝パターンに注目
研究チームは、代謝システムにおける特異なパターンがSIDSのリスクに関連している可能性を探るため、カリフォルニア州で行われた新生児スクリーニングデータを分析しました。このスクリーニングは、生まれたばかりの赤ちゃんの血液サンプルを用いて代謝異常を早期発見するためのもので、今回の研究では、SIDSで亡くなった乳児354人と、同年代で健康に育った乳児を比較対象としました。
発見された代謝バイオマーカーとその
DNAマイクロビーズでオルガノイド設計が進化:新たな発達制御技術
 DNAマイクロビーズで培養組織の発達を精密制御:新しい分子工学技術
分子工学の新技術により、オルガノイドの発達を精密に制御することが可能になりました。特定の形状に折りたたまれたDNAで作られたマイクロビーズを使用し、組織内部に成長因子やシグナル分子を放出します。この技術により、従来よりもはるかに複雑なオルガノイドが作製でき、より現実に近い細胞構成が得られるようになりました。
この技術は、ハイデルベルク大学の「3D Matter Made to Order」卓越クラスターに所属する研究者たちによって開発されました。研究には、ハイデルベルク大学の生物学研究センター(COS)、分子生物学センター(ZMBH)、バイオクアントセンター、ならびにマックス・プランク医学研究所が参加しています。
オルガノイドは、幹細胞から作られる小型の臓器様組織で、ヒトの発生過程や疾患の研究に活用されます。しかし、これまでオルガノイド内部からその成長を制御することは不可能でした。COSの医科学者、カッシアン・アフティング博士(Cassian Afting, PhD)は「この新技術により、成長中の組織内で重要な発達シグナルが放出されるタイミングと場所を正確に決定できるようになりました」と述べています。
DNAマイクロビーズは、タンパク質や分子を「搭載」できる微小な構造物として設計されています。これらのビーズはオルガノイド内に注入され、紫外線にさらされることでその内容物を放出します。この手法により、成長因子やシグナル分子を任意のタイミングで組織内の特定の場所に放出することが可能です。
網膜オルガノイドでの成功例
研究チームは、メダカの網膜オルガノイドでこの技術をテストしました。Wntシグナル分子を搭載したマイクロビーズを網膜組織に挿入することで、網膜外層の色素上皮細胞と神経網膜組織を隣接させる
DNAマイクロビーズで培養組織の発達を精密制御:新しい分子工学技術
分子工学の新技術により、オルガノイドの発達を精密に制御することが可能になりました。特定の形状に折りたたまれたDNAで作られたマイクロビーズを使用し、組織内部に成長因子やシグナル分子を放出します。この技術により、従来よりもはるかに複雑なオルガノイドが作製でき、より現実に近い細胞構成が得られるようになりました。
この技術は、ハイデルベルク大学の「3D Matter Made to Order」卓越クラスターに所属する研究者たちによって開発されました。研究には、ハイデルベルク大学の生物学研究センター(COS)、分子生物学センター(ZMBH)、バイオクアントセンター、ならびにマックス・プランク医学研究所が参加しています。
オルガノイドは、幹細胞から作られる小型の臓器様組織で、ヒトの発生過程や疾患の研究に活用されます。しかし、これまでオルガノイド内部からその成長を制御することは不可能でした。COSの医科学者、カッシアン・アフティング博士(Cassian Afting, PhD)は「この新技術により、成長中の組織内で重要な発達シグナルが放出されるタイミングと場所を正確に決定できるようになりました」と述べています。
DNAマイクロビーズは、タンパク質や分子を「搭載」できる微小な構造物として設計されています。これらのビーズはオルガノイド内に注入され、紫外線にさらされることでその内容物を放出します。この手法により、成長因子やシグナル分子を任意のタイミングで組織内の特定の場所に放出することが可能です。
網膜オルガノイドでの成功例
研究チームは、メダカの網膜オルガノイドでこの技術をテストしました。Wntシグナル分子を搭載したマイクロビーズを網膜組織に挿入することで、網膜外層の色素上皮細胞と神経網膜組織を隣接させる
ALS治療に光!EGLN2酵素抑制で症状緩和の可能性
 EGLN2酵素の抑制でALSの進行を遅らせる新たな治療可能性
筋萎縮性側索硬化症(ALS)は、運動ニューロンを侵す壊滅的な神経変性疾患で、患者の多くは診断から2〜5年以内に死亡します。この病気に対する新たな治療標的として、ベルギーのVIB-KUルーヴェン大学のルド・ヴァン・デン・ボッシュ教授(Ludo Van Den Bosch)率いる研究チームが特定した酵素「EGLN2」が注目されています。この研究成果は、2024年9月9日にCell Reports誌に掲載された論文「Targeting EGLN2/PHD1 Protects Motor Neurons and Normalizes the Astrocytic Interferon Response(EGLN2/PHD1の標的化による運動ニューロン保護とアストロサイトIFN応答の正常化)」で詳しく報告されています。
研究の背景
ALS(ルー・ゲーリッグ病とも呼ばれる)は、成人における最も一般的な運動ニューロンの変性疾患で、進行性の筋力低下や麻痺を引き起こしますが、現在のところ進行を止めたり逆転させる効果的な治療法は存在しません。ALSの病態には酸化ストレス、代謝機能障害、神経炎症が深く関与しているとされ、研究者らはこれらを標的に酵素「EGLN2」の役割を探求しました。
研究内容と成果
EGLN2の保護的役割の確認:
EGLN2を抑制することで運動ニューロンが保護され、ALSの症状がゼブラフィッシュとマウスモデルで緩和されることが明らかになりました。
炎症反応との関連:
EGLN2がアストロサイト(星状膠細胞)での炎症カスケードに影響を与えることを確認しました。アストロサイトは運動ニューロンを支える脳細胞であり、その炎症抑制がALSの進行を遅らせる可能性があります。
研究手法:
ALS患者由来のi
EGLN2酵素の抑制でALSの進行を遅らせる新たな治療可能性
筋萎縮性側索硬化症(ALS)は、運動ニューロンを侵す壊滅的な神経変性疾患で、患者の多くは診断から2〜5年以内に死亡します。この病気に対する新たな治療標的として、ベルギーのVIB-KUルーヴェン大学のルド・ヴァン・デン・ボッシュ教授(Ludo Van Den Bosch)率いる研究チームが特定した酵素「EGLN2」が注目されています。この研究成果は、2024年9月9日にCell Reports誌に掲載された論文「Targeting EGLN2/PHD1 Protects Motor Neurons and Normalizes the Astrocytic Interferon Response(EGLN2/PHD1の標的化による運動ニューロン保護とアストロサイトIFN応答の正常化)」で詳しく報告されています。
研究の背景
ALS(ルー・ゲーリッグ病とも呼ばれる)は、成人における最も一般的な運動ニューロンの変性疾患で、進行性の筋力低下や麻痺を引き起こしますが、現在のところ進行を止めたり逆転させる効果的な治療法は存在しません。ALSの病態には酸化ストレス、代謝機能障害、神経炎症が深く関与しているとされ、研究者らはこれらを標的に酵素「EGLN2」の役割を探求しました。
研究内容と成果
EGLN2の保護的役割の確認:
EGLN2を抑制することで運動ニューロンが保護され、ALSの症状がゼブラフィッシュとマウスモデルで緩和されることが明らかになりました。
炎症反応との関連:
EGLN2がアストロサイト(星状膠細胞)での炎症カスケードに影響を与えることを確認しました。アストロサイトは運動ニューロンを支える脳細胞であり、その炎症抑制がALSの進行を遅らせる可能性があります。
研究手法:
ALS患者由来のi
オピオイドの副作用を抑えるナノボディ—新時代の鎮痛薬治療
 ナノボディでオピオイドの副作用を抑制—ジュネーブ大学の新たな発見
オピオイドは強力な鎮痛薬として広く使われていますが、めまいから致命的な呼吸抑制に至るまでの副作用を伴い、依存性も高い薬剤です。ジュネーブ大学(UNIGE)の研究者らは、これらの副作用を軽減する可能性を持つナノボディ「NbE」を発見しました。このナノボディは、オピオイドが結合する細胞受容体に強力かつ持続的に結合し、薬剤の作用を阻害することができます。さらに、研究チームはNbEの特性を模倣したさらに小型の分子を合成し、現行の治療法よりも効果的な副作用軽減策を提供する可能性を示しました。この研究成果はNature Communications誌に発表されました。論文タイトルは「Structural Basis of μ-Opioid Receptor Targeting by a Nanobody Antagonist(ナノボディ拮抗剤によるμ-オピオイド受容体標的の構造的基盤)」です。
オピオイドの課題とナノボディの可能性
モルヒネ、フェンタニル、トラマドールなどを含むオピオイドは、痛みを和らげる強力な効果を持つ一方、脳内の神経細胞に作用して陶酔感を引き起こします。しかし、依存性が高く、誤用による過剰摂取は毎年世界で約50万人の命を奪っています。この危機は欧州にも拡大しており、世界的な公衆衛生の課題となっています。
「オピオイドの副作用を軽減し、過剰摂取のリスクを管理するために、新しい分子を緊急に開発する必要があります」と語るのは、本研究を主導したジュネーブ大学医学部の細胞生理学・代謝学科准教授であるミリアム・シュトーバー博士(Miriam Stoeber, PhD)です。
ナノボディ「NbE」の特性
研究チームは、ナノボディNbEがオピオイド受容体に非常に強力かつ持続的に結合する特性を発見しまし
ナノボディでオピオイドの副作用を抑制—ジュネーブ大学の新たな発見
オピオイドは強力な鎮痛薬として広く使われていますが、めまいから致命的な呼吸抑制に至るまでの副作用を伴い、依存性も高い薬剤です。ジュネーブ大学(UNIGE)の研究者らは、これらの副作用を軽減する可能性を持つナノボディ「NbE」を発見しました。このナノボディは、オピオイドが結合する細胞受容体に強力かつ持続的に結合し、薬剤の作用を阻害することができます。さらに、研究チームはNbEの特性を模倣したさらに小型の分子を合成し、現行の治療法よりも効果的な副作用軽減策を提供する可能性を示しました。この研究成果はNature Communications誌に発表されました。論文タイトルは「Structural Basis of μ-Opioid Receptor Targeting by a Nanobody Antagonist(ナノボディ拮抗剤によるμ-オピオイド受容体標的の構造的基盤)」です。
オピオイドの課題とナノボディの可能性
モルヒネ、フェンタニル、トラマドールなどを含むオピオイドは、痛みを和らげる強力な効果を持つ一方、脳内の神経細胞に作用して陶酔感を引き起こします。しかし、依存性が高く、誤用による過剰摂取は毎年世界で約50万人の命を奪っています。この危機は欧州にも拡大しており、世界的な公衆衛生の課題となっています。
「オピオイドの副作用を軽減し、過剰摂取のリスクを管理するために、新しい分子を緊急に開発する必要があります」と語るのは、本研究を主導したジュネーブ大学医学部の細胞生理学・代謝学科准教授であるミリアム・シュトーバー博士(Miriam Stoeber, PhD)です。
ナノボディ「NbE」の特性
研究チームは、ナノボディNbEがオピオイド受容体に非常に強力かつ持続的に結合する特性を発見しまし
マウスの皮膚を透明化する革新的技術:光学研究の未来を切り開く
 科学研究ニュース:マウスの皮膚を透明化する新技術
研究者らが、マウスの頭蓋骨や腹部の皮膚を透明化する技術を開発しました。この研究は、テキサス大学ダラス校の助教授、ジーハオ・オウ博士(Zihao Ou, PhD)を筆頭著者として、2024年9月6日発行のScience誌に掲載されました。論文タイトルは「Achieving Optical Transparency in Live Animals with Absorbing Molecules(光吸収分子を用いた生体動物の光学的透明化の達成)」です。
技術の概要と背景
生体の皮膚は光を散乱させる性質を持ち、霧のように光を遮ります。しかし、オウ博士らの研究では、食品添加物として一般的に使用されるタートラジン(FD&C Yellow #5)と水を混ぜた溶液を用いることで、皮膚の透明化を実現しました。
「光吸収分子である黄色の染料と、光散乱性を持つ皮膚を組み合わせることで透明化が可能になりました」とオウ博士は述べています。これは、染料分子が水に溶けることで、皮膚組織の構成成分である脂質などの屈折率に近づき、光散乱が減少するためです。
実験と結果
マウスの頭蓋骨や腹部の皮膚にこの溶液を塗布したところ、数分で皮膚が透明化しました。頭蓋骨を通して血管が観察可能になり、腹部では内臓や消化管の動きを直接観察することができました。このプロセスは、皮膚に浸透した染料が代謝され尿として排出されることで可逆的です。
将来的な応用と課題
この技術は、光学的イメージングの研究方法を飛躍的に向上させる可能性があります。オウ博士は、「この技術は現在の光学的研究を大きく進化させ、生物学研究に革命をもたらすでしょう」と語っています。
ただし、ヒトの皮膚はマウスの約10倍の厚さがあるため、染料の適切な濃度や適用方法についての追加研究が
科学研究ニュース:マウスの皮膚を透明化する新技術
研究者らが、マウスの頭蓋骨や腹部の皮膚を透明化する技術を開発しました。この研究は、テキサス大学ダラス校の助教授、ジーハオ・オウ博士(Zihao Ou, PhD)を筆頭著者として、2024年9月6日発行のScience誌に掲載されました。論文タイトルは「Achieving Optical Transparency in Live Animals with Absorbing Molecules(光吸収分子を用いた生体動物の光学的透明化の達成)」です。
技術の概要と背景
生体の皮膚は光を散乱させる性質を持ち、霧のように光を遮ります。しかし、オウ博士らの研究では、食品添加物として一般的に使用されるタートラジン(FD&C Yellow #5)と水を混ぜた溶液を用いることで、皮膚の透明化を実現しました。
「光吸収分子である黄色の染料と、光散乱性を持つ皮膚を組み合わせることで透明化が可能になりました」とオウ博士は述べています。これは、染料分子が水に溶けることで、皮膚組織の構成成分である脂質などの屈折率に近づき、光散乱が減少するためです。
実験と結果
マウスの頭蓋骨や腹部の皮膚にこの溶液を塗布したところ、数分で皮膚が透明化しました。頭蓋骨を通して血管が観察可能になり、腹部では内臓や消化管の動きを直接観察することができました。このプロセスは、皮膚に浸透した染料が代謝され尿として排出されることで可逆的です。
将来的な応用と課題
この技術は、光学的イメージングの研究方法を飛躍的に向上させる可能性があります。オウ博士は、「この技術は現在の光学的研究を大きく進化させ、生物学研究に革命をもたらすでしょう」と語っています。
ただし、ヒトの皮膚はマウスの約10倍の厚さがあるため、染料の適切な濃度や適用方法についての追加研究が
バクテリアの24時間時計:季節を予測する新たなメカニズムの発見
 バクテリアは内部の24時間時計を使って季節の到来を予測
バクテリアが内部の24時間時計を利用して新しい季節の到来を予測することができるという研究成果が発表されました。この発見は、「アイスバケットチャレンジ」のような実験を通じて得られたもので、動物の移動や植物の開花といった生物の季節的な適応が、サーカディアンリズム(体内時計の分子的メカニズム)によってどのように支えられているかを解明する上で重要な意味を持ちます。
研究チームはシアノバクテリア(青緑藻)に異なる人工的な昼夜周期を設定し、それを一定の温暖な温度下で8日間観察しました。短日(8時間の光と16時間の暗闇)、春分の日(光と暗闇が等しい)、長日(16時間の光と8時間の暗闇)という条件で処理を行った後、これらのシアノバクテリアを氷点下の環境に2時間さらし、生存率を測定しました。その結果、短日を連続して経験したサンプルの生存率は75%に達し、この準備を行わなかったコロニーよりも最大3倍高いことが判明しました。
短日を1日だけ経験しても耐寒性は向上しませんでしたが、短日が6~8日間続くと顕著に生存率が上昇しました。さらに、シアノバクテリアの体内時計を構成する遺伝子を除去した場合、昼夜周期に関わらず生存率は変化しませんでした。これにより、日長周期を測定し季節に備える能力(フォトペリオディズム:光周性)が、環境の長期的変化への適応において重要であることが示されました。
新しい視点で気候変動に挑む
「この研究は、自然界のバクテリアが内部時計を使って日長を測定し、短日が一定数に達すると、冬の挑戦に備える新しい生理状態に切り替わることを示しています」と語るのは、本研究の第一著者であるルイーザ・ジャブール博士(Luísa Jabbur, PhD)です。研究は彼女がテネシー州ヴァンダービルト大学のカール・ジョンソン教授(Pro
バクテリアは内部の24時間時計を使って季節の到来を予測
バクテリアが内部の24時間時計を利用して新しい季節の到来を予測することができるという研究成果が発表されました。この発見は、「アイスバケットチャレンジ」のような実験を通じて得られたもので、動物の移動や植物の開花といった生物の季節的な適応が、サーカディアンリズム(体内時計の分子的メカニズム)によってどのように支えられているかを解明する上で重要な意味を持ちます。
研究チームはシアノバクテリア(青緑藻)に異なる人工的な昼夜周期を設定し、それを一定の温暖な温度下で8日間観察しました。短日(8時間の光と16時間の暗闇)、春分の日(光と暗闇が等しい)、長日(16時間の光と8時間の暗闇)という条件で処理を行った後、これらのシアノバクテリアを氷点下の環境に2時間さらし、生存率を測定しました。その結果、短日を連続して経験したサンプルの生存率は75%に達し、この準備を行わなかったコロニーよりも最大3倍高いことが判明しました。
短日を1日だけ経験しても耐寒性は向上しませんでしたが、短日が6~8日間続くと顕著に生存率が上昇しました。さらに、シアノバクテリアの体内時計を構成する遺伝子を除去した場合、昼夜周期に関わらず生存率は変化しませんでした。これにより、日長周期を測定し季節に備える能力(フォトペリオディズム:光周性)が、環境の長期的変化への適応において重要であることが示されました。
新しい視点で気候変動に挑む
「この研究は、自然界のバクテリアが内部時計を使って日長を測定し、短日が一定数に達すると、冬の挑戦に備える新しい生理状態に切り替わることを示しています」と語るのは、本研究の第一著者であるルイーザ・ジャブール博士(Luísa Jabbur, PhD)です。研究は彼女がテネシー州ヴァンダービルト大学のカール・ジョンソン教授(Pro
次世代遺伝子編集技術で嚢胞性線維症の未来が変わる?
 次世代型遺伝子編集は嚢胞性線維症(CF)の治療法となるのか?
近年、嚢胞性線維症(CF)に関する治療は大きく進展しましたが、依然として現行治療では効果が得られない患者が存在しています。特に、医療格差の影響を受ける患者にとっては深刻です。アイオワ大学の小児科および微生物学・免疫学教授ポール・マクレー医学博士(Paul McCray, MD)とブロード研究所のデイビッド・リュー博士(David Liu, PhD)は、遺伝子編集技術の新しいバージョンであるプライムエディティングの開発に取り組んでいます。この技術は、遺伝コード中のどの文字でも置換可能で、数百文字に及ぶセクションにも適用できます。
CFはヒトゲノムに含まれる約20,000個の遺伝子のうち、嚢胞性線維症膜貫通調節因子(CFTR)遺伝子の変異によって引き起こされます。最近、マクレー博士らは、リュー博士のチームが開発した遺伝子編集技術に6つの改良を加えた技術を用いて、肺のヒト細胞の60%、および患者の肺から直接採取した気道細胞の25%で遺伝子欠失を修正しました。この研究は米国国立心肺血液研究所(NHLBI)の支援を受けています。
CFとは何か?
CFは世界中で16万人以上に影響を与える遺伝性疾患で、特に肺疾患として知られています。症状には咳、呼吸困難、頻繁な肺感染症が含まれますが、他にも副鼻腔、肝臓、腸、膵臓、生殖器系など複数の臓器に影響を及ぼします。CFTR遺伝子には2,000種類以上の変異が存在し、そのうち少なくとも700種類が疾患を引き起こします。最も一般的な変異は、CF患者の約70%に見られる3文字のコード削除です。この削除により、CFTRタンパク質の異常形成や早期分解が生じ、粘性の高い分泌物の蓄積を引き起こします。これにより、肺では細菌が捕捉され、感染や炎症を引き起こします。
革新的な治療薬の登場と
次世代型遺伝子編集は嚢胞性線維症(CF)の治療法となるのか?
近年、嚢胞性線維症(CF)に関する治療は大きく進展しましたが、依然として現行治療では効果が得られない患者が存在しています。特に、医療格差の影響を受ける患者にとっては深刻です。アイオワ大学の小児科および微生物学・免疫学教授ポール・マクレー医学博士(Paul McCray, MD)とブロード研究所のデイビッド・リュー博士(David Liu, PhD)は、遺伝子編集技術の新しいバージョンであるプライムエディティングの開発に取り組んでいます。この技術は、遺伝コード中のどの文字でも置換可能で、数百文字に及ぶセクションにも適用できます。
CFはヒトゲノムに含まれる約20,000個の遺伝子のうち、嚢胞性線維症膜貫通調節因子(CFTR)遺伝子の変異によって引き起こされます。最近、マクレー博士らは、リュー博士のチームが開発した遺伝子編集技術に6つの改良を加えた技術を用いて、肺のヒト細胞の60%、および患者の肺から直接採取した気道細胞の25%で遺伝子欠失を修正しました。この研究は米国国立心肺血液研究所(NHLBI)の支援を受けています。
CFとは何か?
CFは世界中で16万人以上に影響を与える遺伝性疾患で、特に肺疾患として知られています。症状には咳、呼吸困難、頻繁な肺感染症が含まれますが、他にも副鼻腔、肝臓、腸、膵臓、生殖器系など複数の臓器に影響を及ぼします。CFTR遺伝子には2,000種類以上の変異が存在し、そのうち少なくとも700種類が疾患を引き起こします。最も一般的な変異は、CF患者の約70%に見られる3文字のコード削除です。この削除により、CFTRタンパク質の異常形成や早期分解が生じ、粘性の高い分泌物の蓄積を引き起こします。これにより、肺では細菌が捕捉され、感染や炎症を引き起こします。
革新的な治療薬の登場と
高性能顕微鏡不要!MITの新技術で細胞内部のナノ構造を観察可能に
 高価な超解像顕微鏡がなくても、細胞内のナノ構造を観察できる新しい拡張技術がMITの研究者によって開発されました。この技術では、組織を膨張させてイメージングを行うことで、一般的な光学顕微鏡でもナノスケールの解像度を実現します。最新バージョンでは、組織を単一ステップで20倍に拡大できるようになりました。この手法は簡便かつ低コストであり、多くの生物学研究室でナノスケールイメージングが可能になると期待されています。
「この技術は、イメージングを民主化します。これまでは高解像度の観察には非常に高価な顕微鏡が必要でしたが、この新技術により通常の顕微鏡でも見えなかったものが見えるようになります」と、MITのローラ・キースリング博士(Laura Kiessling, PhD)は述べています。
研究の概要
この技術では、20ナノメートルという高解像度が可能となり、細胞内部のオルガネラやタンパク質のクラスターを観察することができます。MITのボイデン博士(Edward Boyden PhD)は「生物学的分子が活動する領域に近づいており、生命の構成要素であるバイオ分子や遺伝子、遺伝子産物を詳細に見ることが可能です」と述べています。
この研究は、2024年10月11日にNature Methodsに発表され、論文のタイトルは「「Single-Shot 20-Fold Expansion Microscopy」(単一ステップで20倍拡大を可能にする拡張顕微鏡法)」です。
技術の詳細
拡張顕微鏡法は、組織を吸水性ポリマーに埋め込み、組織を保持するタンパク質を分解することで膨張させます。2015年にボイデン博士の研究室が最初にこの技術を開発し、当初は約4倍の拡大で70ナノメートルの解像度を実現しました。その後、2017年には2回の拡張ステップを加えることで20倍の拡大が可能になりましたが
高価な超解像顕微鏡がなくても、細胞内のナノ構造を観察できる新しい拡張技術がMITの研究者によって開発されました。この技術では、組織を膨張させてイメージングを行うことで、一般的な光学顕微鏡でもナノスケールの解像度を実現します。最新バージョンでは、組織を単一ステップで20倍に拡大できるようになりました。この手法は簡便かつ低コストであり、多くの生物学研究室でナノスケールイメージングが可能になると期待されています。
「この技術は、イメージングを民主化します。これまでは高解像度の観察には非常に高価な顕微鏡が必要でしたが、この新技術により通常の顕微鏡でも見えなかったものが見えるようになります」と、MITのローラ・キースリング博士(Laura Kiessling, PhD)は述べています。
研究の概要
この技術では、20ナノメートルという高解像度が可能となり、細胞内部のオルガネラやタンパク質のクラスターを観察することができます。MITのボイデン博士(Edward Boyden PhD)は「生物学的分子が活動する領域に近づいており、生命の構成要素であるバイオ分子や遺伝子、遺伝子産物を詳細に見ることが可能です」と述べています。
この研究は、2024年10月11日にNature Methodsに発表され、論文のタイトルは「「Single-Shot 20-Fold Expansion Microscopy」(単一ステップで20倍拡大を可能にする拡張顕微鏡法)」です。
技術の詳細
拡張顕微鏡法は、組織を吸水性ポリマーに埋め込み、組織を保持するタンパク質を分解することで膨張させます。2015年にボイデン博士の研究室が最初にこの技術を開発し、当初は約4倍の拡大で70ナノメートルの解像度を実現しました。その後、2017年には2回の拡張ステップを加えることで20倍の拡大が可能になりましたが
深海ムール貝の核内寄生細菌の謎に迫る
 深海ムール貝の核内に生息する細菌寄生虫の生存戦略を解明
生物と細菌は密接な関係を持つことが知られていますが、その中でも細菌が宿主の細胞内に住みつく事例は稀です。さらに細胞核(細胞の制御センター)内に住む細菌は、これまでほとんど知られていませんでした。しかし、ドイツのマックスプランク海洋微生物学研究所の研究者たちは、動物の細胞核内に寄生する細菌について初めて詳細に解明しました。この研究は2024年9月6日にNature Microbiology誌に掲載され、「An Intranuclear Bacterial Parasite of Deep-Sea Mussels Expresses Apoptosis Inhibitors Acquired from Its Host(深海ムール貝の核内寄生細菌が宿主由来のアポトーシス阻害因子を発現する)」と題されています。
核内で増殖しながら宿主を維持する仕組み
この寄生細菌「カンジダタス・エンドヌクレオバクター」は、深海の熱水噴出孔や低温湧出帯に生息するムール貝の核内に寄生します。一つの細菌細胞が宿主の核内に侵入し、その後約80,000個以上にまで増殖します。この過程で核は元の大きさの50倍に膨張します。「この細菌が核内にどのように侵入し、どのようにして必要な栄養素を得て大量に増殖するのか、さらに宿主細胞を死なせない方法を解明したかった」と、共同研究者のニコ・ライシュ博士(Niko Leisch, PhD)とニコール・デュビリエ博士(Nicole Dubilier, PhD)は語ります。
研究チームは分子生物学的手法やイメージング技術を用いて、Ca. Endonucleobacterが宿主の糖や脂質などを栄養源としていることを発見しました。この細菌は宿主の核酸を分解せず、この特異な摂食戦略によって宿主細胞を長期間機能させた
深海ムール貝の核内に生息する細菌寄生虫の生存戦略を解明
生物と細菌は密接な関係を持つことが知られていますが、その中でも細菌が宿主の細胞内に住みつく事例は稀です。さらに細胞核(細胞の制御センター)内に住む細菌は、これまでほとんど知られていませんでした。しかし、ドイツのマックスプランク海洋微生物学研究所の研究者たちは、動物の細胞核内に寄生する細菌について初めて詳細に解明しました。この研究は2024年9月6日にNature Microbiology誌に掲載され、「An Intranuclear Bacterial Parasite of Deep-Sea Mussels Expresses Apoptosis Inhibitors Acquired from Its Host(深海ムール貝の核内寄生細菌が宿主由来のアポトーシス阻害因子を発現する)」と題されています。
核内で増殖しながら宿主を維持する仕組み
この寄生細菌「カンジダタス・エンドヌクレオバクター」は、深海の熱水噴出孔や低温湧出帯に生息するムール貝の核内に寄生します。一つの細菌細胞が宿主の核内に侵入し、その後約80,000個以上にまで増殖します。この過程で核は元の大きさの50倍に膨張します。「この細菌が核内にどのように侵入し、どのようにして必要な栄養素を得て大量に増殖するのか、さらに宿主細胞を死なせない方法を解明したかった」と、共同研究者のニコ・ライシュ博士(Niko Leisch, PhD)とニコール・デュビリエ博士(Nicole Dubilier, PhD)は語ります。
研究チームは分子生物学的手法やイメージング技術を用いて、Ca. Endonucleobacterが宿主の糖や脂質などを栄養源としていることを発見しました。この細菌は宿主の核酸を分解せず、この特異な摂食戦略によって宿主細胞を長期間機能させた
LCA1の遺伝子治療:失明患者に光を取り戻す画期的成果
 遺伝性失明「LCA1」における画期的な遺伝子治療、患者に新たな視界を提供
フロリダ大学(University of Florida, UF)の研究者らが開発した遺伝子治療により、稀少な遺伝性失明「レーバー先天性黒内障1型(LCA1)」を患う患者が劇的な改善を経験しました。治療を受けた患者の中には、星を初めて見ることができた人や雪の結晶を初めて目にした人もいます。多くの患者は日常生活での外出が容易になり、ハロウィーンのお菓子のラベルを読むことも可能となりました。
臨床試験と治療の効果
この治療法は、GUCY2D遺伝子における両アレル変異によるLCA1患者を対象としたもので、「ATSN-101」と名付けられた遺伝子治療を用いた臨床試験の結果が2024年9月7日、権威ある医学誌The Lancetに掲載されました。論文のタイトルは「Safety and Efficacy of ATSN-101 in Patients with Leber Congenital Amaurosis Caused by Biallelic Mutations in GUCY2D: a Phase 1/2, Multicentre, Open-Label, Unilateral Dose Escalation Study(GUCY2Dの両アレル変異によるレーバー先天性黒内障患者におけるATSN-101の安全性と有効性:第1/2相、多施設、オープンラベル、片眼用投与量エスカレーション試験)」です。
治療を受けた患者は、光感度が最大1万倍改善し、視力検査表でより多くの行を読むことができるようになり、標準化された迷路のナビゲーション能力も向上しました。研究者らは、この改善を「真っ暗闇での生活から、かすかな明かりが灯るようになった感覚」と表現しています。
安全性と次のステップ
この治療は、眼の
遺伝性失明「LCA1」における画期的な遺伝子治療、患者に新たな視界を提供
フロリダ大学(University of Florida, UF)の研究者らが開発した遺伝子治療により、稀少な遺伝性失明「レーバー先天性黒内障1型(LCA1)」を患う患者が劇的な改善を経験しました。治療を受けた患者の中には、星を初めて見ることができた人や雪の結晶を初めて目にした人もいます。多くの患者は日常生活での外出が容易になり、ハロウィーンのお菓子のラベルを読むことも可能となりました。
臨床試験と治療の効果
この治療法は、GUCY2D遺伝子における両アレル変異によるLCA1患者を対象としたもので、「ATSN-101」と名付けられた遺伝子治療を用いた臨床試験の結果が2024年9月7日、権威ある医学誌The Lancetに掲載されました。論文のタイトルは「Safety and Efficacy of ATSN-101 in Patients with Leber Congenital Amaurosis Caused by Biallelic Mutations in GUCY2D: a Phase 1/2, Multicentre, Open-Label, Unilateral Dose Escalation Study(GUCY2Dの両アレル変異によるレーバー先天性黒内障患者におけるATSN-101の安全性と有効性:第1/2相、多施設、オープンラベル、片眼用投与量エスカレーション試験)」です。
治療を受けた患者は、光感度が最大1万倍改善し、視力検査表でより多くの行を読むことができるようになり、標準化された迷路のナビゲーション能力も向上しました。研究者らは、この改善を「真っ暗闇での生活から、かすかな明かりが灯るようになった感覚」と表現しています。
安全性と次のステップ
この治療は、眼の
加齢黄斑変性症の新治療法発見:ヒトiPS細胞を用いた研究から
 加齢黄斑変性症(AMD)の進展メカニズムと新たな治療戦略の発見
アメリカで失明の主要原因の一つである加齢黄斑変性症(AMD)。現在の治療法には限界があり、病気の根本的な原因や効果的な治療法は未だ不明な点が多い状況です。しかし、2024年10月2日付けで科学誌Developmental Cellに掲載された新しい研究論文「Human iPSC–Based Disease Modeling Studies Identify a Common Mechanistic Defect and Potential Therapies for AMD and Related Macular Dystrophies(ヒトiPS細胞ベースの疾患モデル研究がAMDおよび関連する黄斑ジストロフィーの共通メカニズム的欠陥と潜在的治療法を特定)」は、この疾患の細胞メカニズムに関する重要な洞察を提供し、新たな治療法の可能性を示しています。
TIMP3: AMD進展に関わる重要なタンパク質
この研究は、ヒトiPS細胞(human-induced pluripotent stem cell, ヒトiPS細胞)を用いてAMDのモデル化を行い、動物モデル研究の限界を克服しました。AMDとより希少な遺伝性盲目疾患である黄斑ジストロフィーに関連する遺伝子を調べることで、病気の初期段階に関与する重要なタンパク質を特定しました。
網膜色素上皮(retinal pigment epithelium, RPE)は、目の奥にある細胞層でAMDにおいて重要な役割を果たします。このRPEでは時間の経過とともに、ドルーゼン(脂質やタンパク質の沈着物)が蓄積し、これはAMDの初期指標として知られています。
研究者らは、組織型メタロプロテアーゼ阻害因子3(TIMP3)というタンパク質がAMDにおいて過剰に産生されること
加齢黄斑変性症(AMD)の進展メカニズムと新たな治療戦略の発見
アメリカで失明の主要原因の一つである加齢黄斑変性症(AMD)。現在の治療法には限界があり、病気の根本的な原因や効果的な治療法は未だ不明な点が多い状況です。しかし、2024年10月2日付けで科学誌Developmental Cellに掲載された新しい研究論文「Human iPSC–Based Disease Modeling Studies Identify a Common Mechanistic Defect and Potential Therapies for AMD and Related Macular Dystrophies(ヒトiPS細胞ベースの疾患モデル研究がAMDおよび関連する黄斑ジストロフィーの共通メカニズム的欠陥と潜在的治療法を特定)」は、この疾患の細胞メカニズムに関する重要な洞察を提供し、新たな治療法の可能性を示しています。
TIMP3: AMD進展に関わる重要なタンパク質
この研究は、ヒトiPS細胞(human-induced pluripotent stem cell, ヒトiPS細胞)を用いてAMDのモデル化を行い、動物モデル研究の限界を克服しました。AMDとより希少な遺伝性盲目疾患である黄斑ジストロフィーに関連する遺伝子を調べることで、病気の初期段階に関与する重要なタンパク質を特定しました。
網膜色素上皮(retinal pigment epithelium, RPE)は、目の奥にある細胞層でAMDにおいて重要な役割を果たします。このRPEでは時間の経過とともに、ドルーゼン(脂質やタンパク質の沈着物)が蓄積し、これはAMDの初期指標として知られています。
研究者らは、組織型メタロプロテアーゼ阻害因子3(TIMP3)というタンパク質がAMDにおいて過剰に産生されること
動物の視覚能力に学ぶ最先端ハイパースペクトルカメラ
 蝶は、人間には見えない光の特性である「偏光」や、さらに広範囲の色を感知する能力を持っています。この特別な能力によって、正確なナビゲーション、餌探し、他の蝶とのコミュニケーションが可能になります。同様に、シャコのような他の生物は、さらに広い光のスペクトルや光波の回転状態(円偏光)も感知し、配偶相手を見つけるための「愛のコード」として利用します。
これらの生物の視覚能力に着想を得たペンシルバニア州立大学工学部の研究チームは、超薄型の光学素子「メタサーフェス」を開発しました。このメタサーフェスは従来のカメラに取り付けることで、撮影した画像や動画に含まれるスペクトルや偏光データを一度にエンコードすることが可能です。このデータは、ナノアンテナのような構造を持つ微細なナノ構造を通じて光の特性を調整する仕組みです。また、研究チームは、標準的なノートパソコンでリアルタイムに多次元の視覚情報をデコードできる機械学習フレームワークも開発しました。
この研究成果は、2024年9月4日にScience Advances誌で公開されました。論文はオープンアクセス形式で、「Real-Time Machine Learning–Enhanced Hyperspectro-Polarimetric Imaging Via an Encoding Metasurface(リアルタイム機械学習によるエンコーディングメタサーフェスを介したハイパースペクトロ偏光イメージング)」というタイトルです。
「動物界が示すように、人間の目には見えない光の特性には、さまざまな応用が可能な情報が隠されています」と、本研究の主導者であるペンシルバニア州立大学の電気工学准教授、ニー・シンジェ博士(Xingjie Ni, PhD)は語りました。「この研究では、メタサーフェスを従来のカメラに統合することで、コンパクトで軽量な
蝶は、人間には見えない光の特性である「偏光」や、さらに広範囲の色を感知する能力を持っています。この特別な能力によって、正確なナビゲーション、餌探し、他の蝶とのコミュニケーションが可能になります。同様に、シャコのような他の生物は、さらに広い光のスペクトルや光波の回転状態(円偏光)も感知し、配偶相手を見つけるための「愛のコード」として利用します。
これらの生物の視覚能力に着想を得たペンシルバニア州立大学工学部の研究チームは、超薄型の光学素子「メタサーフェス」を開発しました。このメタサーフェスは従来のカメラに取り付けることで、撮影した画像や動画に含まれるスペクトルや偏光データを一度にエンコードすることが可能です。このデータは、ナノアンテナのような構造を持つ微細なナノ構造を通じて光の特性を調整する仕組みです。また、研究チームは、標準的なノートパソコンでリアルタイムに多次元の視覚情報をデコードできる機械学習フレームワークも開発しました。
この研究成果は、2024年9月4日にScience Advances誌で公開されました。論文はオープンアクセス形式で、「Real-Time Machine Learning–Enhanced Hyperspectro-Polarimetric Imaging Via an Encoding Metasurface(リアルタイム機械学習によるエンコーディングメタサーフェスを介したハイパースペクトロ偏光イメージング)」というタイトルです。
「動物界が示すように、人間の目には見えない光の特性には、さまざまな応用が可能な情報が隠されています」と、本研究の主導者であるペンシルバニア州立大学の電気工学准教授、ニー・シンジェ博士(Xingjie Ni, PhD)は語りました。「この研究では、メタサーフェスを従来のカメラに統合することで、コンパクトで軽量な
新技術でナノセンサー進化、蛍光アミノ酸がもたらす診断革命
 バイオセンサーは、生体分子を利用して特定の物質の存在を検出する装置であり、医療診断、基礎研究、環境モニタリングなど、多岐にわたる用途での可能性を秘めています。その中でも特に「蛍光バイオセンサー」は、ターゲットとなる物質と結合することで蛍光を発するプローブ分子を組み込んでいます。しかし、従来の蛍光バイオセンサーは結合していない分子も蛍光を発するため、信号検出前に洗浄などの手間が必要で、コントラストが低いという課題がありました。
今回、ハーバード大学ワイス研究所、ハーバード医科大学、MIT、英国エジンバラ大学の共同研究チームは、特定のタンパク質やペプチド、小分子を迅速かつ高感度に検出する「結合活性化型蛍光ナノセンサー」を効率的に開発する合成生物学プラットフォームを構築しました。このプラットフォームの鍵となるのは、ターゲット結合小タンパク質(バインダー)に新規の蛍光誘導アミノ酸(FgAAs: fluorogenic amino acids)を組み込む技術です。この技術は遺伝暗号の拡張を可能にし、バインダーをナノセンサーに進化させるための基盤となっています。研究成果は、2024年9月5日付でNature Communicationsに公開されました。
研究チームは、従来のバイオセンサー開発プロセスにおける複雑さを解決するため、化学進化と高スループットスクリーニング技術を組み合わせました。特に注目すべきは、新規の蛍光誘導アミノ酸をバインダータンパク質に組み込むことで、ターゲット結合時のみ蛍光を発するセンサーを開発した点です。この技術により、環境モニタリングや精密医療の分野で即時かつ高感度の検出が可能になります。
「この技術は、細胞の遺伝暗号を拡張して新しい機能を持たせる我々の研究の延長線上にあります。このプラットフォームは、より高性能なバイオセンサーの実現を阻んでいた多くの
バイオセンサーは、生体分子を利用して特定の物質の存在を検出する装置であり、医療診断、基礎研究、環境モニタリングなど、多岐にわたる用途での可能性を秘めています。その中でも特に「蛍光バイオセンサー」は、ターゲットとなる物質と結合することで蛍光を発するプローブ分子を組み込んでいます。しかし、従来の蛍光バイオセンサーは結合していない分子も蛍光を発するため、信号検出前に洗浄などの手間が必要で、コントラストが低いという課題がありました。
今回、ハーバード大学ワイス研究所、ハーバード医科大学、MIT、英国エジンバラ大学の共同研究チームは、特定のタンパク質やペプチド、小分子を迅速かつ高感度に検出する「結合活性化型蛍光ナノセンサー」を効率的に開発する合成生物学プラットフォームを構築しました。このプラットフォームの鍵となるのは、ターゲット結合小タンパク質(バインダー)に新規の蛍光誘導アミノ酸(FgAAs: fluorogenic amino acids)を組み込む技術です。この技術は遺伝暗号の拡張を可能にし、バインダーをナノセンサーに進化させるための基盤となっています。研究成果は、2024年9月5日付でNature Communicationsに公開されました。
研究チームは、従来のバイオセンサー開発プロセスにおける複雑さを解決するため、化学進化と高スループットスクリーニング技術を組み合わせました。特に注目すべきは、新規の蛍光誘導アミノ酸をバインダータンパク質に組み込むことで、ターゲット結合時のみ蛍光を発するセンサーを開発した点です。この技術により、環境モニタリングや精密医療の分野で即時かつ高感度の検出が可能になります。
「この技術は、細胞の遺伝暗号を拡張して新しい機能を持たせる我々の研究の延長線上にあります。このプラットフォームは、より高性能なバイオセンサーの実現を阻んでいた多くの
海綿から結核菌の進化を解明する新細菌を発見
 海綿から発見された結核菌に酷似した細菌が新たな結核研究の扉を開く
オーストラリアのグレートバリアリーフで採取された海綿から発見された新種の細菌「マイコバクテリウム・スポンジアイ」が、結核の病原菌である結核菌に驚くほど似ていることが明らかになりました。この発見は、結核研究や治療戦略の新たな指針となる可能性を秘めています。世界で最も致死率の高い感染症の一つである結核ですが、その原因菌である結核菌の起源は未だ完全には解明されていません。この研究結果は、2024年8月29日にオープンアクセス誌PLOS Pathogensに掲載され、「Marine Sponge Microbe Provides Insights into Evolution and Virulence of the Tubercle Bacillus(海綿微生物が結核菌の進化と病原性に関する洞察を提供)」と題された論文で発表されました。
発見の背景と詳細
海綿は「化学工場」とも呼ばれ、抗がん、抗菌、抗ウイルス、抗炎症効果を持つバイオアクティブ化合物の重要な供給源として知られています。クイーンズランド大学の研究者らが化学物質を生産する細菌を調査していた際、この奇妙な細菌が発見されました。このサンプルはピーター・ドハーティ感染症免疫研究所に送られ、遺伝子、タンパク質、脂質の詳細な分析が行われました。その結果、「M. spongiae」は結核菌と80%もの遺伝情報を共有しており、病原性に関わる主要な遺伝子も含まれていることが判明しました。しかし、結核菌とは異なり、M. spongiaeはマウスに病原性を示さず、非病原性であることが確認されました。
研究者のコメント
この研究の共同筆頭著者であるメルボルン大学のサシャ・ピドット博士(Sacha Pidot, PhD)は、次のように述べています。「この細菌が結核
海綿から発見された結核菌に酷似した細菌が新たな結核研究の扉を開く
オーストラリアのグレートバリアリーフで採取された海綿から発見された新種の細菌「マイコバクテリウム・スポンジアイ」が、結核の病原菌である結核菌に驚くほど似ていることが明らかになりました。この発見は、結核研究や治療戦略の新たな指針となる可能性を秘めています。世界で最も致死率の高い感染症の一つである結核ですが、その原因菌である結核菌の起源は未だ完全には解明されていません。この研究結果は、2024年8月29日にオープンアクセス誌PLOS Pathogensに掲載され、「Marine Sponge Microbe Provides Insights into Evolution and Virulence of the Tubercle Bacillus(海綿微生物が結核菌の進化と病原性に関する洞察を提供)」と題された論文で発表されました。
発見の背景と詳細
海綿は「化学工場」とも呼ばれ、抗がん、抗菌、抗ウイルス、抗炎症効果を持つバイオアクティブ化合物の重要な供給源として知られています。クイーンズランド大学の研究者らが化学物質を生産する細菌を調査していた際、この奇妙な細菌が発見されました。このサンプルはピーター・ドハーティ感染症免疫研究所に送られ、遺伝子、タンパク質、脂質の詳細な分析が行われました。その結果、「M. spongiae」は結核菌と80%もの遺伝情報を共有しており、病原性に関わる主要な遺伝子も含まれていることが判明しました。しかし、結核菌とは異なり、M. spongiaeはマウスに病原性を示さず、非病原性であることが確認されました。
研究者のコメント
この研究の共同筆頭著者であるメルボルン大学のサシャ・ピドット博士(Sacha Pidot, PhD)は、次のように述べています。「この細菌が結核
恐竜化石に見つかったコラーゲン:水による分解を防ぐ新発見
 古代のコラーゲンが水の攻撃から守られる仕組みを発見
195百万年前の恐竜化石から見つかったコラーゲンは、通常のタンパク質結合の寿命である500年を大きく超える保存期間を持つことがわかっています。この驚くべき現象について、MITの研究チームが新たな説明を発表しました。彼らは、コラーゲン内で特別な原子レベルの相互作用が水分子による攻撃を防ぐことを明らかにしました。この相互作用がペプチド結合を守り、加水分解による分解を防ぐバリアとして機能しているのです。
この研究はMITのファーミニッヒ化学教授、ロン・レインズ博士(Ron Raines, PhD)を中心に進められました。この成果は、2024年9月4日に「ACS Central Science」に掲載されました。筆頭著者はMITのポスドク研究員であるヤン・ジンイー博士(Jinyi Yang, PhD)で、共同著者には同じくMITのポスドク研究員であるヴォルガ・コジャソイ博士(Volga Kojasoy, PhD)と大学院生のジェラード・ポーター(Gerard Porter)が名を連ねています。このオープンアクセスの論文は「Pauli Exclusion by n→pi Interactions: Implications for Paleobiology(n→π相互作用によるパウリの排他性:古生物学への示唆)」と題されています。
水に強いコラーゲンの秘密
コラーゲンは骨や皮膚、筋肉、靭帯に存在する動物の主要なタンパク質で、その強靭な三重らせん構造が特徴です。「コラーゲンは私たちをつなぎ止める足場のような存在です」とレインズ博士は語ります。「通常のタンパク質とは異なり、コラーゲンは繊維状で非常に安定しています。」最近では、恐竜化石の中に保存されたコラーゲンが80百万年前のティラノサウルスや195百万年前の竜脚類の化石から
古代のコラーゲンが水の攻撃から守られる仕組みを発見
195百万年前の恐竜化石から見つかったコラーゲンは、通常のタンパク質結合の寿命である500年を大きく超える保存期間を持つことがわかっています。この驚くべき現象について、MITの研究チームが新たな説明を発表しました。彼らは、コラーゲン内で特別な原子レベルの相互作用が水分子による攻撃を防ぐことを明らかにしました。この相互作用がペプチド結合を守り、加水分解による分解を防ぐバリアとして機能しているのです。
この研究はMITのファーミニッヒ化学教授、ロン・レインズ博士(Ron Raines, PhD)を中心に進められました。この成果は、2024年9月4日に「ACS Central Science」に掲載されました。筆頭著者はMITのポスドク研究員であるヤン・ジンイー博士(Jinyi Yang, PhD)で、共同著者には同じくMITのポスドク研究員であるヴォルガ・コジャソイ博士(Volga Kojasoy, PhD)と大学院生のジェラード・ポーター(Gerard Porter)が名を連ねています。このオープンアクセスの論文は「Pauli Exclusion by n→pi Interactions: Implications for Paleobiology(n→π相互作用によるパウリの排他性:古生物学への示唆)」と題されています。
水に強いコラーゲンの秘密
コラーゲンは骨や皮膚、筋肉、靭帯に存在する動物の主要なタンパク質で、その強靭な三重らせん構造が特徴です。「コラーゲンは私たちをつなぎ止める足場のような存在です」とレインズ博士は語ります。「通常のタンパク質とは異なり、コラーゲンは繊維状で非常に安定しています。」最近では、恐竜化石の中に保存されたコラーゲンが80百万年前のティラノサウルスや195百万年前の竜脚類の化石から
北極海の微細藻類、極夜後の光合成の驚異的適応力を発見
 北極圏の微細藻類、極限環境での光合成能力を証明—MOSAiCプロジェクトによる新たな発見
極限的に低い光量でも自然界で光合成が可能であることが、国際研究チームによる最新研究で明らかになりました。この研究は、北極圏の「極夜」が明けた後の微細藻類の発展を調査したもので、MOSAiC(モザイク)遠征の一環として北緯88度で行われました。この結果は、3月末という太陽がほとんど地平線上に出ない時期でも、雪と氷に覆われた北極海の環境下で微細藻類が光合成を通じて生物量を形成できることを示しています。この研究成果は、学術誌Nature Communicationsに掲載され、光合成が従来考えられていたよりもはるかに低い光量条件下、つまり海洋のより深い部分でも可能であることを示唆しています。
光合成の重要性と新発見
光合成は、太陽光を生物が利用可能なエネルギーに変換するプロセスであり、地球上の生命の基盤となっています。しかし、これまで光合成に必要な光量の測定値は、理論的な最小値よりもはるかに高いものでした。この研究では、ほぼ理論上の最小光量に近い条件で生物量の形成が可能であることが示されました。このオープンアクセス論文のタイトルは、「Photosynthetic Light Requirement Near the Theoretical Minimum Detected in Arctic Microalgae(理論的最小光量近くでの北極微細藻類による光合成の発見)」です。
研究の背景と手法
本研究は、国際的なMOSAiCプロジェクトのデータを活用して行われました。このプロジェクトの一環として、ドイツの研究船「ポーラースターン」を2019年に中央北極の氷に固定し、北極の気候と生態系の年間サイクルを調査しました。アルフレッド・ウェゲナー研究所(Alfred Wegener In
北極圏の微細藻類、極限環境での光合成能力を証明—MOSAiCプロジェクトによる新たな発見
極限的に低い光量でも自然界で光合成が可能であることが、国際研究チームによる最新研究で明らかになりました。この研究は、北極圏の「極夜」が明けた後の微細藻類の発展を調査したもので、MOSAiC(モザイク)遠征の一環として北緯88度で行われました。この結果は、3月末という太陽がほとんど地平線上に出ない時期でも、雪と氷に覆われた北極海の環境下で微細藻類が光合成を通じて生物量を形成できることを示しています。この研究成果は、学術誌Nature Communicationsに掲載され、光合成が従来考えられていたよりもはるかに低い光量条件下、つまり海洋のより深い部分でも可能であることを示唆しています。
光合成の重要性と新発見
光合成は、太陽光を生物が利用可能なエネルギーに変換するプロセスであり、地球上の生命の基盤となっています。しかし、これまで光合成に必要な光量の測定値は、理論的な最小値よりもはるかに高いものでした。この研究では、ほぼ理論上の最小光量に近い条件で生物量の形成が可能であることが示されました。このオープンアクセス論文のタイトルは、「Photosynthetic Light Requirement Near the Theoretical Minimum Detected in Arctic Microalgae(理論的最小光量近くでの北極微細藻類による光合成の発見)」です。
研究の背景と手法
本研究は、国際的なMOSAiCプロジェクトのデータを活用して行われました。このプロジェクトの一環として、ドイツの研究船「ポーラースターン」を2019年に中央北極の氷に固定し、北極の気候と生態系の年間サイクルを調査しました。アルフレッド・ウェゲナー研究所(Alfred Wegener In
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill