遺伝子制御の謎:『パイオニア因子』がクロマチンの鍵を開けるメカニズム
 哺乳類細胞生物学と発生学において、初期の段階であらゆる幹細胞は、運命を選ぶという重大な岐路に立たされます。例えば、皮膚の形成過程では、胚の外側を覆う表皮は、単一の層から始まる表皮前駆細胞によって形成されます。そして、これらの幹細胞は、その後、成熟した表皮細胞となるか、毛包細胞に成長するかを選択しなければなりません。この複雑な選択過程は、SOX9と呼ばれる転写因子によって支配されています。胚の前駆細胞がSOX9を発現している場合、それは毛包細胞へと成長を遂げるのです。逆に、SOX9の発現がない場合は、表皮細胞が生成されます。SOX9は肺がん、皮膚がん、頭頸部がん、骨がんなど、世界中で最も致命的ながん種に関与していることが明らかとなっています。皮膚においても、一部の成体表皮幹細胞は、自身の選択に反して後にSOX9を活性化し、その後ずっと活性化させたまま、がん遺伝子の活性化プロセスを開始することがあります。これまで、このような運命の途中での変化がどのようにして引き起こされるのか、分子レベルでの理解が不完全でした。しかし、今回、ロックフェラー研究所の専門家チームが、この悪性化プロセスの背後にあるメカニズムを解き明かしました。
新たな研究によれば、SOX9は特殊なタンパク質ファミリーに属し、DNAからmRNAへの遺伝情報の伝達を司ることが明らかになりました。つまり、SOX9は遺伝情報が封じ込められている領域を解放し、その中に静かに潜んでいた遺伝子と結びつくことで、その遺伝子を活性化させる能力を有しているのです。この驚くべき発見は、科学者たちによってNature Cell Biology誌にて発表されました。オープンアクセス論文のタイトルは 「The Pioneer Factor SOX9 Competes for Epigenetic Factors to Switch Ste
哺乳類細胞生物学と発生学において、初期の段階であらゆる幹細胞は、運命を選ぶという重大な岐路に立たされます。例えば、皮膚の形成過程では、胚の外側を覆う表皮は、単一の層から始まる表皮前駆細胞によって形成されます。そして、これらの幹細胞は、その後、成熟した表皮細胞となるか、毛包細胞に成長するかを選択しなければなりません。この複雑な選択過程は、SOX9と呼ばれる転写因子によって支配されています。胚の前駆細胞がSOX9を発現している場合、それは毛包細胞へと成長を遂げるのです。逆に、SOX9の発現がない場合は、表皮細胞が生成されます。SOX9は肺がん、皮膚がん、頭頸部がん、骨がんなど、世界中で最も致命的ながん種に関与していることが明らかとなっています。皮膚においても、一部の成体表皮幹細胞は、自身の選択に反して後にSOX9を活性化し、その後ずっと活性化させたまま、がん遺伝子の活性化プロセスを開始することがあります。これまで、このような運命の途中での変化がどのようにして引き起こされるのか、分子レベルでの理解が不完全でした。しかし、今回、ロックフェラー研究所の専門家チームが、この悪性化プロセスの背後にあるメカニズムを解き明かしました。
新たな研究によれば、SOX9は特殊なタンパク質ファミリーに属し、DNAからmRNAへの遺伝情報の伝達を司ることが明らかになりました。つまり、SOX9は遺伝情報が封じ込められている領域を解放し、その中に静かに潜んでいた遺伝子と結びつくことで、その遺伝子を活性化させる能力を有しているのです。この驚くべき発見は、科学者たちによってNature Cell Biology誌にて発表されました。オープンアクセス論文のタイトルは 「The Pioneer Factor SOX9 Competes for Epigenetic Factors to Switch Ste
マチュピチュの遺跡からのメッセージ:家来たちのDNAが語る多様なコミュニティ
 マチュピチュの遺跡が照らし出す15世紀のインカ帝国の歴史に、新たな遺伝子解析の知見が注目を浴びている。Science Advances誌に発表された最新の研究によれば、この有名な宮殿の使用人や家来たちは、インカ帝国の多様なコミュニティを代表していたことが示唆された。これによれば、マチュピチュとクスコ周辺の遺跡に埋葬された人々のゲノム多様性が初めて調査され、その結果が明らかになった。
この研究は、イェール大学主導の2021年の研究を含む過去の考古学的・生物考古学的研究を基盤にしており、オープンアクセス論文 「Insights into the Genetic Histories and Lifeways of Machu Picchu's Occupants(マチュピチュの居住者の遺伝的歴史と生活様式に関する洞察。)」として公開されている。
DNA分析は、これまでの歴史的な記述を裏付けると同時に、インカ帝国内でさまざまな地域から集まった個人たちの多様な出自を証明している。イェール大学芸術科学部のチャールズ・J・マッカーディ人類学教授であり、マチュピチュ・プロジェクトの主任研究者である考古学者リチャード・バーガー(Richard Burger)博士は、「DNA分析は、家来がインカの支配下にあった多くの異なる民族から集められた歴史を裏付けるだけでなく、帝国全体から集められた個人たちの出自の多様性を実証しています」と述べている。
バーガー博士によれば、「我々の分析によれば、マチュピチュの集団は非常に異質であり、海岸、高地、アマゾンを含むインカ帝国全域の地域の集団に関連する遺伝的祖先を示す個体がいた」とのことだ。
この研究は、イェール大学をはじめとする複数の研究機関が協力し、ハイラム・ビンガムの所蔵品や人骨をクスコに戻す合意の下で実施されました。国立サンアントニオ・アバド
マチュピチュの遺跡が照らし出す15世紀のインカ帝国の歴史に、新たな遺伝子解析の知見が注目を浴びている。Science Advances誌に発表された最新の研究によれば、この有名な宮殿の使用人や家来たちは、インカ帝国の多様なコミュニティを代表していたことが示唆された。これによれば、マチュピチュとクスコ周辺の遺跡に埋葬された人々のゲノム多様性が初めて調査され、その結果が明らかになった。
この研究は、イェール大学主導の2021年の研究を含む過去の考古学的・生物考古学的研究を基盤にしており、オープンアクセス論文 「Insights into the Genetic Histories and Lifeways of Machu Picchu's Occupants(マチュピチュの居住者の遺伝的歴史と生活様式に関する洞察。)」として公開されている。
DNA分析は、これまでの歴史的な記述を裏付けると同時に、インカ帝国内でさまざまな地域から集まった個人たちの多様な出自を証明している。イェール大学芸術科学部のチャールズ・J・マッカーディ人類学教授であり、マチュピチュ・プロジェクトの主任研究者である考古学者リチャード・バーガー(Richard Burger)博士は、「DNA分析は、家来がインカの支配下にあった多くの異なる民族から集められた歴史を裏付けるだけでなく、帝国全体から集められた個人たちの出自の多様性を実証しています」と述べている。
バーガー博士によれば、「我々の分析によれば、マチュピチュの集団は非常に異質であり、海岸、高地、アマゾンを含むインカ帝国全域の地域の集団に関連する遺伝的祖先を示す個体がいた」とのことだ。
この研究は、イェール大学をはじめとする複数の研究機関が協力し、ハイラム・ビンガムの所蔵品や人骨をクスコに戻す合意の下で実施されました。国立サンアントニオ・アバド
ロックフェラーの科学者、人体の37兆の細胞を駆動する力の謎に迫る
 ロックフェラー大学の構造生物物理学・メカノバイオロジー研究所の所長、グレゴリー・M・アルーシン(Gregory M. Alushin)博士は、自身の科学的キャリアについて、偶然ではなく、多くの経験を積み重ねてきた結果だと考えています。彼は、「『非常に意図的だった』と言える物語は魅力的ですが、私たちの進路は数々の状況によって形成されていると信じています」と述べました。
人体を構成するおよそ37兆の細胞にも同じことが言えます。それぞれの細胞は独自の特性と役割を持ち、一生の間に受ける外部からの力(近隣の細胞からの持続的な力の相互作用も含む)によって形成される部分があります。アルーシン博士は、この未解明の物理学的ダイナミクスが細胞内の骨格にどのような影響を与えているのかについて研究しています。
細胞骨格は、タンパク質フィラメントの複雑なネットワークであり、細胞の移動や形状変化、分子の輸送などに関与しています。アルーシン博士の研究によって、この分子メカニズムの基本的な事実が明らかになっただけでなく、生物の成長と発達、そして一部の癌が転移に利用する生体力学のダイナミクスが、癌の理解に向けて示唆をもたらしています。
作家から生化学者へ
メリーランド州ユニバーシティ・パークという小さなベッドタウン、ワシントンD.C.郊外で、一人っ子として成長した彼は、幼少から作家の夢を抱いていました。初めは小説に魅了され、毎年一度はジェイムズ・ジョイスの『ユリシーズ』を手に取り返すことを習慣としていました。彼の母親は公立学校でフランス語を教え、一方で父親は米国環境保護庁(EPA)で環境弁護士として勤務していました。
アルーシン博士の作家としての情熱は、コロンビア大学の学部1年次に有機化学の講義を受けた際に、新たな情熱へと変わりました。彼はそのとき、「分子の世界がこれまで経験したことのない神秘
ロックフェラー大学の構造生物物理学・メカノバイオロジー研究所の所長、グレゴリー・M・アルーシン(Gregory M. Alushin)博士は、自身の科学的キャリアについて、偶然ではなく、多くの経験を積み重ねてきた結果だと考えています。彼は、「『非常に意図的だった』と言える物語は魅力的ですが、私たちの進路は数々の状況によって形成されていると信じています」と述べました。
人体を構成するおよそ37兆の細胞にも同じことが言えます。それぞれの細胞は独自の特性と役割を持ち、一生の間に受ける外部からの力(近隣の細胞からの持続的な力の相互作用も含む)によって形成される部分があります。アルーシン博士は、この未解明の物理学的ダイナミクスが細胞内の骨格にどのような影響を与えているのかについて研究しています。
細胞骨格は、タンパク質フィラメントの複雑なネットワークであり、細胞の移動や形状変化、分子の輸送などに関与しています。アルーシン博士の研究によって、この分子メカニズムの基本的な事実が明らかになっただけでなく、生物の成長と発達、そして一部の癌が転移に利用する生体力学のダイナミクスが、癌の理解に向けて示唆をもたらしています。
作家から生化学者へ
メリーランド州ユニバーシティ・パークという小さなベッドタウン、ワシントンD.C.郊外で、一人っ子として成長した彼は、幼少から作家の夢を抱いていました。初めは小説に魅了され、毎年一度はジェイムズ・ジョイスの『ユリシーズ』を手に取り返すことを習慣としていました。彼の母親は公立学校でフランス語を教え、一方で父親は米国環境保護庁(EPA)で環境弁護士として勤務していました。
アルーシン博士の作家としての情熱は、コロンビア大学の学部1年次に有機化学の講義を受けた際に、新たな情熱へと変わりました。彼はそのとき、「分子の世界がこれまで経験したことのない神秘
バイオロジカル・ダイナミクス社、Electrophoresis誌でエクソソーム分離技術の革新的研究を発表
 2023年7月26日、バイオロジカル・ダイナミクス社は、早期疾患検出のためのエクソソーム分離技術のリーダーとして名高い組織である。同社は新たに、『Enhancement of Dielectrophoresis-Based Particle Collection from High Conducting Fluids Due to Partial Electrode Insulation(部分電極絶縁による高導電性流体からの誘電泳動に基づく粒子捕集の強化)』という論文をElectrophoresis誌に発表したことを発表した。この研究は、オレゴン健康科学大学(OHSU)との協力のもとで行われ、ナノスケール粒子によって運ばれるバイオマーカーの捕捉に関する革新的な洞察を提供している。
エクソソームは、細胞外小胞の一種であり、自然のプロセスによって細胞から血流中に放出される。これらの微小な構造物は、がんを含むさまざまな疾患に固有の細胞バイオマーカーを運ぶ役割を果たしている。しかしながら、エクソソームの分析や回収は、その微細さ、低濃度、そして浮力密度の低さといった特性からくる難しさによって制約されてきた。
Biological Dynamics社のCEO兼ディレクターであるポール・R・ビリングス医学博士は、この新たな研究について、「我々の革新的な技術の力をさらに示すものであり、血液中を巡るエクソソームの効果的な分離が実現され、それによって病気の早期発見に寄与する価値ある情報が提供される可能性が高まる」と述べた。この成果は、Biological Dynamics社のExoVeritaプラットフォームにおけるバイオマーカーの捕捉の進展を支え、医療分野における重要な前進として注目されている。
バイオロジカル・ダイナミクス社は、独自のラボオンチップ・プラットフォームを通じて、AC
2023年7月26日、バイオロジカル・ダイナミクス社は、早期疾患検出のためのエクソソーム分離技術のリーダーとして名高い組織である。同社は新たに、『Enhancement of Dielectrophoresis-Based Particle Collection from High Conducting Fluids Due to Partial Electrode Insulation(部分電極絶縁による高導電性流体からの誘電泳動に基づく粒子捕集の強化)』という論文をElectrophoresis誌に発表したことを発表した。この研究は、オレゴン健康科学大学(OHSU)との協力のもとで行われ、ナノスケール粒子によって運ばれるバイオマーカーの捕捉に関する革新的な洞察を提供している。
エクソソームは、細胞外小胞の一種であり、自然のプロセスによって細胞から血流中に放出される。これらの微小な構造物は、がんを含むさまざまな疾患に固有の細胞バイオマーカーを運ぶ役割を果たしている。しかしながら、エクソソームの分析や回収は、その微細さ、低濃度、そして浮力密度の低さといった特性からくる難しさによって制約されてきた。
Biological Dynamics社のCEO兼ディレクターであるポール・R・ビリングス医学博士は、この新たな研究について、「我々の革新的な技術の力をさらに示すものであり、血液中を巡るエクソソームの効果的な分離が実現され、それによって病気の早期発見に寄与する価値ある情報が提供される可能性が高まる」と述べた。この成果は、Biological Dynamics社のExoVeritaプラットフォームにおけるバイオマーカーの捕捉の進展を支え、医療分野における重要な前進として注目されている。
バイオロジカル・ダイナミクス社は、独自のラボオンチップ・プラットフォームを通じて、AC
ヒトのリボソーム組み立て、ロックフェラー大学の研究で新知見
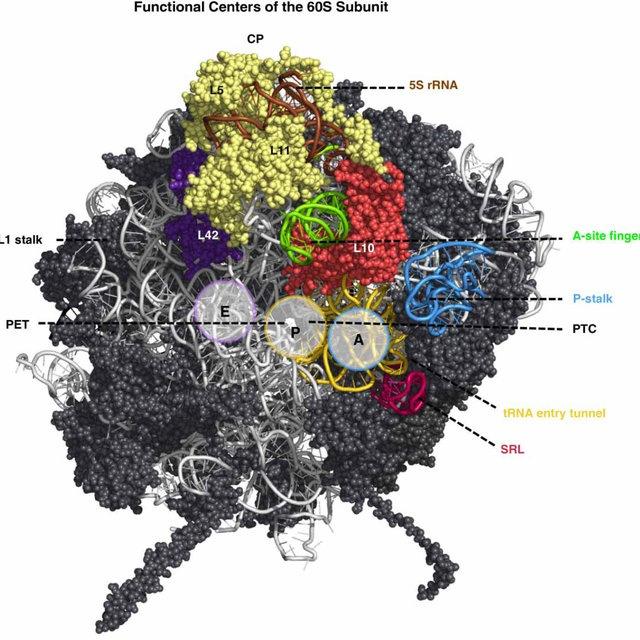 ヒトのリボソーム組み立ての重要な一環が、ロックフェラー大学のセバスチャン・クリンゲ(Sebastian Klinge)博士とその研究チームによって発表されました。生命の最も基本的な構成要素であるリボソームは、遺伝情報をタンパク質に変換する過程で不可欠な役割を果たしています。地球上のあらゆる細胞は、生物が正常に機能するために必要なタンパク質を合成するために、リボソームを利用しています。しかしながら、そのリボソームが具体的にどのように組み立てられているかは、長らく謎に包まれていました。
2023年7月7日、科学誌『サイエンス』で発表されたこの論文のタイトルは「Principles of Human Pre-60S Biogenesis(ヒト60S前生成の原理)」です。
新たに明らかになった研究成果によれば、ヒトの大型リボソーム・サブユニットの高解像度画像が得られたことで、その組み立て過程に関する重要な情報が明らかにされました。ロックフェラー大学のセバスチャン・クリンゲ博士によれば、「我々は現在、ヒトの大型リボソームサブユニットがどのように組み立てられるかについて、かなり良い考えを得ています」と述べています。
この発見によって、生命の基本的なプロセスであるリボソームの組み立てに関する理解が進展しました。ヒト細胞内でのこのプロセスがいかにして行われているかに関する知見は、今後の医学や生命科学の分野において重要な示唆を与えるものとなるでしょう。
ラージサブユニットを解く
1940年代、リボソームの発見から約70年が経過した。これは、メッセンジャーRNAの解読を担う40Sと呼ばれる小さなサブユニット、およびタンパク質の断片を結合させる60Sの大きなサブユニットから成る生命の基本的な構造だ。しかしながら、これは単なる大まかな説明に過ぎない。これらの複雑な分子が成熟した形に組
ヒトのリボソーム組み立ての重要な一環が、ロックフェラー大学のセバスチャン・クリンゲ(Sebastian Klinge)博士とその研究チームによって発表されました。生命の最も基本的な構成要素であるリボソームは、遺伝情報をタンパク質に変換する過程で不可欠な役割を果たしています。地球上のあらゆる細胞は、生物が正常に機能するために必要なタンパク質を合成するために、リボソームを利用しています。しかしながら、そのリボソームが具体的にどのように組み立てられているかは、長らく謎に包まれていました。
2023年7月7日、科学誌『サイエンス』で発表されたこの論文のタイトルは「Principles of Human Pre-60S Biogenesis(ヒト60S前生成の原理)」です。
新たに明らかになった研究成果によれば、ヒトの大型リボソーム・サブユニットの高解像度画像が得られたことで、その組み立て過程に関する重要な情報が明らかにされました。ロックフェラー大学のセバスチャン・クリンゲ博士によれば、「我々は現在、ヒトの大型リボソームサブユニットがどのように組み立てられるかについて、かなり良い考えを得ています」と述べています。
この発見によって、生命の基本的なプロセスであるリボソームの組み立てに関する理解が進展しました。ヒト細胞内でのこのプロセスがいかにして行われているかに関する知見は、今後の医学や生命科学の分野において重要な示唆を与えるものとなるでしょう。
ラージサブユニットを解く
1940年代、リボソームの発見から約70年が経過した。これは、メッセンジャーRNAの解読を担う40Sと呼ばれる小さなサブユニット、およびタンパク質の断片を結合させる60Sの大きなサブユニットから成る生命の基本的な構造だ。しかしながら、これは単なる大まかな説明に過ぎない。これらの複雑な分子が成熟した形に組
ウエストナイル感染での致命的症状、抗インターフェロン自己抗体が影響
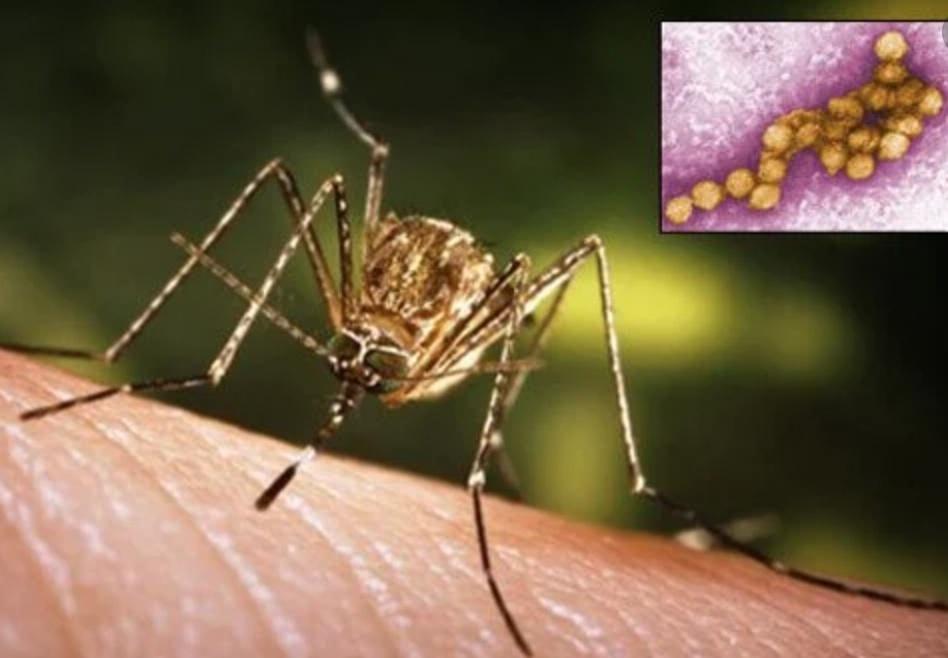 蚊を通じて広がる西ナイル・ウイルス(WNV)の感染者のうち、5人中4人は自身の感染に気づかないという報告がされている。この病気に対するワクチンや治療薬の存在しない現状を考えれば、心強い知らせと言えるだろう。特に、感染者の約1%が脳炎を発症し、その結果脳の炎症を引き起こし、入院を要するケースもある。こうした患者の内、最大20%が命を落としてしまう。この限られた人々が如何に脆弱であるか、その背後には何があるのだろうか?ニューヨークのロックフェラー大学からジャン=ローラン・カサノバ医学博士と、イタリアのパヴィアにあるサン・マッテオ研究病院のアレッサンドロ・ボルゲッシ医学博士を含む国際的な研究チームが、この謎に迫るための成果を発表した。
2023年6月22日に発表されたJournal of Experimental Medicine誌の記事によれば、科学者たちはWNVに感染した患者の約35%に、ウイルスに対抗するためのシグナル伝達タンパク質である1型インターフェロンを中和する自己抗体が存在することを突き止めた。特に脳炎を発症した患者において、その割合は最も高く、約40%の患者がこの自己抗体を保有していた。論文のタイトルは「Autoantibodies Neutralizing Type I IFNs Underlie West Nile Virus Encephalitis in ∼40% of Patients(I型IFNを中和する自己抗体がウエストナイルウイルス脳炎患者の約40%に認められる)」である。
西ナイルウイルスは、インフルエンザ(5%)、COVID-19(15%)、MERS肺炎(25%)など、インターフェロン中和自己抗体が重要な役割を果たす症例と関連があることが示され、小さなながらも重要な感染症のグループに加わったことが明らかになった。
しかし、ウエストナイ
蚊を通じて広がる西ナイル・ウイルス(WNV)の感染者のうち、5人中4人は自身の感染に気づかないという報告がされている。この病気に対するワクチンや治療薬の存在しない現状を考えれば、心強い知らせと言えるだろう。特に、感染者の約1%が脳炎を発症し、その結果脳の炎症を引き起こし、入院を要するケースもある。こうした患者の内、最大20%が命を落としてしまう。この限られた人々が如何に脆弱であるか、その背後には何があるのだろうか?ニューヨークのロックフェラー大学からジャン=ローラン・カサノバ医学博士と、イタリアのパヴィアにあるサン・マッテオ研究病院のアレッサンドロ・ボルゲッシ医学博士を含む国際的な研究チームが、この謎に迫るための成果を発表した。
2023年6月22日に発表されたJournal of Experimental Medicine誌の記事によれば、科学者たちはWNVに感染した患者の約35%に、ウイルスに対抗するためのシグナル伝達タンパク質である1型インターフェロンを中和する自己抗体が存在することを突き止めた。特に脳炎を発症した患者において、その割合は最も高く、約40%の患者がこの自己抗体を保有していた。論文のタイトルは「Autoantibodies Neutralizing Type I IFNs Underlie West Nile Virus Encephalitis in ∼40% of Patients(I型IFNを中和する自己抗体がウエストナイルウイルス脳炎患者の約40%に認められる)」である。
西ナイルウイルスは、インフルエンザ(5%)、COVID-19(15%)、MERS肺炎(25%)など、インターフェロン中和自己抗体が重要な役割を果たす症例と関連があることが示され、小さなながらも重要な感染症のグループに加わったことが明らかになった。
しかし、ウエストナイ
ドイツ神経変性疾患センターの研究者が「レメディオス・カロ・アルメラ賞」を受賞 | 神経細胞研究の優れた成果
 ドイツ神経変性疾患センター(DZNE)の上級研究員であり、ボン大学の教授である神経生物学者、フランク・ブラッドケ(Frank Bradke)博士(写真)が、顕著な業績を称えられる「レメディオス・カロ・アルメラ賞」の受賞者に輝きました。この賞は、神経細胞の成長と再生に関する画期的な研究を認め、その功績をたたえるものです。アワードの授与式は、11月にスペインのアリカンテで行われる予定です。
ブラッドケ博士と彼のチームは、2011年以来、DZNEにおいて神経細胞の発生初期の成長メカニズムの解明と、成人の中枢神経系細胞の再生能力の研究に取り組んできました。特に、軸索として知られる神経細胞の伸長部の成長に関する画期的な発見を達成しました。この軸索は、脊髄損傷やそれによる麻痺の治療において極めて重要な役割を果たす一方で、自己再生能力が限られているため、その研究成果は医学的治療法の基盤を形成する一助となり得るものです。
ブラッドケ博士は、「この受賞にとても興奮しています。私の科学的な同僚たちが過去にこの賞を授与された事実に触れ、その一員として選出していただいた審査員に深い感謝の意を表します。この賞は、私たちの研究チームの成果が高く評価されたことを示しており、その過程で博士課程の学生、ポスドク研究員、テクニシャンといった多彩なバックグラウンドを持つ研究メンバーが、個々の専門性と視点を活かして共同研究に貢献してくれた結果だと考えています。彼らの成果がこの賞に称えられることは、私にとって大きな喜びです。」
ピエルギ・ニコテラ(Pierlugi Nicotera)教授は、DZNEのサイエンティフィック・ディレクターおよび理事長として、ブラッドケ博士の受賞について言及し、「フランク・ブラッドケ博士は、再生神経生物学の分野で国際的に認められた第一人者であり、彼の長年にわたる画期的な研究成果
ドイツ神経変性疾患センター(DZNE)の上級研究員であり、ボン大学の教授である神経生物学者、フランク・ブラッドケ(Frank Bradke)博士(写真)が、顕著な業績を称えられる「レメディオス・カロ・アルメラ賞」の受賞者に輝きました。この賞は、神経細胞の成長と再生に関する画期的な研究を認め、その功績をたたえるものです。アワードの授与式は、11月にスペインのアリカンテで行われる予定です。
ブラッドケ博士と彼のチームは、2011年以来、DZNEにおいて神経細胞の発生初期の成長メカニズムの解明と、成人の中枢神経系細胞の再生能力の研究に取り組んできました。特に、軸索として知られる神経細胞の伸長部の成長に関する画期的な発見を達成しました。この軸索は、脊髄損傷やそれによる麻痺の治療において極めて重要な役割を果たす一方で、自己再生能力が限られているため、その研究成果は医学的治療法の基盤を形成する一助となり得るものです。
ブラッドケ博士は、「この受賞にとても興奮しています。私の科学的な同僚たちが過去にこの賞を授与された事実に触れ、その一員として選出していただいた審査員に深い感謝の意を表します。この賞は、私たちの研究チームの成果が高く評価されたことを示しており、その過程で博士課程の学生、ポスドク研究員、テクニシャンといった多彩なバックグラウンドを持つ研究メンバーが、個々の専門性と視点を活かして共同研究に貢献してくれた結果だと考えています。彼らの成果がこの賞に称えられることは、私にとって大きな喜びです。」
ピエルギ・ニコテラ(Pierlugi Nicotera)教授は、DZNEのサイエンティフィック・ディレクターおよび理事長として、ブラッドケ博士の受賞について言及し、「フランク・ブラッドケ博士は、再生神経生物学の分野で国際的に認められた第一人者であり、彼の長年にわたる画期的な研究成果
エスプレッソコーヒー愛好家注目:アルツハイマー病タンパク質の凝集を防ぐことが判明
 アメリカ人の約半数が毎日コーヒーを飲んでおり、エスプレッソは人気のある摂取方法です。エスプレッソを "抽出"するには、細かく挽いたコーヒー豆にお湯を通し、濃縮されたエキスを作ります。これは、流行のエスプレッソ・マティーニなど、他の飲み物のベースとしてもよく使われます。しかしエスプレッソは目を覚ますだけでなく、別の効果ももたらすかもしれません。2023年7月19日、アメリカ化学会のJournal of Agricultural and Food Chemistry誌にて公開された最新研究によれば、エスプレッソ中の化合物がアルツハイマー病の原因とされるタウタンパク質の凝集を抑制する可能性が示唆されました。
「Espresso Coffee Mitigates the Aggregation and Condensation of Alzheimer′s Associated Tau Protein(エスプレッソコーヒーはアルツハイマー病関連タウタンパク質の凝集と凝縮を抑制する。)」と題された、オープンアクセス論文が、この研究の成果を明らかにしています。
最新の研究はコーヒーがアルツハイマー病を含む神経変性疾患に対しても、一定の効果を発揮する可能性があることを示唆しています。これらの疾患の正確なメカニズムはまだ解明されていませんが、タウというタンパク質が疾患の進行において重要な役割を果たしていると考えられています。通常、健康な人々では、タウ蛋白質は脳内の構造を保持する役割を果たしていますが、特定の疾患が進行すると、この蛋白質は線維状に凝集してしまいます。一部の研究者は、この凝集を阻止することで症状を和らげる可能性があると考えています。このため、ヴェローナ大学のマリアピナ・ドノフリオ(Mariapina D’Onofrio)博士らは、エスプレッソに含まれる化合物がin vi
アメリカ人の約半数が毎日コーヒーを飲んでおり、エスプレッソは人気のある摂取方法です。エスプレッソを "抽出"するには、細かく挽いたコーヒー豆にお湯を通し、濃縮されたエキスを作ります。これは、流行のエスプレッソ・マティーニなど、他の飲み物のベースとしてもよく使われます。しかしエスプレッソは目を覚ますだけでなく、別の効果ももたらすかもしれません。2023年7月19日、アメリカ化学会のJournal of Agricultural and Food Chemistry誌にて公開された最新研究によれば、エスプレッソ中の化合物がアルツハイマー病の原因とされるタウタンパク質の凝集を抑制する可能性が示唆されました。
「Espresso Coffee Mitigates the Aggregation and Condensation of Alzheimer′s Associated Tau Protein(エスプレッソコーヒーはアルツハイマー病関連タウタンパク質の凝集と凝縮を抑制する。)」と題された、オープンアクセス論文が、この研究の成果を明らかにしています。
最新の研究はコーヒーがアルツハイマー病を含む神経変性疾患に対しても、一定の効果を発揮する可能性があることを示唆しています。これらの疾患の正確なメカニズムはまだ解明されていませんが、タウというタンパク質が疾患の進行において重要な役割を果たしていると考えられています。通常、健康な人々では、タウ蛋白質は脳内の構造を保持する役割を果たしていますが、特定の疾患が進行すると、この蛋白質は線維状に凝集してしまいます。一部の研究者は、この凝集を阻止することで症状を和らげる可能性があると考えています。このため、ヴェローナ大学のマリアピナ・ドノフリオ(Mariapina D’Onofrio)博士らは、エスプレッソに含まれる化合物がin vi
相対性理論から脳科学へ:時間認識の秘密に迫る最新研究
 アリストテレスの時の本質に関する研究から、アルベルト・アインシュタインの相対性理論の到達まで、人類は長い間「時間の捉え方と理解」に思索を傾けてきました。相対性理論は時間の伸縮性を前提としており、宇宙が時間をねじるように、私たちの神経回路も主観的な時間体験を歪ませる可能性があります。アインシュタインの言葉によれば、「熱いストーブの上で1分待つと、1時間のように感じられる。しかし愛らしい少女と1時間過ごすと、1分のように思われる」。2023年7月13日付の『ネイチャー・ニューロサイエンス』誌に掲載されたシャンパリモー研究所のラーニング・ラボの新研究は、ラットの神経活動パターンを意図的に加速または遅延させることで、時間の長さの認識が変わり、脳内の時計メカニズムが行動に影響を及ぼすメカニズムを明確にした画期的な証拠を提示しています。
「Using Temperature To Analyze the Neural Basis of a Time-Based Decision(温度を用いた時間ベースの判断の神経基盤分析)」と題されたこの論文が、その成果を示しています。
私たちの生体リズムを支配し、睡眠から代謝に至るまで、日常生活を形作る24時間の循環リズムとは対照的に、体内は秒から分という短時間スケールで時間を計測している方法については、あまり知られていない部分があります。この研究は、交差点で信号待ちをする瞬間やテニスボールをサーブする瞬間など、私たちの行動の多くが数秒から数分の時間スケールで進行していることに焦点を当てています。
人口時計仮説
私たちの脳は、コンピュータの精密な時計とは異なり、分散的で柔軟な時間感覚を保持しています。この「集団時計」仮説によれば、私たちの脳は、行動中にニューロンのグループが示す一貫した活動パターンに頼って時間を認識しているとされています。
アリストテレスの時の本質に関する研究から、アルベルト・アインシュタインの相対性理論の到達まで、人類は長い間「時間の捉え方と理解」に思索を傾けてきました。相対性理論は時間の伸縮性を前提としており、宇宙が時間をねじるように、私たちの神経回路も主観的な時間体験を歪ませる可能性があります。アインシュタインの言葉によれば、「熱いストーブの上で1分待つと、1時間のように感じられる。しかし愛らしい少女と1時間過ごすと、1分のように思われる」。2023年7月13日付の『ネイチャー・ニューロサイエンス』誌に掲載されたシャンパリモー研究所のラーニング・ラボの新研究は、ラットの神経活動パターンを意図的に加速または遅延させることで、時間の長さの認識が変わり、脳内の時計メカニズムが行動に影響を及ぼすメカニズムを明確にした画期的な証拠を提示しています。
「Using Temperature To Analyze the Neural Basis of a Time-Based Decision(温度を用いた時間ベースの判断の神経基盤分析)」と題されたこの論文が、その成果を示しています。
私たちの生体リズムを支配し、睡眠から代謝に至るまで、日常生活を形作る24時間の循環リズムとは対照的に、体内は秒から分という短時間スケールで時間を計測している方法については、あまり知られていない部分があります。この研究は、交差点で信号待ちをする瞬間やテニスボールをサーブする瞬間など、私たちの行動の多くが数秒から数分の時間スケールで進行していることに焦点を当てています。
人口時計仮説
私たちの脳は、コンピュータの精密な時計とは異なり、分散的で柔軟な時間感覚を保持しています。この「集団時計」仮説によれば、私たちの脳は、行動中にニューロンのグループが示す一貫した活動パターンに頼って時間を認識しているとされています。
再生医療におけるブレークスルー:ビクトリア大学の研究チームがin situバイオプリンティングの最新研究成果を報告
 最近の研究によれば、生体適合性のある構造や組織を体内で直接3Dプリントするin situバイオプリンティングが急速に進化しています。研究チームは新たなハンドヘルド型バイオプリンターを開発し、これまでの設計上の主な課題、すなわち複数の材料をプリントする能力とプリントした組織の物理化学的特性を制御する能力に対処しています。この革新的な装置は、再生医療、医薬品開発、試験、カスタムメイドの装具や義肢装具など、多岐にわたる応用分野において非常に有望です。これにより、さまざまな医療や健康関連の分野で革新的な進展が期待されます。この成果を発表した論文は、「Biofabrication」誌の2023年7月号に掲載されました。論文のタイトルは「A Handheld Bioprinter for Multi-Material Printing of Complex Constructs(複雑な構築物のマルチマテリアル印刷のためのハンドヘルド・バイオプリンター)」です。
再生医療の進展は、損傷した組織や臓器の置換、修復、再生によって、世界中の患者たちの生活に実質的な改善をもたらしています。再生医療は、臓器提供者不足や移植に伴うリスクといった課題に対する有望な解決策として注目されています。特に、3Dプリンティング技術の進歩により、in situバイオプリンティングという手法が登場しました。これは、人体内で組織や臓器を直接合成する方法を指し、欠陥のある組織や臓器の修復・再生を促進する可能性を秘めています。
しかし、この分野にはまだ課題も存在します。現在使用されているin situバイオプリンティング技術には制約があります。例えば、特定の種類のバイオインクにしか適合しない装置や、一度に小さな組織のパッチしか作れない装置も存在します。また、装置の設計は通常複雑であり、手が出しづらく応用が制限され
最近の研究によれば、生体適合性のある構造や組織を体内で直接3Dプリントするin situバイオプリンティングが急速に進化しています。研究チームは新たなハンドヘルド型バイオプリンターを開発し、これまでの設計上の主な課題、すなわち複数の材料をプリントする能力とプリントした組織の物理化学的特性を制御する能力に対処しています。この革新的な装置は、再生医療、医薬品開発、試験、カスタムメイドの装具や義肢装具など、多岐にわたる応用分野において非常に有望です。これにより、さまざまな医療や健康関連の分野で革新的な進展が期待されます。この成果を発表した論文は、「Biofabrication」誌の2023年7月号に掲載されました。論文のタイトルは「A Handheld Bioprinter for Multi-Material Printing of Complex Constructs(複雑な構築物のマルチマテリアル印刷のためのハンドヘルド・バイオプリンター)」です。
再生医療の進展は、損傷した組織や臓器の置換、修復、再生によって、世界中の患者たちの生活に実質的な改善をもたらしています。再生医療は、臓器提供者不足や移植に伴うリスクといった課題に対する有望な解決策として注目されています。特に、3Dプリンティング技術の進歩により、in situバイオプリンティングという手法が登場しました。これは、人体内で組織や臓器を直接合成する方法を指し、欠陥のある組織や臓器の修復・再生を促進する可能性を秘めています。
しかし、この分野にはまだ課題も存在します。現在使用されているin situバイオプリンティング技術には制約があります。例えば、特定の種類のバイオインクにしか適合しない装置や、一度に小さな組織のパッチしか作れない装置も存在します。また、装置の設計は通常複雑であり、手が出しづらく応用が制限され
手術中に脳腫瘍のDNA解読可能なAIツール:最新研究結果が学術誌に掲載
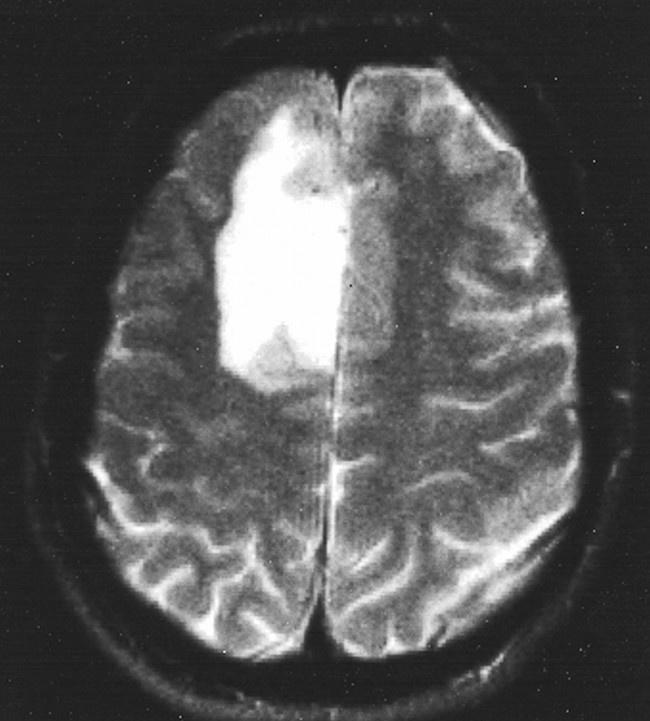 2023年7月7日付の学術誌『Med』によれば、ハーバード大学医学部(HMS)の研究者たちは、AIツールを開発し、手術中に脳腫瘍のDNAを迅速に解読し、その分子的特性を特定することができると報告している。この研究によれば、脳神経外科医は腫瘍の分子タイプを把握することで、手術中に患者の脳組織をどの程度切除するかや、脳に直接薬剤を投与するかなどの決定を下すことができるという。
この論文のタイトルは「Machine Learning for Cryosection Pathology Predicts the 2021 WHO Classification of Glioma(神経膠腫の2021年WHO分類を予測する凍結切片病理学の機械学習)」です。
手術中の正確な分子診断は、脳神経外科医が脳組織の除去範囲を決定する際に非常に有用であると述べられています。腫瘍の侵襲性が低い場合には過剰に切除することで、患者の神経学的および認知機能に影響を与える可能性がある一方、悪性度が高い場合には摘出量が不十分で、急速に増殖・転移する悪性組織が残る可能性が指摘されています。
HMSのBlavatnik研究所の生物医学情報学助教授であるユー・クンシン(Kun-Hsing Yu)博士(研究主任著者)は、「今のところ、手術中に腫瘍を分子レベルでプロファイリングすることはできません。我々のツールは、凍結病理スライドからこれまで利用されていなかった生物医学的シグナルを抽出することで、この課題を克服しています」と述べています。
特定の腫瘍に関しては、手術時に脳に直接薬剤を塗布したウエハーを使用する治療法が有効であるとされています。
ユー博士は「手術中にリアルタイムで術中の分子診断を決定する能力は、リアルタイムのプレシジョン・オンコロジーの発展を推進することができます」と述べています。
従来の
2023年7月7日付の学術誌『Med』によれば、ハーバード大学医学部(HMS)の研究者たちは、AIツールを開発し、手術中に脳腫瘍のDNAを迅速に解読し、その分子的特性を特定することができると報告している。この研究によれば、脳神経外科医は腫瘍の分子タイプを把握することで、手術中に患者の脳組織をどの程度切除するかや、脳に直接薬剤を投与するかなどの決定を下すことができるという。
この論文のタイトルは「Machine Learning for Cryosection Pathology Predicts the 2021 WHO Classification of Glioma(神経膠腫の2021年WHO分類を予測する凍結切片病理学の機械学習)」です。
手術中の正確な分子診断は、脳神経外科医が脳組織の除去範囲を決定する際に非常に有用であると述べられています。腫瘍の侵襲性が低い場合には過剰に切除することで、患者の神経学的および認知機能に影響を与える可能性がある一方、悪性度が高い場合には摘出量が不十分で、急速に増殖・転移する悪性組織が残る可能性が指摘されています。
HMSのBlavatnik研究所の生物医学情報学助教授であるユー・クンシン(Kun-Hsing Yu)博士(研究主任著者)は、「今のところ、手術中に腫瘍を分子レベルでプロファイリングすることはできません。我々のツールは、凍結病理スライドからこれまで利用されていなかった生物医学的シグナルを抽出することで、この課題を克服しています」と述べています。
特定の腫瘍に関しては、手術時に脳に直接薬剤を塗布したウエハーを使用する治療法が有効であるとされています。
ユー博士は「手術中にリアルタイムで術中の分子診断を決定する能力は、リアルタイムのプレシジョン・オンコロジーの発展を推進することができます」と述べています。
従来の
ALS治療に新展望:磁場介入で運動ニューロン回復を実証!
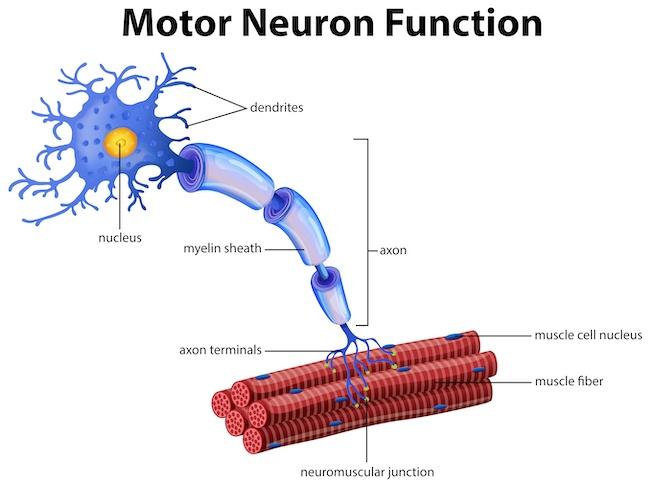 健康な人の運動ニューロンは、骨格筋に精密な信号を送っています。ところが、筋萎縮性側索硬化症(ALS)は、運動ニューロンに深刻な損傷を与え、信号の伝達を阻害する神経変性疾患として知られています。この病気は現在、治療法がなく不治の病とされています。ALSにより、筋肉は指令を受け取れなくなり、次第に衰弱していきます。この重要な課題に挑戦するため、ヘルムホルツ・ツェントラム・ドレスデン・ローゼンドルフ(HZDR)所属の物理学者、トーマス・ヘルマンスドルファー(Thomas Herrmannsdörfer)博士と細胞生物学者のアルン・パル(Arun Pal)博士、そして医師であるリチャード・ファンク(Richard Funk)教授が指導する学際的な研究チームが、磁場の介入によって損傷を受けた運動ニューロンの回復を実証する細胞実験に成功しました。これは、神経変性疾患の治療に新たな展望をもたらす可能性を秘めた画期的な治療法の基礎となるかもしれません。この成果は、Cell誌 に掲載されています。
ALSは不治の運動ニューロン疾患であり、一般的に診断後2〜5年で患者の命を奪います。現在までに、この病気に対する効果的な治療法は見つかっていません。
HZDRドレスデン強磁場研究所(HLD)の部門長であるトーマス・ハーマンスドルファー博士は、医師であるリチャード・ファンク医学博士と緊密に連携しています。彼らは、ドレスデン大学とロストック大学の仲間と共に、物理学、医学、生物学、バイオテクノロジーの分野からの研究者を集め、損傷を受けた運動ニューロンに対する磁場治療の効果を研究しています。このプロジェクトにはHZDRの放射性医薬品がん研究センター(ZRT)も参加しています。
有望なIn Vitro試験
パル博士は、「一連の実験で、ALS患者の運動ニューロンが磁場の刺激に反応し、障害を受けたミ
健康な人の運動ニューロンは、骨格筋に精密な信号を送っています。ところが、筋萎縮性側索硬化症(ALS)は、運動ニューロンに深刻な損傷を与え、信号の伝達を阻害する神経変性疾患として知られています。この病気は現在、治療法がなく不治の病とされています。ALSにより、筋肉は指令を受け取れなくなり、次第に衰弱していきます。この重要な課題に挑戦するため、ヘルムホルツ・ツェントラム・ドレスデン・ローゼンドルフ(HZDR)所属の物理学者、トーマス・ヘルマンスドルファー(Thomas Herrmannsdörfer)博士と細胞生物学者のアルン・パル(Arun Pal)博士、そして医師であるリチャード・ファンク(Richard Funk)教授が指導する学際的な研究チームが、磁場の介入によって損傷を受けた運動ニューロンの回復を実証する細胞実験に成功しました。これは、神経変性疾患の治療に新たな展望をもたらす可能性を秘めた画期的な治療法の基礎となるかもしれません。この成果は、Cell誌 に掲載されています。
ALSは不治の運動ニューロン疾患であり、一般的に診断後2〜5年で患者の命を奪います。現在までに、この病気に対する効果的な治療法は見つかっていません。
HZDRドレスデン強磁場研究所(HLD)の部門長であるトーマス・ハーマンスドルファー博士は、医師であるリチャード・ファンク医学博士と緊密に連携しています。彼らは、ドレスデン大学とロストック大学の仲間と共に、物理学、医学、生物学、バイオテクノロジーの分野からの研究者を集め、損傷を受けた運動ニューロンに対する磁場治療の効果を研究しています。このプロジェクトにはHZDRの放射性医薬品がん研究センター(ZRT)も参加しています。
有望なIn Vitro試験
パル博士は、「一連の実験で、ALS患者の運動ニューロンが磁場の刺激に反応し、障害を受けたミ
幹細胞研究を一変させる"ビレッジ アプローチ":幹細胞研究が100倍効率化
 ガーバン医学研究所(オーストラリア、シドニー)によれば、彼らが開発した方法は、数百人からの幹細胞サンプルを同じ培養皿で研究する画期的な可能性を秘めています。これは個別化治療や複雑なヒト形質の研究にとって重要な意味を持ちます。幹細胞は多様な細胞に成長できるため、ヒト細胞を用いて病気の研究や薬剤テストが可能となります。しかしこのような研究には多くのドナーからのサンプルが必要であり、それが費用と時間の面で課題となってきました。こうした問題を解決する手法がガーバン・チームによって提案されたのです。
この革新的な手法、「皿の中のビレッジ」システムでは、多数のドナーから採取した幹細胞を同じ培養皿の中で同時に培養・研究することができます。これによって研究が加速され、研究の効率が100倍にも向上するとのことです。
ガーバン研究所の細胞科学部長であり、UNSW細胞ゲノム未来研究所(オーストラリア、シドニー、ニューサウスウェールズ大学)の所長であり、この研究の上級著者であるジョセフ・パウエル(Joseph Powell)教授は、「私たちはDNAの大部分を共有しているにもかかわらず、遺伝子の変異がユニークな形質や反応につながっています。このビレッジのシステムは、この多様性を大規模に捉え、人々の間の遺伝子の違いが、生物学や病気の根底にある複雑なメカニズムにどのように影響しているかを明らかにします」と述べています。
これまでの集団ゲノミクスの研究は、バルクRNAシーケンスという技術を用いて遺伝子発現を評価してきました。しかし、この方法では個々の細胞や細胞タイプの違いが隠れてしまい、遺伝子発現の見方が不完全であり、不正確な結論につながる可能性もあります。
この課題に対処するために、研究者らは複数のドナーから採取した幹細胞を1つのディッシュで培養し、シングルセルシーケンスという技術を用いて解
ガーバン医学研究所(オーストラリア、シドニー)によれば、彼らが開発した方法は、数百人からの幹細胞サンプルを同じ培養皿で研究する画期的な可能性を秘めています。これは個別化治療や複雑なヒト形質の研究にとって重要な意味を持ちます。幹細胞は多様な細胞に成長できるため、ヒト細胞を用いて病気の研究や薬剤テストが可能となります。しかしこのような研究には多くのドナーからのサンプルが必要であり、それが費用と時間の面で課題となってきました。こうした問題を解決する手法がガーバン・チームによって提案されたのです。
この革新的な手法、「皿の中のビレッジ」システムでは、多数のドナーから採取した幹細胞を同じ培養皿の中で同時に培養・研究することができます。これによって研究が加速され、研究の効率が100倍にも向上するとのことです。
ガーバン研究所の細胞科学部長であり、UNSW細胞ゲノム未来研究所(オーストラリア、シドニー、ニューサウスウェールズ大学)の所長であり、この研究の上級著者であるジョセフ・パウエル(Joseph Powell)教授は、「私たちはDNAの大部分を共有しているにもかかわらず、遺伝子の変異がユニークな形質や反応につながっています。このビレッジのシステムは、この多様性を大規模に捉え、人々の間の遺伝子の違いが、生物学や病気の根底にある複雑なメカニズムにどのように影響しているかを明らかにします」と述べています。
これまでの集団ゲノミクスの研究は、バルクRNAシーケンスという技術を用いて遺伝子発現を評価してきました。しかし、この方法では個々の細胞や細胞タイプの違いが隠れてしまい、遺伝子発現の見方が不完全であり、不正確な結論につながる可能性もあります。
この課題に対処するために、研究者らは複数のドナーから採取した幹細胞を1つのディッシュで培養し、シングルセルシーケンスという技術を用いて解
NYUアブダビの研究者らがCOVID-19重症度と関連するマイクロRNAを同定
 NYUアブダビのユセフ・イダグドゥール(Youssef Idaghdour)生物学准教授が率いる研究チームは、アブダビ在住のワクチン未接種のCOVID-19患者259人を対象に、遺伝子を制御する低分子RNAであるマイクロRNAとCOVID-19の重症度との関連について調査しました。この研究では、免疫反応の低下やICU入室と関連するマイクロRNAが特定されました。また、中東、北アフリカ(MENA)、南アジア地域におけるワクチン未接種COVID-19患者の血中マイクロRNAの構造に関する初のゲノム画像が作成されました。これはこれら地域において十分な研究が行われていなかったゲノム研究の重要な進展です。
研究者たちは、感染の初期段階におけるマイクロRNAの変化を特定しました。この変化が特定の血液形質や免疫細胞の死と関連しており、ウイルスが免疫系を回避して増殖する可能性を示唆しています。この遺伝学的研究結果は、患者の遺伝的体質が免疫機能と疾患の重症度に影響を及ぼすことを示しており、患者の予後と治療法の改善に向けた新たな知見を提供するものとなっています。
この成果は、サンプルの多様性を考慮して、MENA地域と南アジアに居住する世界人口の約30%に適用できると期待されています。
2023年6月12日、Human Genomics誌に掲載された「Systems Genetics Identifies miRNA-Mediated Regulation of Host Response in COVID-19(システム遺伝学がCOVID-19におけるmiRNAを介した宿主応答制御を特定)」と題する研究論文が、イダグドゥール博士率いる研究チームによって発表されました。この論文はオープンアクセスで提供されています。
この研究では、複数のオミックスデータセット(入院時の患者の遺伝子型、
NYUアブダビのユセフ・イダグドゥール(Youssef Idaghdour)生物学准教授が率いる研究チームは、アブダビ在住のワクチン未接種のCOVID-19患者259人を対象に、遺伝子を制御する低分子RNAであるマイクロRNAとCOVID-19の重症度との関連について調査しました。この研究では、免疫反応の低下やICU入室と関連するマイクロRNAが特定されました。また、中東、北アフリカ(MENA)、南アジア地域におけるワクチン未接種COVID-19患者の血中マイクロRNAの構造に関する初のゲノム画像が作成されました。これはこれら地域において十分な研究が行われていなかったゲノム研究の重要な進展です。
研究者たちは、感染の初期段階におけるマイクロRNAの変化を特定しました。この変化が特定の血液形質や免疫細胞の死と関連しており、ウイルスが免疫系を回避して増殖する可能性を示唆しています。この遺伝学的研究結果は、患者の遺伝的体質が免疫機能と疾患の重症度に影響を及ぼすことを示しており、患者の予後と治療法の改善に向けた新たな知見を提供するものとなっています。
この成果は、サンプルの多様性を考慮して、MENA地域と南アジアに居住する世界人口の約30%に適用できると期待されています。
2023年6月12日、Human Genomics誌に掲載された「Systems Genetics Identifies miRNA-Mediated Regulation of Host Response in COVID-19(システム遺伝学がCOVID-19におけるmiRNAを介した宿主応答制御を特定)」と題する研究論文が、イダグドゥール博士率いる研究チームによって発表されました。この論文はオープンアクセスで提供されています。
この研究では、複数のオミックスデータセット(入院時の患者の遺伝子型、
インフラマソーム免疫タンパク質CARD8が感染症検出に重要な役割を果たす可能性
 インフラマソームが、感染症が発生した際に私たちの身体が警報を発するための分子センサーの複雑なシステムを形成していることがわかっています。しかしながら、侵入してくる病原体などの脅威に対して応答を開始するこれらのセンサーの背後にあるメカニズムや、その作動方法は、免疫学者にとって興味の尽きない分野でした。この度、カリフォルニア大学サンディエゴ校の生物学者が、免疫系が特定のウイルスを検出する、これまで知られていなかった方法について発表しました。発表によれば、SARS-Cov-2を含む様々なウイルスを検出するトリップワイヤーの役割を果たすインフラマソーム免疫タンパク質「CARD8」の特筆すべき存在です。
さらに、UCSD生物科学部のマシュー・ドーガティ(Matthew Daugherty)博士とワシントン大学およびUCバークレー校の研究者らは、CARD8の機能がさまざまな生物種で異なり、ヒトの個体間でも異なることを突き止めました。彼らはヒトの細胞株を用いた一連の実験と、哺乳類種におけるCARD8の遺伝的変異の解析を通じて、この知見を得ました。
これらの重要な研究結果は、オープンアクセス・ジャーナルPLOS Biology誌に2023年6月8日付けで掲載された論文に詳細に記載されています。論文のタイトルは 「Host-Specific Sensing of Coronaviruses and Picornaviruses by the CARD8 Inflammasome(CARD8によるコロナウイルスとピコルナウイルスの宿主特異的感知)」です。
CARD8のバージョンにおいて、私たちは興味深い発見をしました。あるヒトがたった一つの遺伝子の違いによって、コロナウイルス感染を感知する能力を失いつつも、ライノウイルス(風邪)やポリオウイルスを含む別のウイルスファミリーであるエンテ
インフラマソームが、感染症が発生した際に私たちの身体が警報を発するための分子センサーの複雑なシステムを形成していることがわかっています。しかしながら、侵入してくる病原体などの脅威に対して応答を開始するこれらのセンサーの背後にあるメカニズムや、その作動方法は、免疫学者にとって興味の尽きない分野でした。この度、カリフォルニア大学サンディエゴ校の生物学者が、免疫系が特定のウイルスを検出する、これまで知られていなかった方法について発表しました。発表によれば、SARS-Cov-2を含む様々なウイルスを検出するトリップワイヤーの役割を果たすインフラマソーム免疫タンパク質「CARD8」の特筆すべき存在です。
さらに、UCSD生物科学部のマシュー・ドーガティ(Matthew Daugherty)博士とワシントン大学およびUCバークレー校の研究者らは、CARD8の機能がさまざまな生物種で異なり、ヒトの個体間でも異なることを突き止めました。彼らはヒトの細胞株を用いた一連の実験と、哺乳類種におけるCARD8の遺伝的変異の解析を通じて、この知見を得ました。
これらの重要な研究結果は、オープンアクセス・ジャーナルPLOS Biology誌に2023年6月8日付けで掲載された論文に詳細に記載されています。論文のタイトルは 「Host-Specific Sensing of Coronaviruses and Picornaviruses by the CARD8 Inflammasome(CARD8によるコロナウイルスとピコルナウイルスの宿主特異的感知)」です。
CARD8のバージョンにおいて、私たちは興味深い発見をしました。あるヒトがたった一つの遺伝子の違いによって、コロナウイルス感染を感知する能力を失いつつも、ライノウイルス(風邪)やポリオウイルスを含む別のウイルスファミリーであるエンテ
ヒザラガイの目の秘密:国際チームが興味深い視覚能力に迫る研究を開始
 ヴァージニア工科大学(Virginia Tech)のリン・リー(Ling Li)博士率いる国際チームが、興味深い疑問を提起している。それは、ヒザラガイという水中生物が何千もの小さなアラゴナイトの目を持つことで、どんな世界観を持っているのかというものだ。
リー博士は、機械工学科の准教授であり、このユニークな生物の視覚能力に関する研究を率いるために、105万ドルの資金を3年間で授与された。彼のチームには、かつての共同研究者であるサウスカロライナ大学のダニエル・シュパイザー(Daniel Speiser)博士も含まれている。さらに、国際的に著名な応用数学者で画像処理に精通したズーゼ研究所(Zuse Institute Berlin)のダニエル・バウム(Daniel Baum)博士も専門知識を提供することになる。
石のような目は何を見、何を意味するのか
海洋生物であるヒザラガイの石のような目に注目した研究チームは、この生物の興味深い特性について探求しています。ヒザラガイは錠剤のような形状を持ち、硬い外殻と柔らかい内殻が重なり合って構成されています。この貝殻はアラゴナイトと呼ばれる炭酸カルシウムでできており、真珠の主成分の一つでもあります。ヒザラガイは周囲を観察するために、貝殻の装甲板に何千もの小さな石の目を埋め込んで使用しています。
ヒザラガイの視覚については、シュパイザー博士が早くから研究を進め、画像を見る能力についての考察を行ってきました。リー博士はマサチューセッツ工科大学(MIT)で博士号を取得後、ハーバード大学でのポスドク研究中にシュパイザー博士と共同研究者となり、彼の初期研究を発展させ、ヒザラガイの目がどのように機能するのかを追求しました。彼らはヒザラガイのアラゴナイトレンズを直接覗くことができる実験装置を開発し、ぼやけてはいるが認識可能な形を見ることができる
ヴァージニア工科大学(Virginia Tech)のリン・リー(Ling Li)博士率いる国際チームが、興味深い疑問を提起している。それは、ヒザラガイという水中生物が何千もの小さなアラゴナイトの目を持つことで、どんな世界観を持っているのかというものだ。
リー博士は、機械工学科の准教授であり、このユニークな生物の視覚能力に関する研究を率いるために、105万ドルの資金を3年間で授与された。彼のチームには、かつての共同研究者であるサウスカロライナ大学のダニエル・シュパイザー(Daniel Speiser)博士も含まれている。さらに、国際的に著名な応用数学者で画像処理に精通したズーゼ研究所(Zuse Institute Berlin)のダニエル・バウム(Daniel Baum)博士も専門知識を提供することになる。
石のような目は何を見、何を意味するのか
海洋生物であるヒザラガイの石のような目に注目した研究チームは、この生物の興味深い特性について探求しています。ヒザラガイは錠剤のような形状を持ち、硬い外殻と柔らかい内殻が重なり合って構成されています。この貝殻はアラゴナイトと呼ばれる炭酸カルシウムでできており、真珠の主成分の一つでもあります。ヒザラガイは周囲を観察するために、貝殻の装甲板に何千もの小さな石の目を埋め込んで使用しています。
ヒザラガイの視覚については、シュパイザー博士が早くから研究を進め、画像を見る能力についての考察を行ってきました。リー博士はマサチューセッツ工科大学(MIT)で博士号を取得後、ハーバード大学でのポスドク研究中にシュパイザー博士と共同研究者となり、彼の初期研究を発展させ、ヒザラガイの目がどのように機能するのかを追求しました。彼らはヒザラガイのアラゴナイトレンズを直接覗くことができる実験装置を開発し、ぼやけてはいるが認識可能な形を見ることができる
皮膚老化の新展開:IRBバルセロナとCNAGがIL-17に着目した研究を発表
 バルセロナの生物医学研究所(IRBバルセロナ)と国立ゲノム解析センター(CNAG)が共同で行った最新の研究によれば、皮膚の老化において、IL-17タンパク質が中心的な役割を果たしていることが明らかになりました。この研究は、IRBバルセロナのギオマール・ソラナス(Guiomar Solanas)博士とサルバドール・アズナール・ベニタ(Salvador Aznar Benitah)博士、CNAGのホルガー・ヘイン(Holger Heyn)博士が率いたもので、IL-17が老化に伴う炎症状態に関与していることが明らかにされました。
皮膚の老化は、加齢に伴う構造的・機能的な変化によって特徴づけられ、再生能力の低下、治癒能力の減少、バリア機能の低下などが見られます。この研究では、2023年6月8日に学術誌『Nature Aging』に掲載された論文によって、加齢とともに皮膚内の異なる細胞が経験する変化について詳細に説明されており、特に皮膚の免疫細胞の一部が高レベルでIL-17を発現していることが明らかにされました。このオープンアクセス論文のタイトルは 「Targeting Lymphoid-Derived IL-17 Signaling to Delay Skin Aging(リンパ球由来のIL-17シグナルを標的とした皮膚の老化遅延。) 」です。
ベニタ博士は、「我々の結果は、IL-17が老化に関連する多様な機能に影響を及ぼすことを示しています。このタンパク質の機能をブロックすることで、皮膚の老化に伴う欠陥の発生を遅らせることが観察されました。この発見により、例えば手術後の皮膚の回復を促進したり、いくつかの症状を治療するための新たな可能性が開けるでしょう」と述べています。
ヘイン博士もまた、「単一細胞のシークエンシングによって、皮膚を形成する細胞の種類と状態の複雑さ、そして
バルセロナの生物医学研究所(IRBバルセロナ)と国立ゲノム解析センター(CNAG)が共同で行った最新の研究によれば、皮膚の老化において、IL-17タンパク質が中心的な役割を果たしていることが明らかになりました。この研究は、IRBバルセロナのギオマール・ソラナス(Guiomar Solanas)博士とサルバドール・アズナール・ベニタ(Salvador Aznar Benitah)博士、CNAGのホルガー・ヘイン(Holger Heyn)博士が率いたもので、IL-17が老化に伴う炎症状態に関与していることが明らかにされました。
皮膚の老化は、加齢に伴う構造的・機能的な変化によって特徴づけられ、再生能力の低下、治癒能力の減少、バリア機能の低下などが見られます。この研究では、2023年6月8日に学術誌『Nature Aging』に掲載された論文によって、加齢とともに皮膚内の異なる細胞が経験する変化について詳細に説明されており、特に皮膚の免疫細胞の一部が高レベルでIL-17を発現していることが明らかにされました。このオープンアクセス論文のタイトルは 「Targeting Lymphoid-Derived IL-17 Signaling to Delay Skin Aging(リンパ球由来のIL-17シグナルを標的とした皮膚の老化遅延。) 」です。
ベニタ博士は、「我々の結果は、IL-17が老化に関連する多様な機能に影響を及ぼすことを示しています。このタンパク質の機能をブロックすることで、皮膚の老化に伴う欠陥の発生を遅らせることが観察されました。この発見により、例えば手術後の皮膚の回復を促進したり、いくつかの症状を治療するための新たな可能性が開けるでしょう」と述べています。
ヘイン博士もまた、「単一細胞のシークエンシングによって、皮膚を形成する細胞の種類と状態の複雑さ、そして
健康寿命を延ばす鍵はタウリン?コロンビア大学の革新的な発見
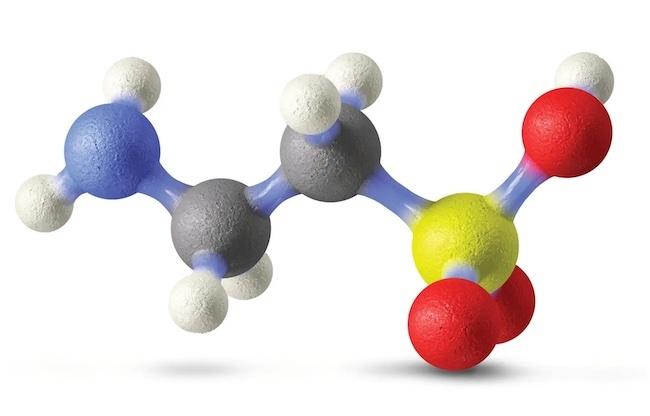 コロンビア大学の研究者が主導し、世界中の老化研究者数十人が参加した新たな研究によれば、体内で生成され、多くの食品に含まれる栄養素であるタウリンの欠乏が、動物の老化を促進することが明らかになりました。この注目すべき研究では、タウリンのサプリメントがミミズ、マウス、サルの老化プロセスを遅らせ、中年マウスの健康寿命を最大12%延ばす効果も見いだされました。これらの成果は、2023年6月8日に『サイエンス』誌にオープンアクセス論文として掲載されました。この論文のタイトルは 「Taurine Deficiency As a Driver of Aging(老化の促進因子としてのタウリン欠乏)」です。
この研究のリーダーであるコロンビア大学ヴァゲロス医師外科大学遺伝学・発生学助教授のヴィジャイ・ヤダヴ(Vijay Yadav)博士は、「過去25年間、科学者たちは、私たちを長生きさせるだけでなく、健康寿命(高齢になっても健康でいられる期間)を延ばす因子を見つけようとしてきました。この研究は、タウリンが私たちの中で、より長く、より健康に生きるための万能薬となり得ることを示唆しています」と述べています。
私たちの中にある抗老化分子
過去20年の間に、高齢期の健康を改善するための介入策を特定する取り組みは、人々の寿命が延び、科学者たちが老化プロセスを操作できる可能性を理解することによって、ますます進展しています。
数々の研究により、血流を介して運ばれるさまざまな分子が老化と密接な関連があることが明らかになりました。しかし、これらの分子が積極的に老化プロセスを導いているのか、あるいは単なる同乗者に過ぎないのか、その詳細はまだ完全に解明されていない部分もあります。もしもある特定の分子が老化を促進しているとすれば、その分子を若い頃のレベルに戻すことで、老化を遅らせ、健康寿命を延ばすことが
コロンビア大学の研究者が主導し、世界中の老化研究者数十人が参加した新たな研究によれば、体内で生成され、多くの食品に含まれる栄養素であるタウリンの欠乏が、動物の老化を促進することが明らかになりました。この注目すべき研究では、タウリンのサプリメントがミミズ、マウス、サルの老化プロセスを遅らせ、中年マウスの健康寿命を最大12%延ばす効果も見いだされました。これらの成果は、2023年6月8日に『サイエンス』誌にオープンアクセス論文として掲載されました。この論文のタイトルは 「Taurine Deficiency As a Driver of Aging(老化の促進因子としてのタウリン欠乏)」です。
この研究のリーダーであるコロンビア大学ヴァゲロス医師外科大学遺伝学・発生学助教授のヴィジャイ・ヤダヴ(Vijay Yadav)博士は、「過去25年間、科学者たちは、私たちを長生きさせるだけでなく、健康寿命(高齢になっても健康でいられる期間)を延ばす因子を見つけようとしてきました。この研究は、タウリンが私たちの中で、より長く、より健康に生きるための万能薬となり得ることを示唆しています」と述べています。
私たちの中にある抗老化分子
過去20年の間に、高齢期の健康を改善するための介入策を特定する取り組みは、人々の寿命が延び、科学者たちが老化プロセスを操作できる可能性を理解することによって、ますます進展しています。
数々の研究により、血流を介して運ばれるさまざまな分子が老化と密接な関連があることが明らかになりました。しかし、これらの分子が積極的に老化プロセスを導いているのか、あるいは単なる同乗者に過ぎないのか、その詳細はまだ完全に解明されていない部分もあります。もしもある特定の分子が老化を促進しているとすれば、その分子を若い頃のレベルに戻すことで、老化を遅らせ、健康寿命を延ばすことが
タコのRNA編集:環境適応の鍵となる驚きの発見
 タコと近縁種は、DNAにコード化された限られた命令セットを有していますが、生命は予測不可能であり、状況が変わると動物は適応する柔軟性が必要とされます。海洋生物学研究所(MBL)のジョシュア・ローゼンタール(Joshua Rosenthal)博士とテルアビブ大学のイーライ・アイゼンバーグ(Eli Eisenberg)博士が率いる新たな研究によれば、タコとその仲間たちは、環境の厳しい条件にエレガントに適応するために、RNAと呼ばれるDNAの指令を伝える中間分子に手を加えるという方法を用いていることがわかりました。
ローゼンタール博士らは、2023年6月8日付の『Cell』誌に掲載された最新の研究で、タコ、イカ、イカ類(頭足類として知られている)が寒冷な水に遭遇すると、RNAの編集が非常に活発になることを報告しています。この研究により、タコの水槽を冷却した後、研究チームは動物の神経系にある13,000以上のRNA部位で、タンパク質の活性を変化させるRNA編集の増加を確認しました。その中には、RNA分子のコードのわずかな変化で、神経細胞が生成するタンパク質の機能が大きく変わる例もありました。Cell誌に掲載された論文のタイトルは、「Temperature-Dependent RNA Editing in Octopus Extensively Recodes the Neural Proteome(タコの温度依存性RNA編集が神経プロテオームを広範囲に再コード化する)」です。
MBLの上級科学者であるローゼンタール博士によれば、RNA編集を通じて、頭足類は独自の生理機能を微調整するユニークな方法を見つけたとのことです。
「我々は、すべての生物が生まれながらにして一定の命令にプログラムされていると考えることが一般的ですが、頭足類の研究を通じて、環境が遺伝情報に影響を与えると
タコと近縁種は、DNAにコード化された限られた命令セットを有していますが、生命は予測不可能であり、状況が変わると動物は適応する柔軟性が必要とされます。海洋生物学研究所(MBL)のジョシュア・ローゼンタール(Joshua Rosenthal)博士とテルアビブ大学のイーライ・アイゼンバーグ(Eli Eisenberg)博士が率いる新たな研究によれば、タコとその仲間たちは、環境の厳しい条件にエレガントに適応するために、RNAと呼ばれるDNAの指令を伝える中間分子に手を加えるという方法を用いていることがわかりました。
ローゼンタール博士らは、2023年6月8日付の『Cell』誌に掲載された最新の研究で、タコ、イカ、イカ類(頭足類として知られている)が寒冷な水に遭遇すると、RNAの編集が非常に活発になることを報告しています。この研究により、タコの水槽を冷却した後、研究チームは動物の神経系にある13,000以上のRNA部位で、タンパク質の活性を変化させるRNA編集の増加を確認しました。その中には、RNA分子のコードのわずかな変化で、神経細胞が生成するタンパク質の機能が大きく変わる例もありました。Cell誌に掲載された論文のタイトルは、「Temperature-Dependent RNA Editing in Octopus Extensively Recodes the Neural Proteome(タコの温度依存性RNA編集が神経プロテオームを広範囲に再コード化する)」です。
MBLの上級科学者であるローゼンタール博士によれば、RNA編集を通じて、頭足類は独自の生理機能を微調整するユニークな方法を見つけたとのことです。
「我々は、すべての生物が生まれながらにして一定の命令にプログラムされていると考えることが一般的ですが、頭足類の研究を通じて、環境が遺伝情報に影響を与えると
逆転写酵素がDNA合成を促進することを示す画期的な論文
 サセックス大学(英国)のAidan Doherty教授率いる研究チームが、Nucleic Acids Research(NAR)誌の "Breakthrough Article"で驚くべき成果を発表しました。彼らの研究では、CRISPRに関連する逆転写酵素(RT)がDNA合成のプライミングをRNAとDNAの両方で直接行うことが明らかにされ、さらにこのRT依存性のプライミングがいくつかのCRISPR-Cas複合体によって利用され、新しいスペーサーが合成され、CRISPRアレイに統合されることが示されました。
この重要な研究では、グループIIのイントロンRTやテロメラーゼ、HIVレトロウイルスRTなど、他の主要なRTクラスの代表者にもプライマー合成活性が保存されていることが明らかになっています。このオープンアクセス論文のタイトルは「Reverse Transcriptases Prime DNA(逆転写酵素プライムDNA)」で、2023年6月6日に発表されました。
DNAプライマー合成は、生物やウイルスのゲノムを増殖させる上で欠かせないプロセスであり、複製酵素であるDNAプライマーゼによって行われます。DNAプライミングは、細胞内の他の重要な作業、例えば損傷耐性や修復などにも必要なのです。
半世紀以上前、ノーベル賞受賞者であるHoward Temin博士とDavid Baltimore博士は、真核生物のRNAウイルスであるレトロウイルスがRNA依存性DNAポリメラーゼである逆転写酵素(RT)をコードしていることを突き止めました。これにより、RNAがDNAに逆転写されるという画期的な発見がなされました。以来、RTは原核細胞や真核細胞においても、レトロトランスポジションやテロメアの維持など、重要な役割を果たしていることが明らかになってきました。
RTのDNA合成機構は、
サセックス大学(英国)のAidan Doherty教授率いる研究チームが、Nucleic Acids Research(NAR)誌の "Breakthrough Article"で驚くべき成果を発表しました。彼らの研究では、CRISPRに関連する逆転写酵素(RT)がDNA合成のプライミングをRNAとDNAの両方で直接行うことが明らかにされ、さらにこのRT依存性のプライミングがいくつかのCRISPR-Cas複合体によって利用され、新しいスペーサーが合成され、CRISPRアレイに統合されることが示されました。
この重要な研究では、グループIIのイントロンRTやテロメラーゼ、HIVレトロウイルスRTなど、他の主要なRTクラスの代表者にもプライマー合成活性が保存されていることが明らかになっています。このオープンアクセス論文のタイトルは「Reverse Transcriptases Prime DNA(逆転写酵素プライムDNA)」で、2023年6月6日に発表されました。
DNAプライマー合成は、生物やウイルスのゲノムを増殖させる上で欠かせないプロセスであり、複製酵素であるDNAプライマーゼによって行われます。DNAプライミングは、細胞内の他の重要な作業、例えば損傷耐性や修復などにも必要なのです。
半世紀以上前、ノーベル賞受賞者であるHoward Temin博士とDavid Baltimore博士は、真核生物のRNAウイルスであるレトロウイルスがRNA依存性DNAポリメラーゼである逆転写酵素(RT)をコードしていることを突き止めました。これにより、RNAがDNAに逆転写されるという画期的な発見がなされました。以来、RTは原核細胞や真核細胞においても、レトロトランスポジションやテロメアの維持など、重要な役割を果たしていることが明らかになってきました。
RTのDNA合成機構は、
高地の長寿現象を解明:酸素制限によるマウスの寿命延長が初めて実証される
 ハーバード大学医学部の科学者らは、驚くべき結果をもたらす研究を発表しました。彼らは異常に寿命の短いマウスの系統を、エベレストのベースキャンプとほぼ同じ酸素濃度の低い環境に置いたところ、予想に反して50%も長生きすることが判明しました。この驚くべき研究結果は、PLoS Biology誌に2023年5月23日付けで掲載されました。
この研究は、動物モデルにおいて寿命を延ばすことが示された新たなアプローチを提供し、また、酸素制限が老化モデルマウスの寿命を延ばすことを初めて実証しました。この研究のオープンアクセス論文のタイトルは「Hypoxia Extends Lifespan and Neurological Function in a Mouse Model of Aging(低酸素は老化モデルマウスの寿命と神経機能を延長する)」です。
疫学的観察からは、高地に住む人々が長生きする傾向があることや、特定の病気になりにくいことが明らかになっています。これは不思議な現象であり、興味深い手がかりとなっています。今回の研究では、この驚くべき現象が動物でも再現できるかどうかを調査しました。
「標高の高い地域に住む集団は、年をとっても長寿で健康な傾向があることが、疫学的な研究から示唆されています。」ハーバード大学医学部ブラヴァトニク研究所のシステム生物学教授であり、この研究の主要な著者であるヴァムシ・ムータ博士は、「私たちは、より制御された環境で酸素を制限することが、私たちの老化モデルマウスにおいて同様の効果をもたらすのかどうかを確認したかったのです」と語りました。
ムータ研究室のポスドク研究員であり、この研究の筆頭著者であるロバート・ロジャース博士は、「人間は古代から、寿命を延ばし、あるいは少なくとも死を遅らせるために努力してきました」と述べました。
過去数十年にわたる研究
ハーバード大学医学部の科学者らは、驚くべき結果をもたらす研究を発表しました。彼らは異常に寿命の短いマウスの系統を、エベレストのベースキャンプとほぼ同じ酸素濃度の低い環境に置いたところ、予想に反して50%も長生きすることが判明しました。この驚くべき研究結果は、PLoS Biology誌に2023年5月23日付けで掲載されました。
この研究は、動物モデルにおいて寿命を延ばすことが示された新たなアプローチを提供し、また、酸素制限が老化モデルマウスの寿命を延ばすことを初めて実証しました。この研究のオープンアクセス論文のタイトルは「Hypoxia Extends Lifespan and Neurological Function in a Mouse Model of Aging(低酸素は老化モデルマウスの寿命と神経機能を延長する)」です。
疫学的観察からは、高地に住む人々が長生きする傾向があることや、特定の病気になりにくいことが明らかになっています。これは不思議な現象であり、興味深い手がかりとなっています。今回の研究では、この驚くべき現象が動物でも再現できるかどうかを調査しました。
「標高の高い地域に住む集団は、年をとっても長寿で健康な傾向があることが、疫学的な研究から示唆されています。」ハーバード大学医学部ブラヴァトニク研究所のシステム生物学教授であり、この研究の主要な著者であるヴァムシ・ムータ博士は、「私たちは、より制御された環境で酸素を制限することが、私たちの老化モデルマウスにおいて同様の効果をもたらすのかどうかを確認したかったのです」と語りました。
ムータ研究室のポスドク研究員であり、この研究の筆頭著者であるロバート・ロジャース博士は、「人間は古代から、寿命を延ばし、あるいは少なくとも死を遅らせるために努力してきました」と述べました。
過去数十年にわたる研究
NIHの資金援助でUTSWがヒト心臓再生研究を推進。心不全に対する低酸素療法の安全性と有望性を示唆。
 テキサス大学サウスウェスタン(UTSW)メディカルセンターでは、心臓発作やその他の心血管系イベント後のヒト心臓細胞の再生能力に関する研究が、国立衛生研究所からの新たな助成金によって加速されることになりました。このプロジェクトは、UTSWのヘシャム・サデック医学博士が率いる心臓再生に関する研究を基にしており、免疫系が心臓の再生能力を制御し、傷害にどのように対応するかを研究します。このプログラム・プロジェクト助成金は、5年間で1,070万ドルの資金を提供し、多くの発見が期待されています。
最近のドイツの研究者による概念実証ヒト試験は、サデック博士の前臨床研究と一致し、心臓発作後の心臓の自己修復と失われた機能の回復には低酸素状態が重要な役割を果たすことを示しました。この成果は、Circulation Research誌で発表され、心臓血管医学の分野において新たな展開をもたらすものとして注目されています。論文のタイトルは「Hypoxia and Cardiac Function in Patients with Prior Myocardial Infarction(心筋梗塞既往患者における低酸素と心機能)」です。
UTSWのHamon再生科学・医学センターの副所長であるサデック博士は、「心臓発作後の心機能の低下は、私たちの従来の信じ方に反して、実際には可逆的な可能性があると考えられます。
基礎的発見
テキサス大学サウスウェスタン(UTSW)メディカルセンターの研究者チームは、以前の研究で心臓の再生能力の喪失を媒介する重要な分子経路を同定しました。その中には、出生直後の心臓への負荷と酸素供給の増大が関与しているものもあります。この研究は、ヒトでこれらの経路を検証するために行われ、ドイツ・ケルン航空宇宙医学研究所心臓血管航空宇宙医学部長のイェンス・タンク医学博士を含むUT
テキサス大学サウスウェスタン(UTSW)メディカルセンターでは、心臓発作やその他の心血管系イベント後のヒト心臓細胞の再生能力に関する研究が、国立衛生研究所からの新たな助成金によって加速されることになりました。このプロジェクトは、UTSWのヘシャム・サデック医学博士が率いる心臓再生に関する研究を基にしており、免疫系が心臓の再生能力を制御し、傷害にどのように対応するかを研究します。このプログラム・プロジェクト助成金は、5年間で1,070万ドルの資金を提供し、多くの発見が期待されています。
最近のドイツの研究者による概念実証ヒト試験は、サデック博士の前臨床研究と一致し、心臓発作後の心臓の自己修復と失われた機能の回復には低酸素状態が重要な役割を果たすことを示しました。この成果は、Circulation Research誌で発表され、心臓血管医学の分野において新たな展開をもたらすものとして注目されています。論文のタイトルは「Hypoxia and Cardiac Function in Patients with Prior Myocardial Infarction(心筋梗塞既往患者における低酸素と心機能)」です。
UTSWのHamon再生科学・医学センターの副所長であるサデック博士は、「心臓発作後の心機能の低下は、私たちの従来の信じ方に反して、実際には可逆的な可能性があると考えられます。
基礎的発見
テキサス大学サウスウェスタン(UTSW)メディカルセンターの研究者チームは、以前の研究で心臓の再生能力の喪失を媒介する重要な分子経路を同定しました。その中には、出生直後の心臓への負荷と酸素供給の増大が関与しているものもあります。この研究は、ヒトでこれらの経路を検証するために行われ、ドイツ・ケルン航空宇宙医学研究所心臓血管航空宇宙医学部長のイェンス・タンク医学博士を含むUT
前癌性大腸ポリープと腸内細菌の接点を解明した最新研究
 マサチューセッツ工科大学(Mass General Brigham)の研究者らが行った最新の研究により、特定の腸内細菌が前癌性大腸ポリープの発生と関連していることが明らかになりました。この研究結果は、2023年4月30日にCell Host & Microbe誌に発表されました。この論文のタイトルは「Association of Distinct Microbial Signatures with Premalignant Colorectal Adenomas(前悪性度大腸腺腫と異なる微生物シグネチャーの関連性)」です。
ダニエル・C・チャン医学博士は共著者として、「腸内マイクロバイオームと癌の関係を理解するために、私たちは多くの研究を行ってきました。しかしこの新しい研究は、前癌性ポリープに対するマイクロバイオームの影響を理解するためのものです。」と述べました。「マイクロバイオームを介して、大腸癌の形成に関与し、予防する機会を得ることができるのです。」
大腸癌は、米国における癌関連死因の第2位であり、若年成人の間での大腸癌の発症率が上昇しています。すべての大腸がんは、前がんポリープから発生すると言われています。大腸癌の発生を最小限に抑えるためには、ポリープが段階的に成長する前に止めることが最も効果的な方法の一つです。
この研究者らによる最新の研究によると、ポリープの発生には複数のタイプが存在し、主な2つのタイプは管状腺腫と無柄性鋸歯状ポリープだという。大腸がんやポリープのリスク要因として、過体重や肥満、運動不足、赤身肉や加工肉を含む食事、喫煙、飲酒などの生活習慣が挙げられます。これらの要因は、腸内に存在する細菌の集まりである腸内細菌叢にも影響を及ぼす可能性があります。
研究者らは、これらの環境的な影響がポリープの成長を促進する可能性について、次の2つの
マサチューセッツ工科大学(Mass General Brigham)の研究者らが行った最新の研究により、特定の腸内細菌が前癌性大腸ポリープの発生と関連していることが明らかになりました。この研究結果は、2023年4月30日にCell Host & Microbe誌に発表されました。この論文のタイトルは「Association of Distinct Microbial Signatures with Premalignant Colorectal Adenomas(前悪性度大腸腺腫と異なる微生物シグネチャーの関連性)」です。
ダニエル・C・チャン医学博士は共著者として、「腸内マイクロバイオームと癌の関係を理解するために、私たちは多くの研究を行ってきました。しかしこの新しい研究は、前癌性ポリープに対するマイクロバイオームの影響を理解するためのものです。」と述べました。「マイクロバイオームを介して、大腸癌の形成に関与し、予防する機会を得ることができるのです。」
大腸癌は、米国における癌関連死因の第2位であり、若年成人の間での大腸癌の発症率が上昇しています。すべての大腸がんは、前がんポリープから発生すると言われています。大腸癌の発生を最小限に抑えるためには、ポリープが段階的に成長する前に止めることが最も効果的な方法の一つです。
この研究者らによる最新の研究によると、ポリープの発生には複数のタイプが存在し、主な2つのタイプは管状腺腫と無柄性鋸歯状ポリープだという。大腸がんやポリープのリスク要因として、過体重や肥満、運動不足、赤身肉や加工肉を含む食事、喫煙、飲酒などの生活習慣が挙げられます。これらの要因は、腸内に存在する細菌の集まりである腸内細菌叢にも影響を及ぼす可能性があります。
研究者らは、これらの環境的な影響がポリープの成長を促進する可能性について、次の2つの
アルツハイマー病の発症の個人差に迫る─ピッツバーグ大学の研究者がアストロサイトの役割を明らかに
 なぜアルツハイマー病の発症には個人差があるのでしょうか?また、アルツハイマー病の典型的な脳の病理学的特徴である有毒なアミロイド凝集体が脳に大量に存在するにも関わらず、なぜその一部の人々はアルツハイマー病に関連した認知症を発症しないのでしょうか?ピッツバーグ大学医学部の研究者たちは、この謎の解明に一歩近づいたようです。彼らは、アストロサイトと呼ばれる星型の脳細胞が、アルツハイマー病の進行において重要な役割を果たす可能性があることを、2023年5月29日付のNature Medicine誌で発表しました。
この研究は、オープンアクセス論文 「Astrocyte Reactivity Influences Amyloid-Βeta Effects on Tau Pathology in Preclinical Alzheimer's Disease(前臨床アルツハイマー病におけるアミロイドβのタウ病態への影響はアストロサイトの反応性に影響する)」にまとめられています。
ピッツバーグ大学の研究チームは、1,000人以上の高齢者を対象に、認知機能に障害のない人々の血液を調査しました。彼らは、アミロイド病理学の有無に関わらず、アミロイドの蓄積とアストロサイトの異常な活性化(反応性)の両方を示す血液マーカーを持つ人々が、将来的に症状の現れるアルツハイマー病に進行する可能性が高いことを発見しました。
「我々の研究は、アストロサイト反応性の血液バイオマーカーと脳内のアミロイドの存在を検査することが、アルツハイマー病の進行リスクが最も高い患者を同定するための最適なスクリーニング方法であると主張しています」と、上級著者でありピット精神医学・神経学准教授であるタリック・パスコアル医学博士は述べています。「この研究は、アミロイドがアルツハイマー病の引き金となるという従来の考え方に挑戦するも
なぜアルツハイマー病の発症には個人差があるのでしょうか?また、アルツハイマー病の典型的な脳の病理学的特徴である有毒なアミロイド凝集体が脳に大量に存在するにも関わらず、なぜその一部の人々はアルツハイマー病に関連した認知症を発症しないのでしょうか?ピッツバーグ大学医学部の研究者たちは、この謎の解明に一歩近づいたようです。彼らは、アストロサイトと呼ばれる星型の脳細胞が、アルツハイマー病の進行において重要な役割を果たす可能性があることを、2023年5月29日付のNature Medicine誌で発表しました。
この研究は、オープンアクセス論文 「Astrocyte Reactivity Influences Amyloid-Βeta Effects on Tau Pathology in Preclinical Alzheimer's Disease(前臨床アルツハイマー病におけるアミロイドβのタウ病態への影響はアストロサイトの反応性に影響する)」にまとめられています。
ピッツバーグ大学の研究チームは、1,000人以上の高齢者を対象に、認知機能に障害のない人々の血液を調査しました。彼らは、アミロイド病理学の有無に関わらず、アミロイドの蓄積とアストロサイトの異常な活性化(反応性)の両方を示す血液マーカーを持つ人々が、将来的に症状の現れるアルツハイマー病に進行する可能性が高いことを発見しました。
「我々の研究は、アストロサイト反応性の血液バイオマーカーと脳内のアミロイドの存在を検査することが、アルツハイマー病の進行リスクが最も高い患者を同定するための最適なスクリーニング方法であると主張しています」と、上級著者でありピット精神医学・神経学准教授であるタリック・パスコアル医学博士は述べています。「この研究は、アミロイドがアルツハイマー病の引き金となるという従来の考え方に挑戦するも
ヒト・パンゲノムの革新:47人のゲノムから成る最も鮮明なスナップショットが発表された
 科学者たちは20年以上にわたり、ヒト・リファレンスゲノムとして知られるコンセンサス遺伝子配列を使用し、他の遺伝子データと比較してきました。このリファレンスゲノムは数え切れないほどの研究で利用され、特定の病気の遺伝子を特定したり、ヒトの形質の進化を追跡したりすることが可能になりました。しかしこのツールには常に問題がありました。最大の問題の一つは、データの約70パーセントが、ヒトゲノム計画でDNA配列が決定されたアフリカ系ヨーロッパ人の男性から得られたものであるということです。その結果、地球上の70億の人々の間でわずかながらでも違いを生み出す0.2〜1パーセントの遺伝子配列についてはほとんど知ることができず、生物医学データにはバイアスが生じていると考えられています。このバイアスは、現在の健康格差の一部の原因ともなっています。
たとえば、リファレンスゲノムには含まれていないヨーロッパ人以外の集団に見られる多くの遺伝子変異が存在します。これまで、研究者たちはヒトの多様性をより包括的に捉えるためのリソースを求めてきました。そして、ヒト・パンゲノム・リファレンス・コンソーシアム(HPRC)の科学者たちは、この取り組みで画期的な進歩を遂げました。彼らは2023年5月10日付のネイチャー誌に発表し、世界中の47人のゲノム配列を「パンゲノム」と呼ばれる形で再構築したと述べています。このパンゲノムでは、各ゲノム配列の99%以上が高い精度で再現されています。
このオープンアクセス論文のタイトルは『A Draft Human Pangenome Reference』です。これにより、個人間で異なるヒトDNAの割合を特徴付ける上で、大きな進展が達成されました。これにより、将来的には様々な人々の遺伝子情報をより包括的に理解することが可能となります。ヒト・パンゲノムの構築により、リファレンスゲノ
科学者たちは20年以上にわたり、ヒト・リファレンスゲノムとして知られるコンセンサス遺伝子配列を使用し、他の遺伝子データと比較してきました。このリファレンスゲノムは数え切れないほどの研究で利用され、特定の病気の遺伝子を特定したり、ヒトの形質の進化を追跡したりすることが可能になりました。しかしこのツールには常に問題がありました。最大の問題の一つは、データの約70パーセントが、ヒトゲノム計画でDNA配列が決定されたアフリカ系ヨーロッパ人の男性から得られたものであるということです。その結果、地球上の70億の人々の間でわずかながらでも違いを生み出す0.2〜1パーセントの遺伝子配列についてはほとんど知ることができず、生物医学データにはバイアスが生じていると考えられています。このバイアスは、現在の健康格差の一部の原因ともなっています。
たとえば、リファレンスゲノムには含まれていないヨーロッパ人以外の集団に見られる多くの遺伝子変異が存在します。これまで、研究者たちはヒトの多様性をより包括的に捉えるためのリソースを求めてきました。そして、ヒト・パンゲノム・リファレンス・コンソーシアム(HPRC)の科学者たちは、この取り組みで画期的な進歩を遂げました。彼らは2023年5月10日付のネイチャー誌に発表し、世界中の47人のゲノム配列を「パンゲノム」と呼ばれる形で再構築したと述べています。このパンゲノムでは、各ゲノム配列の99%以上が高い精度で再現されています。
このオープンアクセス論文のタイトルは『A Draft Human Pangenome Reference』です。これにより、個人間で異なるヒトDNAの割合を特徴付ける上で、大きな進展が達成されました。これにより、将来的には様々な人々の遺伝子情報をより包括的に理解することが可能となります。ヒト・パンゲノムの構築により、リファレンスゲノ
食事と腸管幹細胞:健康とがんリスクの関係を明らかにする最新研究
 人間の腸は、細胞が3〜5日ごとに完全に入れ替わるという興味深い特性を持っています。この現象によって、腸の内壁は食物による消化管へのダメージに対して耐えることができます。腸内の他の種類の細胞を生み出す腸管幹細胞がこの迅速な入れ替わりを担当していることが、最近の研究で明らかになりました。
最新の研究によれば、これらの腸管幹細胞は食事によって大きく影響を受け、健康な状態を維持するだけでなく、がん化を促進する可能性もあることがわかっています。MITのアイゼン・アンド・チャン・キャリア開発准教授であるオメル・イルマズ博士は、「断食やカロリー制限などの低カロリー食は、抗老化効果や抗腫瘍効果があります。一方、肥満を引き起こす食事は、がんやその他の老化関連疾患のリスクを高める可能性があります」と述べています。
過去10年間、イルマズ博士はさまざまな食事や環境条件が腸管幹細胞に及ぼす影響を研究し、これらの要因ががんや他の病気のリスクをどのように高めるかを明らかにしてきました。この研究は、食事介入や特定の食事の有益な効果を模倣する薬物によって、消化管の健康を改善するための新たな手法を開発する上で有益な情報となる可能性があります。
イルマズ博士はMITのコッホ統合がん研究所のメンバーでもあり、彼は「我々の発見は、絶食介入や絶食の効果を模倣する低分子が、腸の再生を改善する役割を果たす可能性を示唆しています」と述べています。今後、この研究に基づいて、消化管の健康を向上させるための新たな方法や、絶食効果を模倣する低分子を活用した治療法の開発が進められることが期待されます。
臨床的アプローチ
イルマズ博士は、医学と病気に対する関心は幼い頃から芽生えました。彼の父親が内科医だったため、イルマズ医師は放課後に父親の診療所で多くの時間を過ごす機会がありました。
「薬や病気の治療について非常に興
人間の腸は、細胞が3〜5日ごとに完全に入れ替わるという興味深い特性を持っています。この現象によって、腸の内壁は食物による消化管へのダメージに対して耐えることができます。腸内の他の種類の細胞を生み出す腸管幹細胞がこの迅速な入れ替わりを担当していることが、最近の研究で明らかになりました。
最新の研究によれば、これらの腸管幹細胞は食事によって大きく影響を受け、健康な状態を維持するだけでなく、がん化を促進する可能性もあることがわかっています。MITのアイゼン・アンド・チャン・キャリア開発准教授であるオメル・イルマズ博士は、「断食やカロリー制限などの低カロリー食は、抗老化効果や抗腫瘍効果があります。一方、肥満を引き起こす食事は、がんやその他の老化関連疾患のリスクを高める可能性があります」と述べています。
過去10年間、イルマズ博士はさまざまな食事や環境条件が腸管幹細胞に及ぼす影響を研究し、これらの要因ががんや他の病気のリスクをどのように高めるかを明らかにしてきました。この研究は、食事介入や特定の食事の有益な効果を模倣する薬物によって、消化管の健康を改善するための新たな手法を開発する上で有益な情報となる可能性があります。
イルマズ博士はMITのコッホ統合がん研究所のメンバーでもあり、彼は「我々の発見は、絶食介入や絶食の効果を模倣する低分子が、腸の再生を改善する役割を果たす可能性を示唆しています」と述べています。今後、この研究に基づいて、消化管の健康を向上させるための新たな方法や、絶食効果を模倣する低分子を活用した治療法の開発が進められることが期待されます。
臨床的アプローチ
イルマズ博士は、医学と病気に対する関心は幼い頃から芽生えました。彼の父親が内科医だったため、イルマズ医師は放課後に父親の診療所で多くの時間を過ごす機会がありました。
「薬や病気の治療について非常に興
ナノ粒子と生物の相互作用の解明:ナノインフォマティクスの力を実証
 「ナノ粒子への曝露に特異的な新たな反応メカニズム」、それが研究者たちによって明らかにされました。フィンランド・タンペレ大学のFHAIVE(統合的アプローチの開発と検証のためのフィンランド拠点)のジウシー・デル・ジュディチェ博士研究員とダリオ・グレコ教授を中心とする学際的なチームは、ヒトからより単純な生物まで、異なる生物種がこの種の曝露にどのように適応しているのかを説明するエピジェネティックな防御メカニズムを解明しました。この研究は、ナノ物質に対する分子応答に関する豊富なデータセットの分析に基づいています。
このプロジェクトは、フィンランド、アイルランド、ポーランド、英国、キプロス、南アフリカ、ギリシャ、エストニアの学際的チームと、アイルランドのユニバーシティ・カレッジ・ダブリン(UCD)物理学部のウラジミール・ロバスキン准教授と共同で実施されました。彼らの共同研究論文「Ancestral Molecular Response to Nanomaterial Particulates(ナノ物質微粒子に対する祖先の分子反応)」は、2023年5月8日にネイチャー・ナノテクノロジー誌に掲載されました。
FHAIVEのディレクターであるグレコ教授は、次のように述べています。「我々は、初めてナノ粒子に対する特異的な応答が存在し、それがナノ特性と密接に関連していることを実証しました。この研究は、異なる生物種がどのように粒子状物質に類似した反応を示すのかを明らかにするものです。また、化学物質の安全性評価におけるトキシコゲノミクスの制限を克服するための解決策を提案しています。」
システム生物学とナノインフォマティクスの出会い
ナノ構造生物システムの専門家であるウラジミール・ロバスキン准教授は、次のように述べています。「この重要な共同研究において、タンペレ大学率いるチームとUCD物
「ナノ粒子への曝露に特異的な新たな反応メカニズム」、それが研究者たちによって明らかにされました。フィンランド・タンペレ大学のFHAIVE(統合的アプローチの開発と検証のためのフィンランド拠点)のジウシー・デル・ジュディチェ博士研究員とダリオ・グレコ教授を中心とする学際的なチームは、ヒトからより単純な生物まで、異なる生物種がこの種の曝露にどのように適応しているのかを説明するエピジェネティックな防御メカニズムを解明しました。この研究は、ナノ物質に対する分子応答に関する豊富なデータセットの分析に基づいています。
このプロジェクトは、フィンランド、アイルランド、ポーランド、英国、キプロス、南アフリカ、ギリシャ、エストニアの学際的チームと、アイルランドのユニバーシティ・カレッジ・ダブリン(UCD)物理学部のウラジミール・ロバスキン准教授と共同で実施されました。彼らの共同研究論文「Ancestral Molecular Response to Nanomaterial Particulates(ナノ物質微粒子に対する祖先の分子反応)」は、2023年5月8日にネイチャー・ナノテクノロジー誌に掲載されました。
FHAIVEのディレクターであるグレコ教授は、次のように述べています。「我々は、初めてナノ粒子に対する特異的な応答が存在し、それがナノ特性と密接に関連していることを実証しました。この研究は、異なる生物種がどのように粒子状物質に類似した反応を示すのかを明らかにするものです。また、化学物質の安全性評価におけるトキシコゲノミクスの制限を克服するための解決策を提案しています。」
システム生物学とナノインフォマティクスの出会い
ナノ構造生物システムの専門家であるウラジミール・ロバスキン准教授は、次のように述べています。「この重要な共同研究において、タンペレ大学率いるチームとUCD物
抗生物質耐性感染症に朗報!AIアルゴリズムで新薬発見、MITとマクマスター大学の共同研究
 マサチューセッツ工科大学(MIT)とマクマスター大学(カナダ)の研究者は、最新のニュースによれば、人工知能のアルゴリズムを活用して、薬剤耐性感染症の主要な原因となる一種の細菌に対抗できる新たな抗生物質を発見しました。この発見により、肺炎や髄膜炎などの深刻な感染症を引き起こすアシネトバクター・バウマンニ(画像)という細菌に対して有効な治療薬が開発され、将来的に患者の治療に使用される可能性があります。
アシネトバクター・バウマンニは、イラクやアフガニスタンの負傷兵の感染症の主な原因となっており、病院内でも長期間生存し、抗生物質耐性遺伝子を環境から取り込むことができる特性を持っています。この細菌について、マクマスター大学の生化学・医科学助教授であり、かつてMITのポスドクであったJonathan Stokes博士は次のように述べています。「アシネトバクターは、病院のドアノブや器具の表面などで長時間生存でき、環境から抗生物質耐性遺伝子を取り込む能力を持っています。」
研究チームは、約7,000種類の化合物からなる新しい薬剤候補のライブラリを利用し、機械学習モデルを訓練して、これらの化合物がアシネトバクター・バウマンニの増殖を抑制するかどうかを評価しました。その結果、特定の化合物が細菌の増殖を効果的に抑制することが明らかになりました。
「今回の発見は、AIが新規抗生物質の探索を大幅に加速・拡大できるという前提をさらに裏付けるものです。」と、マサチューセッツ工科大学(MIT)の医用工学・科学研究所(IMES)および生物工学科のテルマー教授であるJames Collins博士は語ります。「この研究が、アシネトバクター・バウマンニのような問題のある病原菌に対抗するためにAIを利用できることを示していることに興奮しています。」
Collins博士とStokes博士は、2023年5
マサチューセッツ工科大学(MIT)とマクマスター大学(カナダ)の研究者は、最新のニュースによれば、人工知能のアルゴリズムを活用して、薬剤耐性感染症の主要な原因となる一種の細菌に対抗できる新たな抗生物質を発見しました。この発見により、肺炎や髄膜炎などの深刻な感染症を引き起こすアシネトバクター・バウマンニ(画像)という細菌に対して有効な治療薬が開発され、将来的に患者の治療に使用される可能性があります。
アシネトバクター・バウマンニは、イラクやアフガニスタンの負傷兵の感染症の主な原因となっており、病院内でも長期間生存し、抗生物質耐性遺伝子を環境から取り込むことができる特性を持っています。この細菌について、マクマスター大学の生化学・医科学助教授であり、かつてMITのポスドクであったJonathan Stokes博士は次のように述べています。「アシネトバクターは、病院のドアノブや器具の表面などで長時間生存でき、環境から抗生物質耐性遺伝子を取り込む能力を持っています。」
研究チームは、約7,000種類の化合物からなる新しい薬剤候補のライブラリを利用し、機械学習モデルを訓練して、これらの化合物がアシネトバクター・バウマンニの増殖を抑制するかどうかを評価しました。その結果、特定の化合物が細菌の増殖を効果的に抑制することが明らかになりました。
「今回の発見は、AIが新規抗生物質の探索を大幅に加速・拡大できるという前提をさらに裏付けるものです。」と、マサチューセッツ工科大学(MIT)の医用工学・科学研究所(IMES)および生物工学科のテルマー教授であるJames Collins博士は語ります。「この研究が、アシネトバクター・バウマンニのような問題のある病原菌に対抗するためにAIを利用できることを示していることに興奮しています。」
Collins博士とStokes博士は、2023年5
革新的な糖尿病治療法の展望:胃幹細胞がインスリン分泌細胞に変換可能
 Weill Cornell Medicineの研究者とその共同研究者による前臨床研究の成果が、ヒトの胃から採取した幹細胞を血糖値の上昇に反応してインスリンを分泌する細胞に変換することが可能であることを示し、この手法が糖尿病治療の有望なアプローチとなることが明らかになりました。この研究の結果は、2023年4月27日にNature Cell Biologyに掲載され、ヒトの胃組織から得た幹細胞が、インスリン分泌細胞であるβ細胞に驚くほど高い効率で再プログラムされることが報告されました。実験では、これらの細胞が糖尿病モデルマウスに移植され、病気の兆候が回復したことが確認されたとしています。
「この研究は、1型糖尿病や重症の2型糖尿病に対して、患者自身の細胞を用いた治療法を開発するための確かな基礎となる概念実証試験です」と、Weill Cornell Medicineの再生医学教授であり、Hartman Institute for Therapeutic Organ RegenerationのメンバーでもあるJoe Zhou博士は述べました。このNature Cell Biologyの論文のタイトルは、「Stomach-Derived Human Insulin-Secreting Organoids Restore Glucose Homeostasis(胃由来のヒトインスリン分泌オルガノイドが血糖値の調節を回復させる)」です。
インスリンは血糖値を調節する重要なホルモンであり、その不足は糖尿病やその合併症の原因となります。米国では約160万人が1型糖尿病であり、自己免疫攻撃によって膵臓のβ細胞が破壊されることで発症します。また、数百万人以上のアメリカ人が重度の2型糖尿病により、十分なβ細胞が存在しない状態にあります。現在の治療法では、インスリンの手動注射やウェアラブルポ
Weill Cornell Medicineの研究者とその共同研究者による前臨床研究の成果が、ヒトの胃から採取した幹細胞を血糖値の上昇に反応してインスリンを分泌する細胞に変換することが可能であることを示し、この手法が糖尿病治療の有望なアプローチとなることが明らかになりました。この研究の結果は、2023年4月27日にNature Cell Biologyに掲載され、ヒトの胃組織から得た幹細胞が、インスリン分泌細胞であるβ細胞に驚くほど高い効率で再プログラムされることが報告されました。実験では、これらの細胞が糖尿病モデルマウスに移植され、病気の兆候が回復したことが確認されたとしています。
「この研究は、1型糖尿病や重症の2型糖尿病に対して、患者自身の細胞を用いた治療法を開発するための確かな基礎となる概念実証試験です」と、Weill Cornell Medicineの再生医学教授であり、Hartman Institute for Therapeutic Organ RegenerationのメンバーでもあるJoe Zhou博士は述べました。このNature Cell Biologyの論文のタイトルは、「Stomach-Derived Human Insulin-Secreting Organoids Restore Glucose Homeostasis(胃由来のヒトインスリン分泌オルガノイドが血糖値の調節を回復させる)」です。
インスリンは血糖値を調節する重要なホルモンであり、その不足は糖尿病やその合併症の原因となります。米国では約160万人が1型糖尿病であり、自己免疫攻撃によって膵臓のβ細胞が破壊されることで発症します。また、数百万人以上のアメリカ人が重度の2型糖尿病により、十分なβ細胞が存在しない状態にあります。現在の治療法では、インスリンの手動注射やウェアラブルポ
糖タンパク質3量体構造の解明により、ラッサウイルスの新たなワクチン開発への道が開かれる
 西アフリカでは毎年数十万人がラッサウイルスに感染し、その結果、ラッサ熱に罹患し、重篤な合併症や長期的な健康影響、さらには死亡する可能性があります。現時点では、この病気に対する確立された治療法やワクチンは存在しません。しかしながら、カリフォルニア州ラホヤに所在するスクリプス研究所の科学者たちが、重要なタンパク質複合体の構造解析に成功しました。このタンパク質複合体は、ラッサウイルスがヒト細胞に感染する際に重要な役割を果たしています。この研究成果は、2023年5月18日にオンライン版のCell Reportsに掲載されました。さらに、研究者たちは、このタンパク質複合体に結合することでウイルスを中和する新しい抗体も同定しました。これにより、ラッサウイルスに対する効果的なワクチンや治療法の開発への道が開かれることになります。
スクリプス研究所の統合構造・計算生物学の教授であり、この研究の上級著者であるAndrew Ward博士は、「この研究は、ウイルスの脆弱性に関連する新たな抗体の単離能力において重要な進展です。これにより、多くのラッサウイルスの系統から人々を広範に保護するための合理的なワクチン設計の基礎が確立されます」と述べています。
さらに、Ward博士は、「論文に記載されたこれらの新しい薬剤は既に効果的に利用され、刺激的な新たな結果をもたらしています」と付け加えました。この研究成果は、ラッサウイルスに対する防御策の向上に向けた希望をもたらしています。
ラッサウイルスを含む多くのウイルスは、遺伝子の微細な違いにより、様々な系統が存在します。この多様性のため、すべてのラッサウイルスのバリエーションを認識する抗体の特定は困難です。さらに、ラッサウイルスを取り巻くトゲのようなタンパク質に関しても、抗体の標的となるラッサ糖タンパク質の分離に苦労しています。感染性ウイルスでは、こ
西アフリカでは毎年数十万人がラッサウイルスに感染し、その結果、ラッサ熱に罹患し、重篤な合併症や長期的な健康影響、さらには死亡する可能性があります。現時点では、この病気に対する確立された治療法やワクチンは存在しません。しかしながら、カリフォルニア州ラホヤに所在するスクリプス研究所の科学者たちが、重要なタンパク質複合体の構造解析に成功しました。このタンパク質複合体は、ラッサウイルスがヒト細胞に感染する際に重要な役割を果たしています。この研究成果は、2023年5月18日にオンライン版のCell Reportsに掲載されました。さらに、研究者たちは、このタンパク質複合体に結合することでウイルスを中和する新しい抗体も同定しました。これにより、ラッサウイルスに対する効果的なワクチンや治療法の開発への道が開かれることになります。
スクリプス研究所の統合構造・計算生物学の教授であり、この研究の上級著者であるAndrew Ward博士は、「この研究は、ウイルスの脆弱性に関連する新たな抗体の単離能力において重要な進展です。これにより、多くのラッサウイルスの系統から人々を広範に保護するための合理的なワクチン設計の基礎が確立されます」と述べています。
さらに、Ward博士は、「論文に記載されたこれらの新しい薬剤は既に効果的に利用され、刺激的な新たな結果をもたらしています」と付け加えました。この研究成果は、ラッサウイルスに対する防御策の向上に向けた希望をもたらしています。
ラッサウイルスを含む多くのウイルスは、遺伝子の微細な違いにより、様々な系統が存在します。この多様性のため、すべてのラッサウイルスのバリエーションを認識する抗体の特定は困難です。さらに、ラッサウイルスを取り巻くトゲのようなタンパク質に関しても、抗体の標的となるラッサ糖タンパク質の分離に苦労しています。感染性ウイルスでは、こ
センザンコウの鱗の違法取引を防ぐため、ゲノム情報を収集し、保護活動に活用
センザンコウの特異性が科学界によってさらに解明されました。センザンコウは、ツチブタとアルマジロを組み合わせたような、奇妙なうろこ状の哺乳類であり、科学者たちにはまだ多くの謎が残されています。この驚くべき生物について、UCLAの研究者であるJen Tinsman博士が率いる研究チームが、学術誌Chromosome Researchに論文を発表しました。彼らの研究は、“科学的な驚き”と称されるセンザンコウの特異性を強調しています。 センザンコウは、他の哺乳類よりも驚くべき染色体数を持っています。ボリビアタケネズミを除けば、センザンコウは118本の染色体を持ち、これはヒトの46本よりもはるかに多いです。一般的な染色体数は36本から42本ですが、センザンコウはその範疇を超えています。 さらに、科学者たちはもう一つの遺伝的特徴を発見しました。オスのセンザンコウはメスと異なる113本の染色体を持っており(通常、オスとメスは同じ数の染色体を持つことが一般的です)、これも他の生物種では見られない特徴です。 Tinsman博士は、この研究の共著者であり、UCLAの研究員でもあります。彼は、「この地球上で他に類を見ない独自の秩序と家族を持つ」と述べ、センザンコの近縁種にはネコやサイも含まれることを付け加えました。彼の研究チームの論文は、「Chromosome-Length Genome Assemblies and Cytogenomic Analyses of Pangolins Reveal Remarkable Chromosome Counts and Plasticity(センザンコウの染色体長ゲノムアセンブリと細胞遺伝学的解析から、驚くべき染色体数と可塑性が明らかになった)」というタイトルで発表されました。 Tinsman博士は、UCLAを含む世界中の大学、動物園、研究腫瘍が肝臓を再プログラムするメカニズムを解明:新たな治療法の可能性
 発表された最新の研究によれば、がんは肝臓に影響を及ぼす分子を放出することで、肝臓を病的に変化させ、炎症を引き起こし、脂肪を蓄積させ、解毒機能を損なうことが明らかになりました。この研究は、Weill Cornell Medicineの研究者と他の研究機関との共同作業によって行われました。この発見は、がんの生存メカニズムの中でも非常に巧妙なものの一つであり、新たな検査や薬剤の開発に向けた可能性を示唆しています。これにより、肝臓の状態を改善し、逆転させる手段が見つかるかもしれません。
この研究は、最新の論文として、2023年5月24日にNature誌に掲載されました。論文のタイトルは、「Tumour Extracellular Vesicles and Particles Induce Liver Metabolic Dysfunction(腫瘍由来の細胞外小胞および粒子が肝臓の代謝機能障害を誘発する)」です。
研究者たちは、肝臓外で成長する様々な腫瘍が、肝臓を脂肪肝に似た状態に再プログラムするために、脂肪酸を含む細胞外小胞および粒子(EVP)の分泌を利用していることを発見しました。このプロセスは、がんの動物モデルや実際のがん患者の肝臓で確認されました。
Weill Cornell Medicineの小児科および細胞・発達生物学の教授であり、研究共同責任者であるDavid Lyden医学博士は、「我々の発見は、腫瘍が肝臓疾患を含む重大な全身的な合併症を引き起こす可能性があることを示しています。しかし、同時に、これらの合併症に対処するための将来の治療法の可能性も示唆しています」と述べました。
なお、この研究は、Weill Cornell Medicineのゲイル&アイラ・ドルキエ研究所とサンドラ&エドワード・マイヤーがんセンターのメンバーであるDavid Lyden博士
発表された最新の研究によれば、がんは肝臓に影響を及ぼす分子を放出することで、肝臓を病的に変化させ、炎症を引き起こし、脂肪を蓄積させ、解毒機能を損なうことが明らかになりました。この研究は、Weill Cornell Medicineの研究者と他の研究機関との共同作業によって行われました。この発見は、がんの生存メカニズムの中でも非常に巧妙なものの一つであり、新たな検査や薬剤の開発に向けた可能性を示唆しています。これにより、肝臓の状態を改善し、逆転させる手段が見つかるかもしれません。
この研究は、最新の論文として、2023年5月24日にNature誌に掲載されました。論文のタイトルは、「Tumour Extracellular Vesicles and Particles Induce Liver Metabolic Dysfunction(腫瘍由来の細胞外小胞および粒子が肝臓の代謝機能障害を誘発する)」です。
研究者たちは、肝臓外で成長する様々な腫瘍が、肝臓を脂肪肝に似た状態に再プログラムするために、脂肪酸を含む細胞外小胞および粒子(EVP)の分泌を利用していることを発見しました。このプロセスは、がんの動物モデルや実際のがん患者の肝臓で確認されました。
Weill Cornell Medicineの小児科および細胞・発達生物学の教授であり、研究共同責任者であるDavid Lyden医学博士は、「我々の発見は、腫瘍が肝臓疾患を含む重大な全身的な合併症を引き起こす可能性があることを示しています。しかし、同時に、これらの合併症に対処するための将来の治療法の可能性も示唆しています」と述べました。
なお、この研究は、Weill Cornell Medicineのゲイル&アイラ・ドルキエ研究所とサンドラ&エドワード・マイヤーがんセンターのメンバーであるDavid Lyden博士
胎盤が鍵?統合失調症のリスク遺伝子に新たな展開
 リーバー脳発達研究所の研究者が率いる新しい研究によると、統合失調症のリスクに関連する100以上の遺伝子は、発達中の脳ではなく胎盤によって病気が引き起こされる可能性があることが明らかになりました。科学者たちは、統合失調症のリスクに関与する遺伝子は、長い間脳に関連するものであると考えてきましたが、それが独占的なものではないという認識はありました。しかし、最新の研究が2023年5月15日にNature Communications誌に発表され、胎盤が病気の発症においてこれまで以上に重要な役割を果たすことがわかりました。
このオープンアクセス論文のタイトルは、「プラセンタにおける統合失調症の潜在的な原因遺伝子の優先順位付け(Prioritization of Potential Causative Genes for Schizophrenia in Placenta)」です。この研究により、統合失調症の遺伝的な謎が、予想外の場所に隠されていることが明らかになりました。胎盤は胎児の成長に重要な役割を果たしており、リスクの発達において重要な役割を果たしているのです。リーバー脳発達研究所の所長兼CEOであり、論文のシニア著者であるDaniel Weinberger医学博士は、ボルチモアのジョンズ・ホプキンス医療キャンパスにおいて以下のように述べています。「統合失調症の原因について広く共有されている見解は、遺伝的および環境的な危険因子が直接的に脳に影響を及ぼすというものですが、この最新の研究結果は、胎盤の健康も重要であることを示しています。」
リーバー脳発達研究所の研究者による新しい研究により、統合失調症のリスク遺伝子が胎盤の重要な機能に影響を与えることが明らかになりました。研究グループは、胎盤が酸素を含む母親の血流中の栄養素を感知し、それに基づいて栄養交換を行う重要な役割を果た
リーバー脳発達研究所の研究者が率いる新しい研究によると、統合失調症のリスクに関連する100以上の遺伝子は、発達中の脳ではなく胎盤によって病気が引き起こされる可能性があることが明らかになりました。科学者たちは、統合失調症のリスクに関与する遺伝子は、長い間脳に関連するものであると考えてきましたが、それが独占的なものではないという認識はありました。しかし、最新の研究が2023年5月15日にNature Communications誌に発表され、胎盤が病気の発症においてこれまで以上に重要な役割を果たすことがわかりました。
このオープンアクセス論文のタイトルは、「プラセンタにおける統合失調症の潜在的な原因遺伝子の優先順位付け(Prioritization of Potential Causative Genes for Schizophrenia in Placenta)」です。この研究により、統合失調症の遺伝的な謎が、予想外の場所に隠されていることが明らかになりました。胎盤は胎児の成長に重要な役割を果たしており、リスクの発達において重要な役割を果たしているのです。リーバー脳発達研究所の所長兼CEOであり、論文のシニア著者であるDaniel Weinberger医学博士は、ボルチモアのジョンズ・ホプキンス医療キャンパスにおいて以下のように述べています。「統合失調症の原因について広く共有されている見解は、遺伝的および環境的な危険因子が直接的に脳に影響を及ぼすというものですが、この最新の研究結果は、胎盤の健康も重要であることを示しています。」
リーバー脳発達研究所の研究者による新しい研究により、統合失調症のリスク遺伝子が胎盤の重要な機能に影響を与えることが明らかになりました。研究グループは、胎盤が酸素を含む母親の血流中の栄養素を感知し、それに基づいて栄養交換を行う重要な役割を果た
血中エクソソームのマイクロRNAが精神疾患マーカーとなる可能性
 ブラジルのサンパウロ連邦大学(UNIFESP)の研究者たちは、精神医学遺伝学における重要な課題である精神疾患のマーカーの探索に、血液サンプルの利用が有効であることを示しました。彼らは、神経系細胞を含む体内のほとんどの細胞で作られる細胞外小胞(EV)中のマイクロRNAの分析によって、この問題を解決する可能性を明らかにしました。
この研究は、FAPESPの支援を受けて実施され、2023年2月6日にTranslational Psychiatry誌に掲載されました。論文のタイトルは、「青年期の大うつ病、注意欠陥・多動性障害、不安障害に関連する細胞外小胞のマイクロRNAの変化(Alterations in MicroRNA of Extracellular Vesicles Associated with Major Depression, Attention-Deficit/Hyperactivity and Anxiety Disorders in Adolescents)」です。
これにより、血液サンプルからのマイクロRNAの分析が、若年期の大うつ病、注意欠陥・多動性障害、不安障害といった精神疾患の関連性を調査する上で有望な手法となる可能性が示唆されました。これによって、神経細胞などの神経系細胞から得られる情報を利用して、疾患のメカニズムを理解し、新たな治療法や予防策の開発につなげることが期待されます。今後の研究によって、これらのマイクロRNAの変化と精神疾患の関係性がより明確になることを期待しています。
エクソソームと呼ばれる小型のEVは、脳を病原体や毒素から保護する重要な役割を果たすことができます。そして、マイクロRNA(miRNA)は、メッセンジャーRNAを標的とする小さな転写物であり、複数の遺伝子の発現を一度に調節する役割を担っています。これらのmiRNAは
ブラジルのサンパウロ連邦大学(UNIFESP)の研究者たちは、精神医学遺伝学における重要な課題である精神疾患のマーカーの探索に、血液サンプルの利用が有効であることを示しました。彼らは、神経系細胞を含む体内のほとんどの細胞で作られる細胞外小胞(EV)中のマイクロRNAの分析によって、この問題を解決する可能性を明らかにしました。
この研究は、FAPESPの支援を受けて実施され、2023年2月6日にTranslational Psychiatry誌に掲載されました。論文のタイトルは、「青年期の大うつ病、注意欠陥・多動性障害、不安障害に関連する細胞外小胞のマイクロRNAの変化(Alterations in MicroRNA of Extracellular Vesicles Associated with Major Depression, Attention-Deficit/Hyperactivity and Anxiety Disorders in Adolescents)」です。
これにより、血液サンプルからのマイクロRNAの分析が、若年期の大うつ病、注意欠陥・多動性障害、不安障害といった精神疾患の関連性を調査する上で有望な手法となる可能性が示唆されました。これによって、神経細胞などの神経系細胞から得られる情報を利用して、疾患のメカニズムを理解し、新たな治療法や予防策の開発につなげることが期待されます。今後の研究によって、これらのマイクロRNAの変化と精神疾患の関係性がより明確になることを期待しています。
エクソソームと呼ばれる小型のEVは、脳を病原体や毒素から保護する重要な役割を果たすことができます。そして、マイクロRNA(miRNA)は、メッセンジャーRNAを標的とする小さな転写物であり、複数の遺伝子の発現を一度に調節する役割を担っています。これらのmiRNAは
イボガインに代わる新たな治療法?研究者が特定した2つの化合物とは
 イボガインの治療効果を持ちながら毒性を持たない化合物を探していた研究者が、マウスのうつ病とオピオイドの離脱を緩和する2つの化合物を発見しました。イボガインは1960年代からオピオイド中毒の治療薬として注目されてきましたが、幻覚剤としての性質も持っています。イボガインの服用後、オピオイドを使用する意欲が低下するという報告もあり、限られた実験的な証拠が存在し、この関心が高まってきました。ただし、この薬には心臓疾患や死亡のリスクが伴います。そこで、イェール大学の研究者と共同研究者はマウスを用いた実験で、イボガインよりも生物学的標的性が高く、幻覚剤と同様にうつ病、不安、オピオイドの離脱症状を改善する2つの化合物を特定しました。
この研究成果は、今後の医薬品開発に役立ち、オピオイド中毒のより効果的な治療法につながる可能性があると、研究者は述べています。この研究は、2023年5月2日付の『Cell』誌に掲載されました。論文のタイトルは「セロトニントランスポーターの構造選択的阻害剤の構造に基づく発見(Structure-Based Discovery of Conformationally Selective Inhibitors of the Serotonin Transporter)」です。
イボガインは、イボガという植物(画像)から抽出される天然の幻覚剤であり、様々な標的タンパク質と結合する特性があります。この特性は、薬の副作用を増加させ、その効果のメカニズムを理解するのが困難であると科学者は述べています。
セロトニントランスポーターは、イボガインの標的の一つであり、抗うつ剤であるプロザック、セレクサ、パキシルなどが作用する場所でもあります。セロトニントランスポーターは脳の神経細胞の膜に存在するタンパク質であり、うつ病に関連する神経伝達物質であるセロトニンを、その作用を
イボガインの治療効果を持ちながら毒性を持たない化合物を探していた研究者が、マウスのうつ病とオピオイドの離脱を緩和する2つの化合物を発見しました。イボガインは1960年代からオピオイド中毒の治療薬として注目されてきましたが、幻覚剤としての性質も持っています。イボガインの服用後、オピオイドを使用する意欲が低下するという報告もあり、限られた実験的な証拠が存在し、この関心が高まってきました。ただし、この薬には心臓疾患や死亡のリスクが伴います。そこで、イェール大学の研究者と共同研究者はマウスを用いた実験で、イボガインよりも生物学的標的性が高く、幻覚剤と同様にうつ病、不安、オピオイドの離脱症状を改善する2つの化合物を特定しました。
この研究成果は、今後の医薬品開発に役立ち、オピオイド中毒のより効果的な治療法につながる可能性があると、研究者は述べています。この研究は、2023年5月2日付の『Cell』誌に掲載されました。論文のタイトルは「セロトニントランスポーターの構造選択的阻害剤の構造に基づく発見(Structure-Based Discovery of Conformationally Selective Inhibitors of the Serotonin Transporter)」です。
イボガインは、イボガという植物(画像)から抽出される天然の幻覚剤であり、様々な標的タンパク質と結合する特性があります。この特性は、薬の副作用を増加させ、その効果のメカニズムを理解するのが困難であると科学者は述べています。
セロトニントランスポーターは、イボガインの標的の一つであり、抗うつ剤であるプロザック、セレクサ、パキシルなどが作用する場所でもあります。セロトニントランスポーターは脳の神経細胞の膜に存在するタンパク質であり、うつ病に関連する神経伝達物質であるセロトニンを、その作用を
細胞内に存在する電気活動が生物学に新たな可能性をもたらすことが発見された。
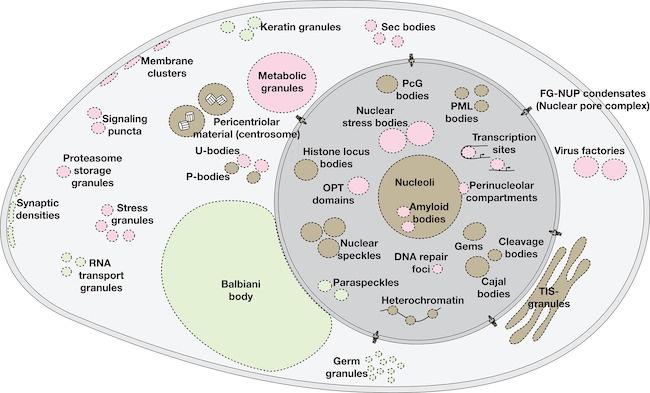 デューク大学の研究者たちは、生物学的凝縮体と呼ばれる細胞構造の内部や周囲に、細胞膜と同じような不均衡な電荷が存在することを発見した。この構造は、水中に浮かぶ油滴のように、密度の違いによって存在しており、細胞膜という物理的な境界を必要とせず、細胞内にコンパートメントを形成している。これにより、生物化学に関する研究者の考え方が変わる可能性がある。また、地球上の最初の生命が、どのようにして誕生に必要なエネルギーを利用したのかを知る手がかりにもなりそうだ。
研究チームは、小さな生体凝縮液にも、水滴が空気や固体の表面と相互作用すると、電気的な不均衡が生じることを示した過去の研究にヒントを得て、同様のことが言えるかどうかを調べた。さらに、この不均衡が、他のシステムのように活性酸素(レドックス)反応を引き起こすかどうかも確認した。論文のタイトルは、「生体分子凝縮体の界面が酸化還元反応を制御する(Interface of Biomolecular Condensates Modulates Redox Reactions)」である。
デューク大学のポスドク研究者、ダイ・イーファン博士は、バイオメディカル工学のアラン・L・カガノフ特別教授とジェームズ・L・メリアム特別教授のリンチョウ・ユウ博士の研究室で、酵素のないプレバイオティクス環境におけるエネルギー源について研究を行っている。ダイ博士は、「界面は生物学的領域であるにもかかわらず、細胞膜以外ではほとんど研究されていない。そこで、我々は生物学的凝縮体の界面で何が起こっているのかを調べ、それが非対称系なのかどうかを確かめたいと考えた」と述べた。
細胞は、生物学的凝縮体を利用して特定のタンパク質や分子を分離したり、一緒に閉じ込めたりすることができる。しかし、凝縮体の機能や利用方法についてはまだ十分に理解されていない。ダイ博士らは、この
デューク大学の研究者たちは、生物学的凝縮体と呼ばれる細胞構造の内部や周囲に、細胞膜と同じような不均衡な電荷が存在することを発見した。この構造は、水中に浮かぶ油滴のように、密度の違いによって存在しており、細胞膜という物理的な境界を必要とせず、細胞内にコンパートメントを形成している。これにより、生物化学に関する研究者の考え方が変わる可能性がある。また、地球上の最初の生命が、どのようにして誕生に必要なエネルギーを利用したのかを知る手がかりにもなりそうだ。
研究チームは、小さな生体凝縮液にも、水滴が空気や固体の表面と相互作用すると、電気的な不均衡が生じることを示した過去の研究にヒントを得て、同様のことが言えるかどうかを調べた。さらに、この不均衡が、他のシステムのように活性酸素(レドックス)反応を引き起こすかどうかも確認した。論文のタイトルは、「生体分子凝縮体の界面が酸化還元反応を制御する(Interface of Biomolecular Condensates Modulates Redox Reactions)」である。
デューク大学のポスドク研究者、ダイ・イーファン博士は、バイオメディカル工学のアラン・L・カガノフ特別教授とジェームズ・L・メリアム特別教授のリンチョウ・ユウ博士の研究室で、酵素のないプレバイオティクス環境におけるエネルギー源について研究を行っている。ダイ博士は、「界面は生物学的領域であるにもかかわらず、細胞膜以外ではほとんど研究されていない。そこで、我々は生物学的凝縮体の界面で何が起こっているのかを調べ、それが非対称系なのかどうかを確かめたいと考えた」と述べた。
細胞は、生物学的凝縮体を利用して特定のタンパク質や分子を分離したり、一緒に閉じ込めたりすることができる。しかし、凝縮体の機能や利用方法についてはまだ十分に理解されていない。ダイ博士らは、この
細胞内の長寿を工学的に制御して老化を遅らせる:酵母細胞の寿命を82%延ばす生合成遺伝子時計を開発
 3年前、カリフォルニア大学サンディエゴ校(UCSD)の研究者グループは、老化現象の背後にある重要なメカニズムを解明した。この研究チームは、細胞が老化する際にたどる2つの異なる方向を特定し、これらのプロセスを遺伝的に操作して、細胞の寿命を延ばすことに成功した。そして今回、UCサンディエゴの研究グループは、老化に伴う細胞の劣化が通常のレベルに達しないようにする解決策を考案した。
この研究の上級著者でUCサンディエゴの合成生物学研究所の共同ディレクターである生物科学部分子生物学科のナン・ハオ教授は、2023年4月28日付『サイエンス』誌に掲載された「長寿工学-細胞の老化を遅らせる合成遺伝子オシレーターの設計(Engineering Longevity-Design of a Synthetic Gene Oscillator to Slow Cellular Aging)」と題された論文で、これらの遺伝子回路は、家電や自動車などの機器を制御する我々の家庭の電気回路のように動作させることができると述べている。
UCサンディエゴの研究グループは、中心的な遺伝子制御回路の制御下で、細胞は必ずしも同じように老化するわけではないことを明らかにした。例えば、車の場合、エンジンが劣化するか、トランスミッションが摩耗するかで老化が進むが、両方が同時に進むわけではない。そこで、研究チームは、ある老化メカニズムから別の老化メカニズムへと劣化を循環させることで、細胞の寿命を延ばす「スマート・エイジング・プロセス」を構想した。
今回の研究では、細胞の老化を制御する回路の配線を遺伝的に変更した。通常の役割から、老化プロセスを停止させる負のフィードバックループを設計したのである。この回路は、遺伝子オシレーターと呼ばれる時計のような装置として機能し、細胞が2つの有害な「老化」状態を周期的に切り替える
3年前、カリフォルニア大学サンディエゴ校(UCSD)の研究者グループは、老化現象の背後にある重要なメカニズムを解明した。この研究チームは、細胞が老化する際にたどる2つの異なる方向を特定し、これらのプロセスを遺伝的に操作して、細胞の寿命を延ばすことに成功した。そして今回、UCサンディエゴの研究グループは、老化に伴う細胞の劣化が通常のレベルに達しないようにする解決策を考案した。
この研究の上級著者でUCサンディエゴの合成生物学研究所の共同ディレクターである生物科学部分子生物学科のナン・ハオ教授は、2023年4月28日付『サイエンス』誌に掲載された「長寿工学-細胞の老化を遅らせる合成遺伝子オシレーターの設計(Engineering Longevity-Design of a Synthetic Gene Oscillator to Slow Cellular Aging)」と題された論文で、これらの遺伝子回路は、家電や自動車などの機器を制御する我々の家庭の電気回路のように動作させることができると述べている。
UCサンディエゴの研究グループは、中心的な遺伝子制御回路の制御下で、細胞は必ずしも同じように老化するわけではないことを明らかにした。例えば、車の場合、エンジンが劣化するか、トランスミッションが摩耗するかで老化が進むが、両方が同時に進むわけではない。そこで、研究チームは、ある老化メカニズムから別の老化メカニズムへと劣化を循環させることで、細胞の寿命を延ばす「スマート・エイジング・プロセス」を構想した。
今回の研究では、細胞の老化を制御する回路の配線を遺伝的に変更した。通常の役割から、老化プロセスを停止させる負のフィードバックループを設計したのである。この回路は、遺伝子オシレーターと呼ばれる時計のような装置として機能し、細胞が2つの有害な「老化」状態を周期的に切り替える
100年来の謎だった休眠状態の細菌の胞子が生命を取り戻す仕組みを解明。
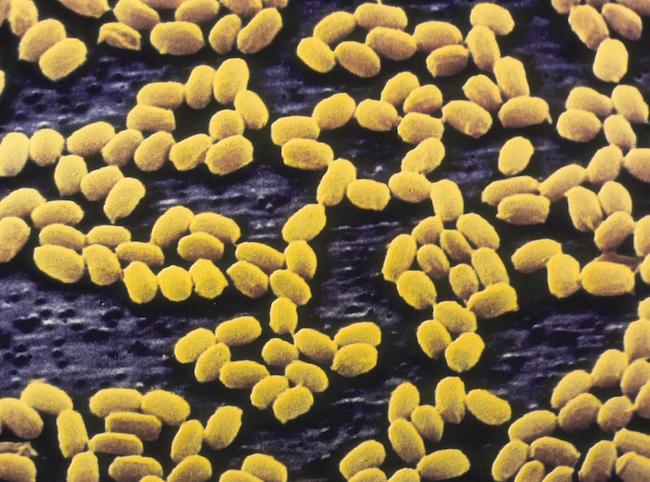 ハーバード大学医学部(HMS)の研究者が、150年以上前に初めて報告された細菌の胞子に関する謎を解き明かした。この胞子は、不活性で眠っている状態から栄養素の存在を感知すると素早く生き返るための新しい種類の細胞センサーを持っていることが分かった。このセンサーは、休眠中は閉じているが、栄養を感知すると急速に開くことが判明した。膜を貫通するチャネルとして機能するこのセンサーが開くと、胞子の保護膜が剥がれ、代謝プロセスのスイッチが入るのだ。この研究成果は、4月28日付の『Science』誌に掲載された。
HMSのブラバトニック研究所の微生物学教授であるデビッド・ルドナー博士は、「この発見は、1世紀以上前のパズルを解決するものだ。バクテリアはどのようにして環境の変化を感じ取り、保護されたケースの中でシステムがほぼ完全に停止しているときに、休眠状態から抜け出すための行動を起こすのだろうか?」と述べている。
この研究成果は、危険な細菌の芽胞が数カ月から数年間も休眠し、再び目を覚まして大発生するのを防ぐ方法の設計に役立つと考えられる。論文は「細菌胞子発芽レセプターは栄養塩ゲートイオンチャネルである(Bacterial Spore Germination Receptors Are Nutrient-Gated Ion Channels)」と題されている。
眠っていた細菌がよみがえる仕組み
悪環境を生き抜くために、一部の細菌は休眠状態に入り、生物学的プロセスを保留して細胞の周囲に保護膜を張り巡らせた芽胞となる。これにより、細菌は飢饉の時期を待ち、猛暑や乾燥、紫外線、刺激の強い化学物質、抗生物質などの害から身を守ることができる。
100年以上前から、芽胞が環境中の栄養分を感知すると、急速に保護膜を脱いで代謝エンジンを再稼働させることが知られていた。しかし、栄養分を感知するセンサー
ハーバード大学医学部(HMS)の研究者が、150年以上前に初めて報告された細菌の胞子に関する謎を解き明かした。この胞子は、不活性で眠っている状態から栄養素の存在を感知すると素早く生き返るための新しい種類の細胞センサーを持っていることが分かった。このセンサーは、休眠中は閉じているが、栄養を感知すると急速に開くことが判明した。膜を貫通するチャネルとして機能するこのセンサーが開くと、胞子の保護膜が剥がれ、代謝プロセスのスイッチが入るのだ。この研究成果は、4月28日付の『Science』誌に掲載された。
HMSのブラバトニック研究所の微生物学教授であるデビッド・ルドナー博士は、「この発見は、1世紀以上前のパズルを解決するものだ。バクテリアはどのようにして環境の変化を感じ取り、保護されたケースの中でシステムがほぼ完全に停止しているときに、休眠状態から抜け出すための行動を起こすのだろうか?」と述べている。
この研究成果は、危険な細菌の芽胞が数カ月から数年間も休眠し、再び目を覚まして大発生するのを防ぐ方法の設計に役立つと考えられる。論文は「細菌胞子発芽レセプターは栄養塩ゲートイオンチャネルである(Bacterial Spore Germination Receptors Are Nutrient-Gated Ion Channels)」と題されている。
眠っていた細菌がよみがえる仕組み
悪環境を生き抜くために、一部の細菌は休眠状態に入り、生物学的プロセスを保留して細胞の周囲に保護膜を張り巡らせた芽胞となる。これにより、細菌は飢饉の時期を待ち、猛暑や乾燥、紫外線、刺激の強い化学物質、抗生物質などの害から身を守ることができる。
100年以上前から、芽胞が環境中の栄養分を感知すると、急速に保護膜を脱いで代謝エンジンを再稼働させることが知られていた。しかし、栄養分を感知するセンサー
Capricor社、エクソソームベースの多価ワクチンの治療可能性を証明する査読付き論文を発表
 2023年4月27日、Capricor Therapeutics(NASDAQ:CAPR)は、4月24日に発表された前臨床研究に関する報告書を公表した。この報告書は、米国微生物学会の主要な査読付き科学雑誌であるMicrobiology Spectrumに掲載されたものであり、StealthX™エクソソームプラットフォーム技術を用いた多価ワクチンの開発における治療可能性を強調している。
報告書によると、このエクソソームベースの多価ワクチンは、スパイクおよびヌクレオカプシドSARS-CoV-2タンパク質に対して強力な免疫反応を引き起こすことができるとされている。さらに、このワクチンは広範な反応性を示し、強力なT細胞反応をもたらすことが確認された。
このオープンアクセス論文は、「エクソソームベースの多価ワクチン:ナノグラムのタンパク質で強力な免疫、広範な反応性、および強力なT細胞反応を達成(Exosome-Based Multivalent Vaccine: Achieving Potent Immunization, Broadened Reactivity, and Strong T-Cell Responses with Nanograms of Proteins.」というタイトルで掲載されており、エクソソームプラットフォーム技術を活用した多価ワクチンの有望性を示している。
この報告書の発表により、Capricor TherapeuticsはCOVID-19の治療に向けた新たなアプローチを示し、今後の研究に期待が寄せられることとなった。
Capricorの最高経営責任者であるLinda Marbán博士(写真)は、「エクソソームはドラッグデリバリーへの新しいアプローチを提供し、本研究は多価タンパク質ベースのワクチンを迅速に生成する可能性を示している。」と述べまし
2023年4月27日、Capricor Therapeutics(NASDAQ:CAPR)は、4月24日に発表された前臨床研究に関する報告書を公表した。この報告書は、米国微生物学会の主要な査読付き科学雑誌であるMicrobiology Spectrumに掲載されたものであり、StealthX™エクソソームプラットフォーム技術を用いた多価ワクチンの開発における治療可能性を強調している。
報告書によると、このエクソソームベースの多価ワクチンは、スパイクおよびヌクレオカプシドSARS-CoV-2タンパク質に対して強力な免疫反応を引き起こすことができるとされている。さらに、このワクチンは広範な反応性を示し、強力なT細胞反応をもたらすことが確認された。
このオープンアクセス論文は、「エクソソームベースの多価ワクチン:ナノグラムのタンパク質で強力な免疫、広範な反応性、および強力なT細胞反応を達成(Exosome-Based Multivalent Vaccine: Achieving Potent Immunization, Broadened Reactivity, and Strong T-Cell Responses with Nanograms of Proteins.」というタイトルで掲載されており、エクソソームプラットフォーム技術を活用した多価ワクチンの有望性を示している。
この報告書の発表により、Capricor TherapeuticsはCOVID-19の治療に向けた新たなアプローチを示し、今後の研究に期待が寄せられることとなった。
Capricorの最高経営責任者であるLinda Marbán博士(写真)は、「エクソソームはドラッグデリバリーへの新しいアプローチを提供し、本研究は多価タンパク質ベースのワクチンを迅速に生成する可能性を示している。」と述べまし
人工知能が集中治療室の臨床医の意思決定を支援することができるかどうかが検討された。
 カーネギーメロン大学のHCII(Human-Computer Interaction Institute)の研究者らは、集中治療室の臨床医が24時間監視しながら迅速かつ的確な判断を下す必要があることを指摘している。そこで、ピッツバーグ大学およびUPMCの医師および研究者と共同で、人工知能がこの意思決定プロセスに役立つのか、また臨床医がその支援を信頼するのかについて検討した。
研究チームは、18,000人以上の患者のデータセットでトレーニングされたAI Clinicianモデルを使用して、敗血症の治療に関する推奨事項を提供する対話型臨床意思決定支援(CDS)インターフェースを設計した。このモデルを利用することで、臨床専門家はデータセット内の患者をフィルタリングして検索し、疾患の軌跡を可視化し、モデルの予測とベッドサイドで行われる実際の治療決定とを比較することができる。
HCIIの博士課程の学生で研究チームのメンバーであるヴェンカテッシュ・シバラマン氏は、「臨床医は、AIが自分たちを助けてくれる可能性に興奮しているように感じられるが、これらのAIツールがどのように機能するのかについてはよく知らないかもしれない。」と述べている。しかし、実際にAIベースのツールを利用した結果、ほとんどの医師が意思決定の一部にその支援を取り入れたことがわかったという。
シバラマン氏は、「臨床医は常に、自分が診察した患者に関する多くのデータをコンピュータシステムや電子カルテに入力している。このアイデアは、我々がそのデータの一部から学ぶことで、彼らのプロセスの一部を高速化し、彼らの生活を少し楽にし、また、ケアの一貫性を向上させることができるかもしれないということだ。」と述べ、AIが臨床医の意思決定を支援することで、医療の質を向上させる可能性があることを示唆している。
この研究は、ICUで勤務
カーネギーメロン大学のHCII(Human-Computer Interaction Institute)の研究者らは、集中治療室の臨床医が24時間監視しながら迅速かつ的確な判断を下す必要があることを指摘している。そこで、ピッツバーグ大学およびUPMCの医師および研究者と共同で、人工知能がこの意思決定プロセスに役立つのか、また臨床医がその支援を信頼するのかについて検討した。
研究チームは、18,000人以上の患者のデータセットでトレーニングされたAI Clinicianモデルを使用して、敗血症の治療に関する推奨事項を提供する対話型臨床意思決定支援(CDS)インターフェースを設計した。このモデルを利用することで、臨床専門家はデータセット内の患者をフィルタリングして検索し、疾患の軌跡を可視化し、モデルの予測とベッドサイドで行われる実際の治療決定とを比較することができる。
HCIIの博士課程の学生で研究チームのメンバーであるヴェンカテッシュ・シバラマン氏は、「臨床医は、AIが自分たちを助けてくれる可能性に興奮しているように感じられるが、これらのAIツールがどのように機能するのかについてはよく知らないかもしれない。」と述べている。しかし、実際にAIベースのツールを利用した結果、ほとんどの医師が意思決定の一部にその支援を取り入れたことがわかったという。
シバラマン氏は、「臨床医は常に、自分が診察した患者に関する多くのデータをコンピュータシステムや電子カルテに入力している。このアイデアは、我々がそのデータの一部から学ぶことで、彼らのプロセスの一部を高速化し、彼らの生活を少し楽にし、また、ケアの一貫性を向上させることができるかもしれないということだ。」と述べ、AIが臨床医の意思決定を支援することで、医療の質を向上させる可能性があることを示唆している。
この研究は、ICUで勤務
タスマニアデビルの伝染性がんを初めて解読。詳細な遺伝子地図から腫瘍の起源と今後の進化が示唆された。
 タスマニアデビルは、30年もの間、伝染性の顔面がんと闘ってきた。このがんは、タスマニアデビルの個体群に大きな影響を与えており、その拡散に懸念が寄せられていた。しかし、このたび、がんの包括的な遺伝子解析により、がんの進化を追跡し、今後どのようにがんが広がっていくかを知る手がかりを得ることができた。
本研究は、4月20日付の『Science』誌に掲載され、この病気がどのように発生し、進化し、広がっていったかについて、初めて詳細な知見を得ることができた。キャンベラ大学のゲノム学者であるジャニーン・ディーキン博士は、「ゲノム解析は、過去と未来に対する洞察を与えてくれる。この研究は、科学者が将来タスマニアデビルの個体群にどのような影響を与えるかをモデル化するための基礎となるものだ」と述べている。
「我々は、一緒に働いている敵を理解する必要がある」とディーキン博士は言う。この研究により、タスマニアデビルのがんの進化について、新たな知見が得られたことは、将来的な対策につながると期待されている。サイエンスの論文は「タスマニアデビルの2つの感染性がんの進化について(The Evolution of Two Transmissible Cancers in Tasmanian Devils)」と題されており、この研究が科学界に与える影響は大きいと考えられている。
デビルの病気について
タスマニアデビル(Sarcophilus harrisii)は、オーストラリア南東部のタスマニア島に生息する肉食の有袋類だ。タスマニアデビルには、devil facial tumor 1(DFT1)と悪devil facial tumor 2(DFT2)という、別々に発生した2つのがんがあることが分かっている。タスマニアデビルの個体群は、これらのがんの影響で60〜70%が失われてしまった。このような宿
タスマニアデビルは、30年もの間、伝染性の顔面がんと闘ってきた。このがんは、タスマニアデビルの個体群に大きな影響を与えており、その拡散に懸念が寄せられていた。しかし、このたび、がんの包括的な遺伝子解析により、がんの進化を追跡し、今後どのようにがんが広がっていくかを知る手がかりを得ることができた。
本研究は、4月20日付の『Science』誌に掲載され、この病気がどのように発生し、進化し、広がっていったかについて、初めて詳細な知見を得ることができた。キャンベラ大学のゲノム学者であるジャニーン・ディーキン博士は、「ゲノム解析は、過去と未来に対する洞察を与えてくれる。この研究は、科学者が将来タスマニアデビルの個体群にどのような影響を与えるかをモデル化するための基礎となるものだ」と述べている。
「我々は、一緒に働いている敵を理解する必要がある」とディーキン博士は言う。この研究により、タスマニアデビルのがんの進化について、新たな知見が得られたことは、将来的な対策につながると期待されている。サイエンスの論文は「タスマニアデビルの2つの感染性がんの進化について(The Evolution of Two Transmissible Cancers in Tasmanian Devils)」と題されており、この研究が科学界に与える影響は大きいと考えられている。
デビルの病気について
タスマニアデビル(Sarcophilus harrisii)は、オーストラリア南東部のタスマニア島に生息する肉食の有袋類だ。タスマニアデビルには、devil facial tumor 1(DFT1)と悪devil facial tumor 2(DFT2)という、別々に発生した2つのがんがあることが分かっている。タスマニアデビルの個体群は、これらのがんの影響で60〜70%が失われてしまった。このような宿
幼少期の逆境は、若年層における2型糖尿病発症リスク上昇につながることが判明。
 2023年4月20日にDiabetologia(the European Association for the Study of Diabetes [EASD]の学術誌)に掲載された新しい研究では、小児期に逆境を経験した人は成人期早期に2型糖尿病になるリスクが高いことがわかったという。本研究は、デンマーク・コペンハーゲン大学公衆衛生学部疫学課のレオニー・K・エルセンブルグ助教(写真)らによって行われ、男女の成人期早期(16~38歳)における小児期の逆境と2型糖尿病発症の間に関連性があるかどうかを明らかにすることを目的としている。この論文は、「小児期の逆境と成人期早期の2型糖尿病リスク: 120万人を対象とした人口規模のコホート研究の結果。(Childhood Adversity and Risk of Type 2 Diabetes in Early Adulthood: Results from a Population-Wide Cohort Study of 1.2 Million Individuals.)」と題されている。
青年期および若年成人の2型糖尿病の世界的な有病率は、主にライフスタイルの変化と肥満率によって、過去100年の間に大幅に増加している。特に、早期発症(40歳以前)の場合、病態がより侵襲的であると考えられ、罹患者は現役世代であり、生涯治療を必要とする可能性があり、合併症のリスクが高まるため懸念されている。これらの要因が相まって、成人期早期の2型糖尿病の危険因子を特定することは、公衆衛生上、極めて重要な問題である。
小児期の逆境は、虐待、家族内の身体的・精神的疾患、貧困などの経験を含み、若年成人においても糖尿病の発症と関連している。逆境は、生理的なストレス反応を引き起こし、神経系、ホルモン、身体の免疫反応に影響を及ぼしかねない。また、精神的
2023年4月20日にDiabetologia(the European Association for the Study of Diabetes [EASD]の学術誌)に掲載された新しい研究では、小児期に逆境を経験した人は成人期早期に2型糖尿病になるリスクが高いことがわかったという。本研究は、デンマーク・コペンハーゲン大学公衆衛生学部疫学課のレオニー・K・エルセンブルグ助教(写真)らによって行われ、男女の成人期早期(16~38歳)における小児期の逆境と2型糖尿病発症の間に関連性があるかどうかを明らかにすることを目的としている。この論文は、「小児期の逆境と成人期早期の2型糖尿病リスク: 120万人を対象とした人口規模のコホート研究の結果。(Childhood Adversity and Risk of Type 2 Diabetes in Early Adulthood: Results from a Population-Wide Cohort Study of 1.2 Million Individuals.)」と題されている。
青年期および若年成人の2型糖尿病の世界的な有病率は、主にライフスタイルの変化と肥満率によって、過去100年の間に大幅に増加している。特に、早期発症(40歳以前)の場合、病態がより侵襲的であると考えられ、罹患者は現役世代であり、生涯治療を必要とする可能性があり、合併症のリスクが高まるため懸念されている。これらの要因が相まって、成人期早期の2型糖尿病の危険因子を特定することは、公衆衛生上、極めて重要な問題である。
小児期の逆境は、虐待、家族内の身体的・精神的疾患、貧困などの経験を含み、若年成人においても糖尿病の発症と関連している。逆境は、生理的なストレス反応を引き起こし、神経系、ホルモン、身体の免疫反応に影響を及ぼしかねない。また、精神的
白髪の原因はメラノサイト幹細胞の動きの欠如である可能性が示唆された。
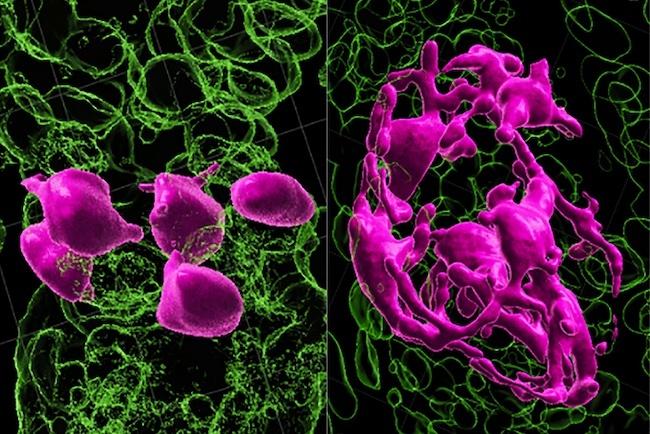 ある種の幹細胞は、毛包内の成長区画間を移動するユニークな能力を持っているが、加齢とともに動けなくなり、成熟して髪の色を維持する能力を失ってしまうことが、新しい研究で明らかになった。ニューヨーク大学グロスマン校医学部の研究者らは、マウスの皮膚にあるメラノサイト幹細胞と呼ばれる細胞に注目した。髪の色は、毛包内にある機能しないが増殖し続けるメラノサイト幹細胞が、色の元となるタンパク質色素を作る成熟細胞になるためのシグナルを受け取るかどうかでコントロールされていると言う。
2023年4月19日付のNatureのオンライン版に掲載された今回の研究では、メラノサイト幹細胞は驚くほど可塑的であることが示された。つまり、毛髪の正常な成長過程において、この細胞は、発育中の毛包の区画間を通過する際に、成熟軸上を絶えず往復するのだ。このような区画の中で、メラノサイト幹細胞は成熟に影響を与えるさまざまなレベルのタンパク質シグナルにさらされる。この論文は「脱分化がメラノサイト幹細胞をダイナミックなニッチに維持する(Dedifferentiation Maintains Melanocyte Stem Cells in a Dynamic Niche)」と題されている。
具体的には、研究チームは、メラノサイト幹細胞が最も原始的な幹細胞の状態と、成熟の次の段階である通過増幅状態の間で、場所によって変化することを発見した。
その結果、研究者らは、毛髪が老化し、抜け落ち、再び成長することを繰り返すにつれて、毛包バルジと呼ばれる幹細胞区画に詰まるメラノサイト幹細胞の数が増加することを発見した。 それらはそこに留まり、通過増幅状態に成熟せず、WNTタンパク質が色素細胞への再生を促したはずの胚芽区画内の元の位置に戻らない。
「本研究は、メラノサイト幹細胞がどのようにして髪に色をつけるのかについての基本
ある種の幹細胞は、毛包内の成長区画間を移動するユニークな能力を持っているが、加齢とともに動けなくなり、成熟して髪の色を維持する能力を失ってしまうことが、新しい研究で明らかになった。ニューヨーク大学グロスマン校医学部の研究者らは、マウスの皮膚にあるメラノサイト幹細胞と呼ばれる細胞に注目した。髪の色は、毛包内にある機能しないが増殖し続けるメラノサイト幹細胞が、色の元となるタンパク質色素を作る成熟細胞になるためのシグナルを受け取るかどうかでコントロールされていると言う。
2023年4月19日付のNatureのオンライン版に掲載された今回の研究では、メラノサイト幹細胞は驚くほど可塑的であることが示された。つまり、毛髪の正常な成長過程において、この細胞は、発育中の毛包の区画間を通過する際に、成熟軸上を絶えず往復するのだ。このような区画の中で、メラノサイト幹細胞は成熟に影響を与えるさまざまなレベルのタンパク質シグナルにさらされる。この論文は「脱分化がメラノサイト幹細胞をダイナミックなニッチに維持する(Dedifferentiation Maintains Melanocyte Stem Cells in a Dynamic Niche)」と題されている。
具体的には、研究チームは、メラノサイト幹細胞が最も原始的な幹細胞の状態と、成熟の次の段階である通過増幅状態の間で、場所によって変化することを発見した。
その結果、研究者らは、毛髪が老化し、抜け落ち、再び成長することを繰り返すにつれて、毛包バルジと呼ばれる幹細胞区画に詰まるメラノサイト幹細胞の数が増加することを発見した。 それらはそこに留まり、通過増幅状態に成熟せず、WNTタンパク質が色素細胞への再生を促したはずの胚芽区画内の元の位置に戻らない。
「本研究は、メラノサイト幹細胞がどのようにして髪に色をつけるのかについての基本
移植可能なナノ流体デバイスでCD40抗体を送達。動物モデルで膵臓腫瘍の縮小が認められた。
 ヒューストン・メソジスト研究所のナノメディシン研究者は、米粒よりも小さな装置で腫瘍に直接免疫療法を行うことにより、最も攻撃的で治療が困難ながんの一つである膵臓がんを克服する可能性を見いだした。ヒューストン・メソジスト・アカデミック・インスティテュートの研究者らは、2023年1月13日にAdvanced Scienceに掲載された論文の中で、彼らが発明した埋め込み型ナノ流体デバイスを使用して、有望な免疫治療薬であるCD40モノクローナル抗体(mAbs)をナノ流体薬剤溶出種子(NDES)を介して低用量で持続投与することについて述べている。その結果、マウスモデルにおいて、従来の全身免疫療法治療と比較して4倍の低用量で腫瘍を縮小させることが判明した。この論文は、「アゴニストCD40抗体の持続的な腫瘍内投与により、膵臓がんにおける免疫抑制的な腫瘍微小環境が克服される(Sustained Intratumoral Administration of Agonist CD40 Antibody Overcomes Immunosuppressive Tumor Microenvironment in Pancreatic Cancer)」と題されている。
「最もエキサイティングな発見の1つは、NDESデバイスが同じ動物モデルの2つの腫瘍のうち1つにしか挿入されていないにも関わらず、デバイスのない腫瘍の縮小が認められたことだ。」と、共著者でヒューストン・メソジストのナノメディシン部門の助教であるコリーヌ・イン・スアン・チュア博士は述べている。「これは、免疫療法による局所治療が、他の腫瘍を標的とする免疫反応を活性化させることができたことを意味する。実際、ある動物モデルは、100日間の観察継続期間中、腫瘍がない状態を維持した。」
膵管腺がん(PDAC)は、進行した段階で診断されることが
ヒューストン・メソジスト研究所のナノメディシン研究者は、米粒よりも小さな装置で腫瘍に直接免疫療法を行うことにより、最も攻撃的で治療が困難ながんの一つである膵臓がんを克服する可能性を見いだした。ヒューストン・メソジスト・アカデミック・インスティテュートの研究者らは、2023年1月13日にAdvanced Scienceに掲載された論文の中で、彼らが発明した埋め込み型ナノ流体デバイスを使用して、有望な免疫治療薬であるCD40モノクローナル抗体(mAbs)をナノ流体薬剤溶出種子(NDES)を介して低用量で持続投与することについて述べている。その結果、マウスモデルにおいて、従来の全身免疫療法治療と比較して4倍の低用量で腫瘍を縮小させることが判明した。この論文は、「アゴニストCD40抗体の持続的な腫瘍内投与により、膵臓がんにおける免疫抑制的な腫瘍微小環境が克服される(Sustained Intratumoral Administration of Agonist CD40 Antibody Overcomes Immunosuppressive Tumor Microenvironment in Pancreatic Cancer)」と題されている。
「最もエキサイティングな発見の1つは、NDESデバイスが同じ動物モデルの2つの腫瘍のうち1つにしか挿入されていないにも関わらず、デバイスのない腫瘍の縮小が認められたことだ。」と、共著者でヒューストン・メソジストのナノメディシン部門の助教であるコリーヌ・イン・スアン・チュア博士は述べている。「これは、免疫療法による局所治療が、他の腫瘍を標的とする免疫反応を活性化させることができたことを意味する。実際、ある動物モデルは、100日間の観察継続期間中、腫瘍がない状態を維持した。」
膵管腺がん(PDAC)は、進行した段階で診断されることが
Cell誌の総説で提示された治療改善のための膵臓がんの特徴とは?
 カリフォルニア大学アーバイン校(UCI)、ミシガン大学、テキサス大学MDアンダーソンがんセンターの科学者らは、膵臓がん研究の分野において大きな貢献をしたことを明らかにした。彼らの新しい研究は、膵臓がんの生物学において、膵臓がんの特徴となり得るいくつかの重要なテーマを提示している。これらのテーマには、ゲノム変化、代謝、腫瘍微小環境、免疫療法、革新的な臨床試験デザインなどが含まれる。この論文は、2023年4月13日付でCell誌に掲載され、「膵臓がん:進歩と挑戦(Pancreatic Cancer:Advances and Challenges)」と題されている。
膵臓がんの大部分を占める膵管腺がんは、最も困難で致命的ながんの1つである。過去数十年にわたり、膵管腺がんの生物学的性質の解明が大幅に進んだにもかかわらず、ほとんどの患者に対する臨床治療には大きなブレークスルーが見られなかった。しかし、著者らは、膵臓がんの特徴として定義した領域での複合的な進歩が、この疾患の治療に変革をもたらすと信じている。
UCI分子生物学・生化学助教授で筆頭著者であるクリストファー・ハルブルック博士は、「膵管腺がんを対象とした初期の取り組みは、この病気の複雑さを非常に単純化しすぎていた。膵臓腫瘍の複雑さを理解するための技術的なブレークスルーに助けられながら、数十年にわたる努力の結果、ようやく患者にとってより良い治療法を開発するためのロードマップを手に入れることができた。そのためには、多角的にアプローチすることが重要であり、できるだけ多くの特徴的な要素を取り入れることが大切だ。」と述べている。
本論文は、膵臓腫瘍の遺伝的発生と病態の進行を支えるコンセンサスモデルを要約している。さらに、膵管腺がんの遺伝的・免疫的特徴、がん代謝、化学療法抵抗性を標的とした治験薬や臨床応用のアプローチの開発など、現在
カリフォルニア大学アーバイン校(UCI)、ミシガン大学、テキサス大学MDアンダーソンがんセンターの科学者らは、膵臓がん研究の分野において大きな貢献をしたことを明らかにした。彼らの新しい研究は、膵臓がんの生物学において、膵臓がんの特徴となり得るいくつかの重要なテーマを提示している。これらのテーマには、ゲノム変化、代謝、腫瘍微小環境、免疫療法、革新的な臨床試験デザインなどが含まれる。この論文は、2023年4月13日付でCell誌に掲載され、「膵臓がん:進歩と挑戦(Pancreatic Cancer:Advances and Challenges)」と題されている。
膵臓がんの大部分を占める膵管腺がんは、最も困難で致命的ながんの1つである。過去数十年にわたり、膵管腺がんの生物学的性質の解明が大幅に進んだにもかかわらず、ほとんどの患者に対する臨床治療には大きなブレークスルーが見られなかった。しかし、著者らは、膵臓がんの特徴として定義した領域での複合的な進歩が、この疾患の治療に変革をもたらすと信じている。
UCI分子生物学・生化学助教授で筆頭著者であるクリストファー・ハルブルック博士は、「膵管腺がんを対象とした初期の取り組みは、この病気の複雑さを非常に単純化しすぎていた。膵臓腫瘍の複雑さを理解するための技術的なブレークスルーに助けられながら、数十年にわたる努力の結果、ようやく患者にとってより良い治療法を開発するためのロードマップを手に入れることができた。そのためには、多角的にアプローチすることが重要であり、できるだけ多くの特徴的な要素を取り入れることが大切だ。」と述べている。
本論文は、膵臓腫瘍の遺伝的発生と病態の進行を支えるコンセンサスモデルを要約している。さらに、膵管腺がんの遺伝的・免疫的特徴、がん代謝、化学療法抵抗性を標的とした治験薬や臨床応用のアプローチの開発など、現在
血液中の糖鎖分子がアルツハイマー病の予知に役立つことが判明
 アルツハイマー病の早期診断と治療には、信頼性が高く、費用対効果の高いスクリーニング方法が必要だ。このたび、スウェーデンのカロリンスカ研究所の研究者らは、血中の糖分子の一種が、重度の認知症の発症に重要な役割を果たすタンパク質であるタウのレベルに関連することを発見した。この研究は、2023年4月12日にAlzheimer's & Dementia誌に掲載され、10年先の発症を予測できる簡単なスクリーニング方法への道を開くことができるという。このオープンアクセス論文は「糖鎖エピトープが血清中のタウと相関し、APOE4アレル状態との組み合わせでアルツハイマー病への進行を予測する(A Glycan Epitope Correlates with Tau in Serum and Predicts Progression to Alzheimer's Disease in Combination with APOE4 Allele Status)」と題されている。
「糖分子で構成される構造体である糖鎖の役割は、認知症研究において比較的未開拓の分野だ。我々は今回の研究で、糖鎖の血中濃度が病気の発症の初期に変化することを実証した。これは、血液検査と記憶力テストだけでアルツハイマー病のリスクを予測できるようになることを意味している。」と、この研究の筆頭著者である、カロリンスカ研究所神経生物学・ケア科学・社会学科(NVS)の医学生で提携研究者のロビン・ズー氏は述べている。
アルツハイマー型認知症では、脳の神経細胞が死滅し、アミロイドβとタウというタンパク質が異常に蓄積されることが原因と考えられている。アルツハイマー病治療薬の臨床試験では、手遅れになる前に、神経細胞が死滅する前の病態の初期段階から治療を開始し、進行を逆転させることが重要であることが示されている。
より多くの血液
アルツハイマー病の早期診断と治療には、信頼性が高く、費用対効果の高いスクリーニング方法が必要だ。このたび、スウェーデンのカロリンスカ研究所の研究者らは、血中の糖分子の一種が、重度の認知症の発症に重要な役割を果たすタンパク質であるタウのレベルに関連することを発見した。この研究は、2023年4月12日にAlzheimer's & Dementia誌に掲載され、10年先の発症を予測できる簡単なスクリーニング方法への道を開くことができるという。このオープンアクセス論文は「糖鎖エピトープが血清中のタウと相関し、APOE4アレル状態との組み合わせでアルツハイマー病への進行を予測する(A Glycan Epitope Correlates with Tau in Serum and Predicts Progression to Alzheimer's Disease in Combination with APOE4 Allele Status)」と題されている。
「糖分子で構成される構造体である糖鎖の役割は、認知症研究において比較的未開拓の分野だ。我々は今回の研究で、糖鎖の血中濃度が病気の発症の初期に変化することを実証した。これは、血液検査と記憶力テストだけでアルツハイマー病のリスクを予測できるようになることを意味している。」と、この研究の筆頭著者である、カロリンスカ研究所神経生物学・ケア科学・社会学科(NVS)の医学生で提携研究者のロビン・ズー氏は述べている。
アルツハイマー型認知症では、脳の神経細胞が死滅し、アミロイドβとタウというタンパク質が異常に蓄積されることが原因と考えられている。アルツハイマー病治療薬の臨床試験では、手遅れになる前に、神経細胞が死滅する前の病態の初期段階から治療を開始し、進行を逆転させることが重要であることが示されている。
より多くの血液
ブロッコリーの摂取が腸内環境を保護し、疾病を減少させることをマウスで確認
 ブロッコリーは、我々の健康に有益であることが知られている。例えば、アブラナ科の野菜を多く摂取すると、がんや2型糖尿病の発症率が低下することが研究で明らかになっている。最近の研究で、ペンシルベニア州立大学の研究者が、ブロッコリーにはマウスの受容体と結合して小腸の粘膜を保護し、病気の発生を抑制する特定の分子があることを発見した。この発見は、ブロッコリーがまさに "スーパーフード "であることを裏付けている。
「ブロッコリーが体に良いということは知っているが、なぜだろう?」と、ペンシルベニア州立大学のH. トーマス&ドロシー・ウィリッツ・ハロウェル農学講座のゲイリー・ペルデュー博士は問いかける。「我々の研究は、ブロッコリーやその他の食品が、マウスやおそらくヒトの健康にどのように役立つかのメカニズムを明らかにするのに役立っている。ブロッコリー、キャベツ、芽キャベツなどのアブラナ科の野菜は、通常の健康的な食生活の一部であるべきだという強い証拠を提供している。」と述べている。
ペルデュー博士によると、小腸の壁は、有益な水分や栄養素を体内に取り込み、害となる食べかすや細菌を防いでいるという。水と栄養を吸収する腸細胞、腸壁に粘液の保護膜を分泌する杯細胞、消化酵素を含むリソソームを分泌するパネス細胞など、腸に並ぶ特定の細胞が、この活動を調節して健康なバランスを保つのに役立っている。
2023年1月10日にLaboratory Investigationに掲載されたこの研究で、ペルデュー博士らは、ブロッコリーに含まれるアリール炭化水素受容体リガンドと呼ばれる分子が、転写因子と呼ばれるタンパク質の一種であるアリール炭化水素受容体(AHR)に結合することを発見した。この結合により、腸内細胞の機能に影響を与える様々な活動が開始されることを発見した。この論文は「アリール炭化水素受容体の活性化
ブロッコリーは、我々の健康に有益であることが知られている。例えば、アブラナ科の野菜を多く摂取すると、がんや2型糖尿病の発症率が低下することが研究で明らかになっている。最近の研究で、ペンシルベニア州立大学の研究者が、ブロッコリーにはマウスの受容体と結合して小腸の粘膜を保護し、病気の発生を抑制する特定の分子があることを発見した。この発見は、ブロッコリーがまさに "スーパーフード "であることを裏付けている。
「ブロッコリーが体に良いということは知っているが、なぜだろう?」と、ペンシルベニア州立大学のH. トーマス&ドロシー・ウィリッツ・ハロウェル農学講座のゲイリー・ペルデュー博士は問いかける。「我々の研究は、ブロッコリーやその他の食品が、マウスやおそらくヒトの健康にどのように役立つかのメカニズムを明らかにするのに役立っている。ブロッコリー、キャベツ、芽キャベツなどのアブラナ科の野菜は、通常の健康的な食生活の一部であるべきだという強い証拠を提供している。」と述べている。
ペルデュー博士によると、小腸の壁は、有益な水分や栄養素を体内に取り込み、害となる食べかすや細菌を防いでいるという。水と栄養を吸収する腸細胞、腸壁に粘液の保護膜を分泌する杯細胞、消化酵素を含むリソソームを分泌するパネス細胞など、腸に並ぶ特定の細胞が、この活動を調節して健康なバランスを保つのに役立っている。
2023年1月10日にLaboratory Investigationに掲載されたこの研究で、ペルデュー博士らは、ブロッコリーに含まれるアリール炭化水素受容体リガンドと呼ばれる分子が、転写因子と呼ばれるタンパク質の一種であるアリール炭化水素受容体(AHR)に結合することを発見した。この結合により、腸内細胞の機能に影響を与える様々な活動が開始されることを発見した。この論文は「アリール炭化水素受容体の活性化
形状変化する新しい抗生物質が致命的な感染症に対抗できるかもしれない
 薬剤耐性菌や真菌は米国だけでも年間約300万人に感染し、約35,000人が死亡している。抗生物質は必要不可欠で有効なものだが、近年、使い過ぎにより一部の細菌が抗生物質に対する耐性を獲得している。このような感染症は治療が困難なため、世界保健機関は抗生物質耐性を世界の公衆衛生上の脅威のトップ10とみなしている。このたび、コールド・スプリング・ハーバー研究所(CSHL)のジョン・E・モーゼス教授(写真)が、こうした薬剤耐性スーパーバグに対する新たな武器として、原子の再配列によって形を変えることのできる抗生物質を開発した。
モーゼス博士は、軍事訓練の戦車を観察しているうちに、変身する抗生物質を思いついた。戦車は回転する砲塔と軽快な動きで、起こりうる脅威に対して迅速に対応することができる。
その数年後、モーゼス博士はブルバレンという分子を見つけた。ブルバレンという分子は、原子の位置が入れ替わる「フラクショナル分子」である。原子の位置を入れ替えることができるため、100万通り以上の形状があり、まさにモーゼス博士が求めていた「流動性」があった。
MRSA、VRSA、VREなどいくつかの細菌は、皮膚感染から髄膜炎まであらゆる治療に使われるバンコマイシンという強力な抗生物質に対する耐性を獲得している。モーゼス博士は、バンコマイシンをブルバレンと組み合わせることで、細菌と闘う性能を向上させることができると考えた。
クリックケミストリーは、ノーベル賞を受賞した高速・高収率の化学反応の一種で、分子同士を確実に「クリック」させることで、より効率的な反応を実現するものだ。
ノーベル賞を2度受賞したK.バリー・シャープレス博士のもとでこの画期的な開発を研究したモーゼス博士は、「クリックケミストリーは素晴らしい。複雑なものを作るのに、確実で最高のチャンスを与えてくれる」と言う。
この技術を
薬剤耐性菌や真菌は米国だけでも年間約300万人に感染し、約35,000人が死亡している。抗生物質は必要不可欠で有効なものだが、近年、使い過ぎにより一部の細菌が抗生物質に対する耐性を獲得している。このような感染症は治療が困難なため、世界保健機関は抗生物質耐性を世界の公衆衛生上の脅威のトップ10とみなしている。このたび、コールド・スプリング・ハーバー研究所(CSHL)のジョン・E・モーゼス教授(写真)が、こうした薬剤耐性スーパーバグに対する新たな武器として、原子の再配列によって形を変えることのできる抗生物質を開発した。
モーゼス博士は、軍事訓練の戦車を観察しているうちに、変身する抗生物質を思いついた。戦車は回転する砲塔と軽快な動きで、起こりうる脅威に対して迅速に対応することができる。
その数年後、モーゼス博士はブルバレンという分子を見つけた。ブルバレンという分子は、原子の位置が入れ替わる「フラクショナル分子」である。原子の位置を入れ替えることができるため、100万通り以上の形状があり、まさにモーゼス博士が求めていた「流動性」があった。
MRSA、VRSA、VREなどいくつかの細菌は、皮膚感染から髄膜炎まであらゆる治療に使われるバンコマイシンという強力な抗生物質に対する耐性を獲得している。モーゼス博士は、バンコマイシンをブルバレンと組み合わせることで、細菌と闘う性能を向上させることができると考えた。
クリックケミストリーは、ノーベル賞を受賞した高速・高収率の化学反応の一種で、分子同士を確実に「クリック」させることで、より効率的な反応を実現するものだ。
ノーベル賞を2度受賞したK.バリー・シャープレス博士のもとでこの画期的な開発を研究したモーゼス博士は、「クリックケミストリーは素晴らしい。複雑なものを作るのに、確実で最高のチャンスを与えてくれる」と言う。
この技術を
がん転移の発生を抑制するSTING細胞シグナル伝達経路の新たな役割を発見
 スローン・ケタリング研究所の科学者チームは、STING細胞シグナル伝達経路が、休眠状態のがん細胞が原発巣から脱出した後、数ヶ月あるいは数年後に攻撃的な腫瘍に進展するのを防ぐ重要な役割を果たすことを明らかにした。この研究成果は、2023年3月29日付のNature誌に掲載され、STINGを活性化する薬剤が、体内の新しい部位へのがんの拡散(転移プロセス)を防ぐのに役立つ可能性を示唆している。この論文は「STINGは肺腺がんにおける休眠状態の転移の再活性化を抑制する(STING Inhibits the Reactivation of Dormant Metastasis in Lung Adenocarcinoma)」と題されている。
肺がんのマウスモデルにおいて、STING経路を刺激する治療は、残存するがん細胞を排除し、攻撃的な転移への進行を防止するのに役立つ。微小転移として知られるこれらの細胞は、個々に、あるいは小さなクラスターで見つかるが、小さすぎて標準的な画像検査では検出できない。「がんによる死亡の大部分は転移によるものだ」と、本研究の上席著者であり、メモリアル・スローン・ケタリングがんセンター(MSK)内の基礎科学とトランスレーショナル研究の拠点であるスローン・ケタリング研究所長のジョーン・マサグエ博士(写真)は「このような細胞が再び出現しないようにしたり、免疫系が排除するのを助けるためにできることがあれば、多くの人に大きな利益をもたらすことができる。この研究により、STINGシグナルが攻撃的な転移の発生を抑制する上で、これまで知られていなかった役割が明らかになった。」と述べている。
マサグエ博士は、がんの転移を調査する研究室を率いる傍ら、MSKのAlan and Sandra Gerry Metastasis and Tumor Ecosystems Cen
スローン・ケタリング研究所の科学者チームは、STING細胞シグナル伝達経路が、休眠状態のがん細胞が原発巣から脱出した後、数ヶ月あるいは数年後に攻撃的な腫瘍に進展するのを防ぐ重要な役割を果たすことを明らかにした。この研究成果は、2023年3月29日付のNature誌に掲載され、STINGを活性化する薬剤が、体内の新しい部位へのがんの拡散(転移プロセス)を防ぐのに役立つ可能性を示唆している。この論文は「STINGは肺腺がんにおける休眠状態の転移の再活性化を抑制する(STING Inhibits the Reactivation of Dormant Metastasis in Lung Adenocarcinoma)」と題されている。
肺がんのマウスモデルにおいて、STING経路を刺激する治療は、残存するがん細胞を排除し、攻撃的な転移への進行を防止するのに役立つ。微小転移として知られるこれらの細胞は、個々に、あるいは小さなクラスターで見つかるが、小さすぎて標準的な画像検査では検出できない。「がんによる死亡の大部分は転移によるものだ」と、本研究の上席著者であり、メモリアル・スローン・ケタリングがんセンター(MSK)内の基礎科学とトランスレーショナル研究の拠点であるスローン・ケタリング研究所長のジョーン・マサグエ博士(写真)は「このような細胞が再び出現しないようにしたり、免疫系が排除するのを助けるためにできることがあれば、多くの人に大きな利益をもたらすことができる。この研究により、STINGシグナルが攻撃的な転移の発生を抑制する上で、これまで知られていなかった役割が明らかになった。」と述べている。
マサグエ博士は、がんの転移を調査する研究室を率いる傍ら、MSKのAlan and Sandra Gerry Metastasis and Tumor Ecosystems Cen
がん遺伝子Mycは、がん細胞表面の糖鎖パターンを変化させ、がん細胞を免疫システムから隠蔽する役割があることが発見された。
 がん遺伝子と呼ばれるがん関連遺伝子は、細胞の成長と分裂を刺激し、腫瘍を膨らませたり広げたりすることがよく知られている。しかし今回、スタンフォード大学医学部とSarafan ChEM-Hの研究者は、Mycと呼ばれる悪名高いがん遺伝子が、成長したがんを免疫システムから隠蔽する直接的な役割を持つことを発見した。Mycはヒトのがんの70%以上と関連しており、これらのがんの偽装を引き剥がすことで、新しいクラスのがん治療につながる可能性があると研究者は考えている。
研究チームは、Mycによるカモフラージュの主要な構成要素が、がん細胞の表面にコーティングされた糖の分子であることを突き止めた。この糖は、通常ならがん細胞を取り込んで破壊するはずのマクロファージと呼ばれる免疫細胞に対して「立ち止まれ」という信号を送る。この発見は、一見無関係に見える2つの過去の観察結果(がん細胞は健康な細胞とは異なり細胞表面の糖のパターンが異なる・がん細胞内の特定のタンパク質の生産を増加させることにより、がん細胞を免疫システムから保護するMycがん遺伝子があること)を結びつけるものである。この関係を解明するためには、糖質化学者で最近ノーベル賞を受賞したキャロライン・ベルトッツィ博士が率いる研究所と、がんの専門家であるディーン・フェルシャー医学博士が率いるスタンフォード大学の2つの研究所が協力する必要があった。
医学と病理学の教授であるフェルシャー博士は、「これは、全く新しいがん治療法につながる可能性が非常に高いと思う」と述べている。フェルシャー博士は、スタンフォード大学トランスレーショナル・リサーチ&アプライド・メディシンセンターの責任者でもあり、医師と基礎科学者が協力して成果を臨床に持ち込むことを奨励している。「多くのがん治療法は、基本的に試行錯誤の末に開発されたが、これは全く違う。我々は、そのメカニ
がん遺伝子と呼ばれるがん関連遺伝子は、細胞の成長と分裂を刺激し、腫瘍を膨らませたり広げたりすることがよく知られている。しかし今回、スタンフォード大学医学部とSarafan ChEM-Hの研究者は、Mycと呼ばれる悪名高いがん遺伝子が、成長したがんを免疫システムから隠蔽する直接的な役割を持つことを発見した。Mycはヒトのがんの70%以上と関連しており、これらのがんの偽装を引き剥がすことで、新しいクラスのがん治療につながる可能性があると研究者は考えている。
研究チームは、Mycによるカモフラージュの主要な構成要素が、がん細胞の表面にコーティングされた糖の分子であることを突き止めた。この糖は、通常ならがん細胞を取り込んで破壊するはずのマクロファージと呼ばれる免疫細胞に対して「立ち止まれ」という信号を送る。この発見は、一見無関係に見える2つの過去の観察結果(がん細胞は健康な細胞とは異なり細胞表面の糖のパターンが異なる・がん細胞内の特定のタンパク質の生産を増加させることにより、がん細胞を免疫システムから保護するMycがん遺伝子があること)を結びつけるものである。この関係を解明するためには、糖質化学者で最近ノーベル賞を受賞したキャロライン・ベルトッツィ博士が率いる研究所と、がんの専門家であるディーン・フェルシャー医学博士が率いるスタンフォード大学の2つの研究所が協力する必要があった。
医学と病理学の教授であるフェルシャー博士は、「これは、全く新しいがん治療法につながる可能性が非常に高いと思う」と述べている。フェルシャー博士は、スタンフォード大学トランスレーショナル・リサーチ&アプライド・メディシンセンターの責任者でもあり、医師と基礎科学者が協力して成果を臨床に持ち込むことを奨励している。「多くのがん治療法は、基本的に試行錯誤の末に開発されたが、これは全く違う。我々は、そのメカニ
MITとハーバード大学の研究者が新しいタンパク質送達方法を開発。がん治療への応用可能性を報告。
 MIT・ハーバード大学ブロード研究所とMITマクガバン脳研究所の研究者は、天然の細菌システムを利用して、ヒトや動物の細胞で機能する新しいタンパク質送達方法を開発した。このシステムは、遺伝子治療やがん治療を安全かつ効率的に行う方法になる可能性がある。この技術は、2023年3月29日付のNature誌に掲載され、遺伝子編集用のものを含む様々なタンパク質を異なる細胞タイプに送達するようにプログラムすることができる。このオープンアクセス論文は「細菌収縮注入システムによるプログラム可能なタンパク質送達(Programmable Protein Delivery with a Bacterial Contractile Injection System)」と題されている。
ブロード研究所メンバーでマクガバン研究所研究員のフェン・チャン博士 (写真)率いる研究チームは、昆虫細胞に自然に結合してタンパク質ペイロードを注入する、細菌が作り出す小さなシリンジ状の注入構造を利用した。研究チームは、人工知能ツールAlphaFoldを使用して、この注射器構造を設計し、ヒト細胞およびマウス細胞の両方にさまざまな有用なタンパク質を送達した。
本研究の筆頭著者であり、チャン博士の研究室の大学院生であるジョセフ・クライツ氏は、「これは、タンパク質工学が自然システムの生物活性を変化させることができるという本当に美しい例だ。私は、タンパク質工学が生物工学や新しい治療システムの開発において有用なツールであることを立証している。」と述べている。
「治療用分子の送達は、医療にとって大きなボトルネックであり、これらの強力な新治療法を体内の正しい細胞に届けるためには、より多くの選択肢が必要だ。自然界がどのようにタンパク質を輸送しているかを学ぶことで、このギャップに対処できる新しいプラットフォームを開発することが
MIT・ハーバード大学ブロード研究所とMITマクガバン脳研究所の研究者は、天然の細菌システムを利用して、ヒトや動物の細胞で機能する新しいタンパク質送達方法を開発した。このシステムは、遺伝子治療やがん治療を安全かつ効率的に行う方法になる可能性がある。この技術は、2023年3月29日付のNature誌に掲載され、遺伝子編集用のものを含む様々なタンパク質を異なる細胞タイプに送達するようにプログラムすることができる。このオープンアクセス論文は「細菌収縮注入システムによるプログラム可能なタンパク質送達(Programmable Protein Delivery with a Bacterial Contractile Injection System)」と題されている。
ブロード研究所メンバーでマクガバン研究所研究員のフェン・チャン博士 (写真)率いる研究チームは、昆虫細胞に自然に結合してタンパク質ペイロードを注入する、細菌が作り出す小さなシリンジ状の注入構造を利用した。研究チームは、人工知能ツールAlphaFoldを使用して、この注射器構造を設計し、ヒト細胞およびマウス細胞の両方にさまざまな有用なタンパク質を送達した。
本研究の筆頭著者であり、チャン博士の研究室の大学院生であるジョセフ・クライツ氏は、「これは、タンパク質工学が自然システムの生物活性を変化させることができるという本当に美しい例だ。私は、タンパク質工学が生物工学や新しい治療システムの開発において有用なツールであることを立証している。」と述べている。
「治療用分子の送達は、医療にとって大きなボトルネックであり、これらの強力な新治療法を体内の正しい細胞に届けるためには、より多くの選択肢が必要だ。自然界がどのようにタンパク質を輸送しているかを学ぶことで、このギャップに対処できる新しいプラットフォームを開発することが
放射線による老化がmiRNAプロファイルを変化させ、老化関連エクソソームががん関連線維化に大きな役割を果たすことが明らかに
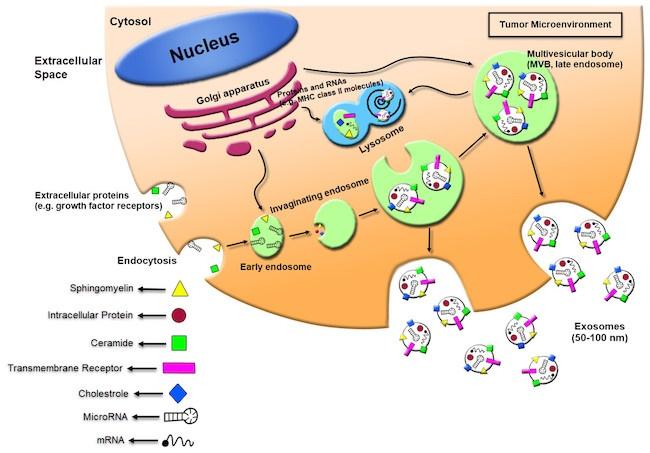 「老化に伴うエクソソームによるmiRNA誘導線維化の隣接細胞への移行について(Senescence-Associated Exosome Transfer miRNA-Induced Fibrosis to Neighboring Cells)」と題された新しい研究論文が2023年3月15日、Agingの15巻5号で発表された。「これは、老化関連エクソソームが、隣接する細胞の浸潤特性を活性化する強力な分泌表現型メディエーターとして機能することを示している。」と著者は述べている。
放射線誘発性線維症は、がんの治療法として最も一般的な放射線治療の副作用である。しかし、放射線は、照射組織に存在する正常細胞においても、p53を介した細胞周期停止、p21の発現延長、老化の進展などを引き起こす。骨髄由来の間葉系幹細胞は、炎症組織や線維化組織への自然なトロピズム(向性)を持つため、原発腫瘍部位に蓄積される。
間葉系幹細胞は低線量の電離放射線に対して極めて敏感であり、傍観者的な放射線影響の結果として老化を獲得する。老化した細胞は代謝的に活発であるが、サイトカイン、線維化促進成長因子、エクソソームの過剰分泌に関連する強力な老化に伴う分泌表現型を発達させる。
統合パスウェイ解析により、放射線誘発性老化は、間葉系幹細胞の細胞周期、細胞外マトリックス、トランスフォーミング成長因子β(TGF-β)シグナル、小胞媒介輸送遺伝子を有意に強化することが明らかになった。エクソソーム は細胞から分泌されるナノベシクル(細胞外小胞のサブクラス)で、細胞間コミュニケーションに重要なタンパク質、RNA、マイクロRNA(miRNA)などの生体物質を含んでいる。 さらに分泌された エクソソームのmiRNA含有量解析から、放射線による老化がmiRNAプロファイルを特異的に変化させていることがわかった。
「実際
「老化に伴うエクソソームによるmiRNA誘導線維化の隣接細胞への移行について(Senescence-Associated Exosome Transfer miRNA-Induced Fibrosis to Neighboring Cells)」と題された新しい研究論文が2023年3月15日、Agingの15巻5号で発表された。「これは、老化関連エクソソームが、隣接する細胞の浸潤特性を活性化する強力な分泌表現型メディエーターとして機能することを示している。」と著者は述べている。
放射線誘発性線維症は、がんの治療法として最も一般的な放射線治療の副作用である。しかし、放射線は、照射組織に存在する正常細胞においても、p53を介した細胞周期停止、p21の発現延長、老化の進展などを引き起こす。骨髄由来の間葉系幹細胞は、炎症組織や線維化組織への自然なトロピズム(向性)を持つため、原発腫瘍部位に蓄積される。
間葉系幹細胞は低線量の電離放射線に対して極めて敏感であり、傍観者的な放射線影響の結果として老化を獲得する。老化した細胞は代謝的に活発であるが、サイトカイン、線維化促進成長因子、エクソソームの過剰分泌に関連する強力な老化に伴う分泌表現型を発達させる。
統合パスウェイ解析により、放射線誘発性老化は、間葉系幹細胞の細胞周期、細胞外マトリックス、トランスフォーミング成長因子β(TGF-β)シグナル、小胞媒介輸送遺伝子を有意に強化することが明らかになった。エクソソーム は細胞から分泌されるナノベシクル(細胞外小胞のサブクラス)で、細胞間コミュニケーションに重要なタンパク質、RNA、マイクロRNA(miRNA)などの生体物質を含んでいる。 さらに分泌された エクソソームのmiRNA含有量解析から、放射線による老化がmiRNAプロファイルを特異的に変化させていることがわかった。
「実際
T細胞の "疲弊 "の原因を特定。CAR-T細胞治療薬の効力が失われるのを防ぐ道が開ける。
 がん細胞を攻撃するようにカスタムメイドされたCAR-T細胞療法は、ヒトのがん、特に血液悪性腫瘍の治療に新しい時代を切り開いた。しかし、CAR-T細胞は、体内の免疫系細胞から受け継いだ、がんを退治する力が激減してしまう『疲弊』を示すことが多い。疲弊は、がん闘病中のT細胞だけでなく、ヒト免疫不全ウイルス(HIV)、B/C型肝炎ウイルス(HBV、HCV)、COVID-19(SARS-CoV-2)などのウイルス感染でも頻繁に見られる。この無気力状態は、一部の患者においてCAR-T細胞療法の効果を低下させ、科学者たちにその原因を探らせるきっかけとなった。ダナファーバーがん研究所とニューヨーク大学グロスマン校の科学者らは、新しい研究で、mSWI/SNF(またはBAF)複合体と呼ばれる細胞の核にある特殊なタンパク質群が、T細胞を活性化してがんを攻撃し、疲弊を引き起こす司令塔としての役割を果たしていることを示した。
この発見は、2023年3月20日にMolecular Cell誌のオンライン版で報告され、CRISPRなどの遺伝子切断技術や標的薬によってこれらの複合体の一部を標的とすることで消耗を抑え、CAR-T細胞(一般的には、すべての腫瘍と戦うT細胞)に、がんに立ち向かう持続力を与えることができると示唆された。このオープンアクセス論文は「MSWI/SNFファミリーのクロマチンリモデリング複合体の段階的な活性化がT細胞の活性化と疲弊を誘導する(Stepwise Activities of mSWI/SNF Family Chromatin Remodeling Complexes Direct T Cell Activation and Exhaustion)」と題されている。
この研究の上級著者である、ダナファーバーがん研究所およびMIT・ハーバード大学ブロード研究所のシガール・
がん細胞を攻撃するようにカスタムメイドされたCAR-T細胞療法は、ヒトのがん、特に血液悪性腫瘍の治療に新しい時代を切り開いた。しかし、CAR-T細胞は、体内の免疫系細胞から受け継いだ、がんを退治する力が激減してしまう『疲弊』を示すことが多い。疲弊は、がん闘病中のT細胞だけでなく、ヒト免疫不全ウイルス(HIV)、B/C型肝炎ウイルス(HBV、HCV)、COVID-19(SARS-CoV-2)などのウイルス感染でも頻繁に見られる。この無気力状態は、一部の患者においてCAR-T細胞療法の効果を低下させ、科学者たちにその原因を探らせるきっかけとなった。ダナファーバーがん研究所とニューヨーク大学グロスマン校の科学者らは、新しい研究で、mSWI/SNF(またはBAF)複合体と呼ばれる細胞の核にある特殊なタンパク質群が、T細胞を活性化してがんを攻撃し、疲弊を引き起こす司令塔としての役割を果たしていることを示した。
この発見は、2023年3月20日にMolecular Cell誌のオンライン版で報告され、CRISPRなどの遺伝子切断技術や標的薬によってこれらの複合体の一部を標的とすることで消耗を抑え、CAR-T細胞(一般的には、すべての腫瘍と戦うT細胞)に、がんに立ち向かう持続力を与えることができると示唆された。このオープンアクセス論文は「MSWI/SNFファミリーのクロマチンリモデリング複合体の段階的な活性化がT細胞の活性化と疲弊を誘導する(Stepwise Activities of mSWI/SNF Family Chromatin Remodeling Complexes Direct T Cell Activation and Exhaustion)」と題されている。
この研究の上級著者である、ダナファーバーがん研究所およびMIT・ハーバード大学ブロード研究所のシガール・
ベートーヴェンの毛髪からDNAを解析。彼が死に至った原因に迫る。
 1802年、ルートヴィヒ・ヴァン・ベートーヴェンは、自分の死後、自分の病気である進行性の難聴について主治医のJ.A.シュミットから世間に説明するよう、兄弟に依頼した。それから2世紀以上が経ち、2023年3月22日付の学術誌Current Biologyに掲載された論文で研究チームは、彼の髪の毛から採取したDNAを分析することで、彼の願いを一部実現した。このオープンアクセス論文は「ルートヴィヒ・ヴァン・ベートーヴェンの毛髪のゲノム解析(Genomic Analyses of Hair from Ludwig van Beethoven)」と題されている。
「この難聴は、1820年代半ばから後半に始まり、1818年には機能的に聞こえなくなったことで有名だ。」と、ドイツ・ライプチヒのマックスプランク進化人類学研究所のヨハネス・クラウス博士は述べている。
「ベートーベンの難聴や胃腸障害について、決定的な原因を見つけることはできなかった。しかし、肝疾患の重大な遺伝的危険因子をいくつも発見することができた。また、遅くとも最期を迎える前の数ヶ月前に、少なくともB型肝炎ウイルスに感染していた証拠も見つかった。それらが彼の死につながったと思われる。」とクラウス博士は述べている。
DNAを分析する際によくあることだが、研究者はもう一つの驚きを発見した。ベートーベンのY染色体は、同じ姓を持ち、家系図からベートーベンの父系と共通の祖先を持つ現代の親族5人のいずれとも一致しないのである。このことは、ベートーヴェンの父方の何世代か前に、婚外恋愛の出来事があったことを示唆している。
「この発見は、1572年頃にベルギーのカンペンハウトでヘンドリック・ファン・ベートーヴェンが受胎してから、7世代後の1770年にドイツのボンでルートヴィヒ・ファン・ベートーヴェンが受胎するまでの間に、彼の父系に対
1802年、ルートヴィヒ・ヴァン・ベートーヴェンは、自分の死後、自分の病気である進行性の難聴について主治医のJ.A.シュミットから世間に説明するよう、兄弟に依頼した。それから2世紀以上が経ち、2023年3月22日付の学術誌Current Biologyに掲載された論文で研究チームは、彼の髪の毛から採取したDNAを分析することで、彼の願いを一部実現した。このオープンアクセス論文は「ルートヴィヒ・ヴァン・ベートーヴェンの毛髪のゲノム解析(Genomic Analyses of Hair from Ludwig van Beethoven)」と題されている。
「この難聴は、1820年代半ばから後半に始まり、1818年には機能的に聞こえなくなったことで有名だ。」と、ドイツ・ライプチヒのマックスプランク進化人類学研究所のヨハネス・クラウス博士は述べている。
「ベートーベンの難聴や胃腸障害について、決定的な原因を見つけることはできなかった。しかし、肝疾患の重大な遺伝的危険因子をいくつも発見することができた。また、遅くとも最期を迎える前の数ヶ月前に、少なくともB型肝炎ウイルスに感染していた証拠も見つかった。それらが彼の死につながったと思われる。」とクラウス博士は述べている。
DNAを分析する際によくあることだが、研究者はもう一つの驚きを発見した。ベートーベンのY染色体は、同じ姓を持ち、家系図からベートーベンの父系と共通の祖先を持つ現代の親族5人のいずれとも一致しないのである。このことは、ベートーヴェンの父方の何世代か前に、婚外恋愛の出来事があったことを示唆している。
「この発見は、1572年頃にベルギーのカンペンハウトでヘンドリック・ファン・ベートーヴェンが受胎してから、7世代後の1770年にドイツのボンでルートヴィヒ・ファン・ベートーヴェンが受胎するまでの間に、彼の父系に対
香りを理解する:嗅覚の分子イメージの解明により、新しい香りの創造に扉が開かれる
 カリフォルニア大学サンフランシスコ校(UCSF)の科学者は、嗅覚の理解における長年の行き詰まりを打破するために、匂い分子がヒトの匂い受容体を活性化する様子を分子レベルの立体画像として初めて作成した。この研究成果は、2023年3月15日にNature のオンライン版に掲載された。香水や食品科学など、嗅覚の科学への関心が再び高まることが期待されている。嗅覚受容体(嗅覚細胞の表面で匂い分子と結合するタンパク質)は、我々の体内で最も大きく、最も多様な受容体ファミリーの半分を占めており、その深い理解は、さまざまな生物学的プロセスに関する新しい洞察への道を開くだろう。
「化学者が分子を設計し、それがどのような香りを放つかを予測できるようにすることは、以前からこの分野の大きな目標だった。」と、この研究の筆頭著者である医薬化学准教授のアーシシュ・マングリク博士は語った。
「というのも、絵がなければ、匂い分子が対応する匂い受容体とどのように反応するかがわからないからだ。」
チーズの香りを絵に描いたような作品
匂いには、約400のユニークな受容体が関係している。我々が感じることのできる何十万もの香りは、それぞれ異なる匂い分子の混合物でできている。それぞれの分子は、さまざまな受容体によって検出されるため、新しい香りを嗅ぐたびに、脳はパズルを解くような感覚を覚える。
「ピアノの鍵盤を叩いて和音を出すようなものだ。」と、デューク大学分子遺伝学・微生物学教授で、マングリック博士の共同研究者である松波宏明博士は語っている。松波博士は過去20年間、嗅覚の解読に重点を置いて研究してきた。「臭気受容体がどのように臭気物質と結合するかを見ることで、これがどのように機能するかを基本的なレベルで説明することができる」。
この画像を作成するために、マングリク博士の研究室では、原子構造を見たり、タンパク
カリフォルニア大学サンフランシスコ校(UCSF)の科学者は、嗅覚の理解における長年の行き詰まりを打破するために、匂い分子がヒトの匂い受容体を活性化する様子を分子レベルの立体画像として初めて作成した。この研究成果は、2023年3月15日にNature のオンライン版に掲載された。香水や食品科学など、嗅覚の科学への関心が再び高まることが期待されている。嗅覚受容体(嗅覚細胞の表面で匂い分子と結合するタンパク質)は、我々の体内で最も大きく、最も多様な受容体ファミリーの半分を占めており、その深い理解は、さまざまな生物学的プロセスに関する新しい洞察への道を開くだろう。
「化学者が分子を設計し、それがどのような香りを放つかを予測できるようにすることは、以前からこの分野の大きな目標だった。」と、この研究の筆頭著者である医薬化学准教授のアーシシュ・マングリク博士は語った。
「というのも、絵がなければ、匂い分子が対応する匂い受容体とどのように反応するかがわからないからだ。」
チーズの香りを絵に描いたような作品
匂いには、約400のユニークな受容体が関係している。我々が感じることのできる何十万もの香りは、それぞれ異なる匂い分子の混合物でできている。それぞれの分子は、さまざまな受容体によって検出されるため、新しい香りを嗅ぐたびに、脳はパズルを解くような感覚を覚える。
「ピアノの鍵盤を叩いて和音を出すようなものだ。」と、デューク大学分子遺伝学・微生物学教授で、マングリック博士の共同研究者である松波宏明博士は語っている。松波博士は過去20年間、嗅覚の解読に重点を置いて研究してきた。「臭気受容体がどのように臭気物質と結合するかを見ることで、これがどのように機能するかを基本的なレベルで説明することができる」。
この画像を作成するために、マングリク博士の研究室では、原子構造を見たり、タンパク
極めて長い尾を持つ“ラプンツェル”バクテリオファージの構造が示す進化論的な奇妙さ
 2023年2月13日にJournal of Biological Chemistry誌に掲載された最新の研究により、進化の驚異である非常に長い尾を持つバクテリオファージの秘密が明らかになった。この驚異的な尾は、人間を寄せ付けない温泉地に生息し、地球上で最も手強い細菌を捕食するバクテリオファージの一種である。バクテリオファージは、細菌に感染して複製するウイルス群で、地球上で最も一般的で多様なものである。「バクテリオファージ、略してファージは、あなたの周りの土や水、そしてあなた自身の体の微生物生態系も含めて、バクテリアがいるあらゆる場所に存在している。」と、UMass Chan医科大学の大学院生で、この研究の主執筆者のエミリー・アグロ氏は言う。
このJBCの論文は「コンフォメーションダイナミクス制御による超長尺バクテリオファージ尾部チューブの構築(Conformational Dynamics Control Assembly of an Extremely Long Bacteriophage Tail Tube)」と題されている。
ファージは、ヒトや動物に感染する多くのウイルスが1つの区画しか持たないのとは異なり、核酸を含むトゲトゲのようなプリズム状のタンパク質の殻に尾が付いた構造になっている。
ファージの尾は、髪型のように長さやスタイルが様々で、長くて弾むようなものもあれば、短くて硬いものもある。ほとんどのファージが短くて微細な尾を持つのに対し、「ラプンツェル・バクテリオファージ」P74-26の尾は他のファージの10倍も長く、長さは1マイクロメートル近く、蜘蛛の糸の幅ほどもある。 「ラプンツェル」という名前は、髪の非常に長い少女が悪い魔女によって塔に閉じ込められたというおとぎ話に由来している。
この研究を監督したUMass Chanの生化学・分子生物学准教授で
2023年2月13日にJournal of Biological Chemistry誌に掲載された最新の研究により、進化の驚異である非常に長い尾を持つバクテリオファージの秘密が明らかになった。この驚異的な尾は、人間を寄せ付けない温泉地に生息し、地球上で最も手強い細菌を捕食するバクテリオファージの一種である。バクテリオファージは、細菌に感染して複製するウイルス群で、地球上で最も一般的で多様なものである。「バクテリオファージ、略してファージは、あなたの周りの土や水、そしてあなた自身の体の微生物生態系も含めて、バクテリアがいるあらゆる場所に存在している。」と、UMass Chan医科大学の大学院生で、この研究の主執筆者のエミリー・アグロ氏は言う。
このJBCの論文は「コンフォメーションダイナミクス制御による超長尺バクテリオファージ尾部チューブの構築(Conformational Dynamics Control Assembly of an Extremely Long Bacteriophage Tail Tube)」と題されている。
ファージは、ヒトや動物に感染する多くのウイルスが1つの区画しか持たないのとは異なり、核酸を含むトゲトゲのようなプリズム状のタンパク質の殻に尾が付いた構造になっている。
ファージの尾は、髪型のように長さやスタイルが様々で、長くて弾むようなものもあれば、短くて硬いものもある。ほとんどのファージが短くて微細な尾を持つのに対し、「ラプンツェル・バクテリオファージ」P74-26の尾は他のファージの10倍も長く、長さは1マイクロメートル近く、蜘蛛の糸の幅ほどもある。 「ラプンツェル」という名前は、髪の非常に長い少女が悪い魔女によって塔に閉じ込められたというおとぎ話に由来している。
この研究を監督したUMass Chanの生化学・分子生物学准教授で
ハイイロゴケグモの攻撃性がクロゴケグモ減少の原因か?ハイイロゴケグモが積極的に近くのクロゴケグモを探して殺すという新たな研究結果
 毒グモとして知られているクロゴケグモは、その毒々しい咬みつきから恐ろしい存在として知られている。しかし、アメリカ南部では、このクモは仲間に嫌われることを恐れているという。過去数十年の間に、クロゴケグモが同じゴケグモ属の仲間であるハイイロゴケグモに駆逐されていることに研究者は気付いていたが、新しい研究によると、これは単に食物や生息地をめぐる競争に一方の種が勝利したという単純なケースではないことが示唆された。ある研究によると、ハイイロゴケグモは近くにいるクロゴケグモを探し出して殺すという顕著な性質があることがわかった。
コンテナ生息のハイイロゴケグモと関連種のヒメグモ科を合わせた実験では、ハイイロゴケグモは他の関連種よりも6.6倍もクロゴケグモを殺す確率が高かった。南フロリダ大学(USF)の研究者が行ったこの研究結果は、2023年3月13日付けでAnnals of the Entomological Society of America に掲載された。このオープンアクセス論文は「導入されたハイイロゴケグモ (クモ目: ヒメグモ科) による捕食は、都市部の生息地における在来のクロゴケグモの局所的絶滅を説明できる可能性がある(Predation by the Introduced Brown Widow Spider (Araneae: Theridiidae) May Explain Local Extinctions of Native Black Widows in Urban Habitats)」と題されている。
「我々は、クロゴケグモに対して非常に攻撃的である一方、同じ科の他のクモに対しては非常に寛容であるというハイイロゴケグモの行動を立証した。」と、USFの学部研究の一環としてこの研究を主導したルイス・コティキオ氏は言う。
ハイイロゴケグモ(Latrodect
毒グモとして知られているクロゴケグモは、その毒々しい咬みつきから恐ろしい存在として知られている。しかし、アメリカ南部では、このクモは仲間に嫌われることを恐れているという。過去数十年の間に、クロゴケグモが同じゴケグモ属の仲間であるハイイロゴケグモに駆逐されていることに研究者は気付いていたが、新しい研究によると、これは単に食物や生息地をめぐる競争に一方の種が勝利したという単純なケースではないことが示唆された。ある研究によると、ハイイロゴケグモは近くにいるクロゴケグモを探し出して殺すという顕著な性質があることがわかった。
コンテナ生息のハイイロゴケグモと関連種のヒメグモ科を合わせた実験では、ハイイロゴケグモは他の関連種よりも6.6倍もクロゴケグモを殺す確率が高かった。南フロリダ大学(USF)の研究者が行ったこの研究結果は、2023年3月13日付けでAnnals of the Entomological Society of America に掲載された。このオープンアクセス論文は「導入されたハイイロゴケグモ (クモ目: ヒメグモ科) による捕食は、都市部の生息地における在来のクロゴケグモの局所的絶滅を説明できる可能性がある(Predation by the Introduced Brown Widow Spider (Araneae: Theridiidae) May Explain Local Extinctions of Native Black Widows in Urban Habitats)」と題されている。
「我々は、クロゴケグモに対して非常に攻撃的である一方、同じ科の他のクモに対しては非常に寛容であるというハイイロゴケグモの行動を立証した。」と、USFの学部研究の一環としてこの研究を主導したルイス・コティキオ氏は言う。
ハイイロゴケグモ(Latrodect
肥満の根本原因にアプローチする天然由来ペプチド‘PEPITEM’:肥満が代謝に与える影響を予防・改善する可能性を示す新たな成果
 2023年3月9日に発表された研究によると、PEPITEMと呼ばれるペプチドが、2型糖尿病や肝性脂肪症(脂肪肝)などの肥満に関連する疾患のリスクを低減する画期的なアプローチとなる可能性が示された。研究チームは、肥満の動物モデルを用いて、徐放性ポンプによって投与されるPEPITEMが、高脂肪食が膵臓に及ぼす影響を予防または逆転させることができるかどうかを調べた。その結果、PEPITEMの投与により、膵臓のインスリン産生細胞の肥大が有意に抑制され、また、様々な組織への免疫細胞の移動が有意に抑制されることが確認された。
この研究は、バーミンガム大学 炎症・老化研究所および心臓血管科学研究所のヘレン・マクゲトリック博士とアシフ・イクバル博士が率いたものだ。 マクゲトリック博士は次のように述べている:「我々は、全身性の炎症によるダメージを防ぐことで、肥満に関連する症状の根本原因に取り組む新薬を提供できる、新しい治療法を発見した。」
PEPITEMは、2015年にバーミンガム大学の研究者が初めて同定し、自己免疫疾患や慢性炎症性疾患の発症や重症化の抑制に関わるアディポネクチン-PEPITEM経路での役割を解明した。
肥満は、脂肪組織の代謝に複雑かつ劇的な変化をもたらし、膵臓にダメージを与え、インスリン感受性を低下させ、最終的には2型糖尿病の基礎となる高血糖を引き起こす。また、肥満は体全体に低レベルの炎症反応を引き起こし、内臓脂肪組織(肝臓や腸などの臓器を包む体内深部の脂肪)や腹膜腔(腸を包む薄い膜)を含む多くの組織に白血球の侵入を促す。
Clinical and Experimental Immunology誌に掲載された最新の研究では、アディポネクチン-PEPITEM経路が、肥満とそれに伴う低レベルの炎症反応、そして糖尿病に先行する膵臓の変化も結びつけていることが示された。
2023年3月9日に発表された研究によると、PEPITEMと呼ばれるペプチドが、2型糖尿病や肝性脂肪症(脂肪肝)などの肥満に関連する疾患のリスクを低減する画期的なアプローチとなる可能性が示された。研究チームは、肥満の動物モデルを用いて、徐放性ポンプによって投与されるPEPITEMが、高脂肪食が膵臓に及ぼす影響を予防または逆転させることができるかどうかを調べた。その結果、PEPITEMの投与により、膵臓のインスリン産生細胞の肥大が有意に抑制され、また、様々な組織への免疫細胞の移動が有意に抑制されることが確認された。
この研究は、バーミンガム大学 炎症・老化研究所および心臓血管科学研究所のヘレン・マクゲトリック博士とアシフ・イクバル博士が率いたものだ。 マクゲトリック博士は次のように述べている:「我々は、全身性の炎症によるダメージを防ぐことで、肥満に関連する症状の根本原因に取り組む新薬を提供できる、新しい治療法を発見した。」
PEPITEMは、2015年にバーミンガム大学の研究者が初めて同定し、自己免疫疾患や慢性炎症性疾患の発症や重症化の抑制に関わるアディポネクチン-PEPITEM経路での役割を解明した。
肥満は、脂肪組織の代謝に複雑かつ劇的な変化をもたらし、膵臓にダメージを与え、インスリン感受性を低下させ、最終的には2型糖尿病の基礎となる高血糖を引き起こす。また、肥満は体全体に低レベルの炎症反応を引き起こし、内臓脂肪組織(肝臓や腸などの臓器を包む体内深部の脂肪)や腹膜腔(腸を包む薄い膜)を含む多くの組織に白血球の侵入を促す。
Clinical and Experimental Immunology誌に掲載された最新の研究では、アディポネクチン-PEPITEM経路が、肥満とそれに伴う低レベルの炎症反応、そして糖尿病に先行する膵臓の変化も結びつけていることが示された。
アルツハイマー病治療の新ターゲットとして、メッセンジャーRNAの改変が有望
 重要なメッセンジャーRNAのメチル化を減らすと、マクロファージの脳への移動が促進され、マウスモデルでアルツハイマー病の症状が改善することが、中国陝西省西安市の空軍医科大学のRui Zhang氏らによるオープンアクセス誌PLOS Biologyで2023年3月7日に発表された。この結果は、末梢性免疫細胞の脳への侵入経路の一つを明らかにしたもので、アルツハイマー病治療の新たなターゲットとなる可能性がある。この論文は「単球由来マクロファージにおけるm6Aメチル基転移酵素METTL3の欠損は、マウスのアルツハイマー病病態を改善させる(Loss of the m6A Methyltransferase METTL3 in Monocyte-Derived Macrophages Ameliorates Alzheimer's Disease Pathology in Mice)」と題されている。
アルツハイマー病の発症の引き金となるのは、脳内に蓄積されたタンパク質性の細胞外アミロイドベータ斑と推定されている。アミロイドベータが高濃度に蓄積されたマウスでは、ヒトのアルツハイマー病を彷彿とさせる神経変性や認知症状が見られることから、アミロイドベータの減少が新たな治療法開発の大きな目標となっている。
アミロイドベータを除去する経路の一つとして、血液由来のミエロイド細胞が脳内に移動し、マクロファージに成熟して、常在するミクログリアとともにアミロイドベータを消費することが考えられる。この移動は、複数の相互作用するプレーヤーによって制御される複雑な現象であるが、潜在的に重要なのは、骨髄細胞内のメッセンジャーRNAのメチル化である。
そこで著者らはまず、骨髄細胞におけるMETTL3の欠損が、アルツハイマー病モデルマウスの認知機能に何らかの影響を及ぼすかどうかを検討した。その結果、METT
重要なメッセンジャーRNAのメチル化を減らすと、マクロファージの脳への移動が促進され、マウスモデルでアルツハイマー病の症状が改善することが、中国陝西省西安市の空軍医科大学のRui Zhang氏らによるオープンアクセス誌PLOS Biologyで2023年3月7日に発表された。この結果は、末梢性免疫細胞の脳への侵入経路の一つを明らかにしたもので、アルツハイマー病治療の新たなターゲットとなる可能性がある。この論文は「単球由来マクロファージにおけるm6Aメチル基転移酵素METTL3の欠損は、マウスのアルツハイマー病病態を改善させる(Loss of the m6A Methyltransferase METTL3 in Monocyte-Derived Macrophages Ameliorates Alzheimer's Disease Pathology in Mice)」と題されている。
アルツハイマー病の発症の引き金となるのは、脳内に蓄積されたタンパク質性の細胞外アミロイドベータ斑と推定されている。アミロイドベータが高濃度に蓄積されたマウスでは、ヒトのアルツハイマー病を彷彿とさせる神経変性や認知症状が見られることから、アミロイドベータの減少が新たな治療法開発の大きな目標となっている。
アミロイドベータを除去する経路の一つとして、血液由来のミエロイド細胞が脳内に移動し、マクロファージに成熟して、常在するミクログリアとともにアミロイドベータを消費することが考えられる。この移動は、複数の相互作用するプレーヤーによって制御される複雑な現象であるが、潜在的に重要なのは、骨髄細胞内のメッセンジャーRNAのメチル化である。
そこで著者らはまず、骨髄細胞におけるMETTL3の欠損が、アルツハイマー病モデルマウスの認知機能に何らかの影響を及ぼすかどうかを検討した。その結果、METT
チェルノブイリの野良犬が教えてくれる、汚染環境下でのサバイバル術
 ノースカロライナ州立大学、コロンビア大学メールマン公衆衛生大学院、サウスカロライナ大学、米国国立衛生研究所の研究者は、放射線、重金属、有毒化学物質への曝露など激しい環境圧力に犬や人間がどのように適応するかを解明する第一歩として、チェルノブイリ原子炉跡地と16.5km離れたチェルノブイリ市内の2つの隔離区域内に住む犬のグループ間で遺伝的に大きな違いがあることを明らかにした。この結果は、これらがほとんど交雑しない2つの異なる集団であることを示している。先行研究では、チェルノブイリ原子力発電所事故が様々な種類の野生生物に与えた影響に焦点が当てられていたが、チェルノブイリ原子力発電所周辺に住む野良犬の遺伝子構造を調査したのは今回が初めてである。
1986年のチェルノブイリ原子力発電所事故は、30万人以上の周辺住民を避難させ、被害を受けた原子炉施設を囲む半径約30kmの「立ち入り禁止区域」を設定するに至った。大惨事の直接的原因は、大気、水、土壌に大量の電離放射線を放出する水蒸気爆発だったが、事故による環境被害は放射線被ばくだけではない。化学物質、有害金属、農薬、有機化合物は、長年にわたる清掃作業や、近くの廃墟となったプリピャチ市やドゥガ1軍事基地など、放置され朽ちた構造物から残され、生態系と環境災害の原因となっている。
コロンビア・メールマン公衆衛生大学院の環境健康科学助教授であるノーマン・J・クライマン博士(共著者)は、「どうにかして、2つの小さな犬の集団が、その毒性の強い環境の中で生き延びることができた」と述べている。「両地点におけるこれらの犬の集団動態を分類することに加え、複数の環境有害物質への慢性的な曝露がこれらの集団にどのような影響を与えたかを理解するための第一歩を踏み出した。」
「ここでの包括的な疑問は、このような大規模な環境災害は、その地域の生活に遺伝的影響を
ノースカロライナ州立大学、コロンビア大学メールマン公衆衛生大学院、サウスカロライナ大学、米国国立衛生研究所の研究者は、放射線、重金属、有毒化学物質への曝露など激しい環境圧力に犬や人間がどのように適応するかを解明する第一歩として、チェルノブイリ原子炉跡地と16.5km離れたチェルノブイリ市内の2つの隔離区域内に住む犬のグループ間で遺伝的に大きな違いがあることを明らかにした。この結果は、これらがほとんど交雑しない2つの異なる集団であることを示している。先行研究では、チェルノブイリ原子力発電所事故が様々な種類の野生生物に与えた影響に焦点が当てられていたが、チェルノブイリ原子力発電所周辺に住む野良犬の遺伝子構造を調査したのは今回が初めてである。
1986年のチェルノブイリ原子力発電所事故は、30万人以上の周辺住民を避難させ、被害を受けた原子炉施設を囲む半径約30kmの「立ち入り禁止区域」を設定するに至った。大惨事の直接的原因は、大気、水、土壌に大量の電離放射線を放出する水蒸気爆発だったが、事故による環境被害は放射線被ばくだけではない。化学物質、有害金属、農薬、有機化合物は、長年にわたる清掃作業や、近くの廃墟となったプリピャチ市やドゥガ1軍事基地など、放置され朽ちた構造物から残され、生態系と環境災害の原因となっている。
コロンビア・メールマン公衆衛生大学院の環境健康科学助教授であるノーマン・J・クライマン博士(共著者)は、「どうにかして、2つの小さな犬の集団が、その毒性の強い環境の中で生き延びることができた」と述べている。「両地点におけるこれらの犬の集団動態を分類することに加え、複数の環境有害物質への慢性的な曝露がこれらの集団にどのような影響を与えたかを理解するための第一歩を踏み出した。」
「ここでの包括的な疑問は、このような大規模な環境災害は、その地域の生活に遺伝的影響を
ニューヨークのドブネズミがSARS-CoV-2を媒介することを示唆する研究結果
 ネズミがSARS-CoV-2のアルファ、デルタ、オミクロン変種に感染しやすく、ニューヨーク市の市営下水道などにいる野生のネズミがSARS-CoV-2に曝露していることが、新たな研究で明らかになった。本研究は、2023年3月9日、米国微生物学会のオープンアクセスジャーナルであるmBio誌に掲載された。この論文は「ニューヨーク市産ドブネズミ(Rattus norvegicus)におけるSARS-CoV-2曝露について/SARS-CoV-2 Exposure in Norway Rats (Rattus norvegicus) from New York City」と題されている。
ミズーリ大学のインフルエンザ・新興感染症センター教授兼センター長である研究代表者のヘンリー・ワン博士は、「今回の発見は、ヒトへの二次的な人獣共通感染症の可能性について、ネズミ集団におけるSARS-CoV-2をさらに監視する必要性を強調している」と語っている。「この分野での我々の研究は、動物がパンデミックに影響を与える可能性があることを示している。我々は、人と動物の両方の健康を守るために、さらなる理解が必要だと考えている。」
ネズミは、米国の都市部に広く分布している。例えば、ニューヨーク市だけでも約800万匹の野生のネズミが生息している。これらの野生のネズミは、人間と接近する機会が十分にある。アジア(香港)とヨーロッパ(ベルギー)のネズミがSARS-CoV-2に暴露されたことを示唆する2つの先行研究があるが、これらのネズミがどちらの研究でもどのSARS-CoV-2変異型に暴露されたかは不明だ。
今回の研究では、ヒトのSARS-CoV-2ウイルスが米国の都市部、特にニューヨークのネズミ集団に感染しているかどうか、また感染している場合、どのSARS-CoV-2変異型がそれらの感染を引き起こしたかを
ネズミがSARS-CoV-2のアルファ、デルタ、オミクロン変種に感染しやすく、ニューヨーク市の市営下水道などにいる野生のネズミがSARS-CoV-2に曝露していることが、新たな研究で明らかになった。本研究は、2023年3月9日、米国微生物学会のオープンアクセスジャーナルであるmBio誌に掲載された。この論文は「ニューヨーク市産ドブネズミ(Rattus norvegicus)におけるSARS-CoV-2曝露について/SARS-CoV-2 Exposure in Norway Rats (Rattus norvegicus) from New York City」と題されている。
ミズーリ大学のインフルエンザ・新興感染症センター教授兼センター長である研究代表者のヘンリー・ワン博士は、「今回の発見は、ヒトへの二次的な人獣共通感染症の可能性について、ネズミ集団におけるSARS-CoV-2をさらに監視する必要性を強調している」と語っている。「この分野での我々の研究は、動物がパンデミックに影響を与える可能性があることを示している。我々は、人と動物の両方の健康を守るために、さらなる理解が必要だと考えている。」
ネズミは、米国の都市部に広く分布している。例えば、ニューヨーク市だけでも約800万匹の野生のネズミが生息している。これらの野生のネズミは、人間と接近する機会が十分にある。アジア(香港)とヨーロッパ(ベルギー)のネズミがSARS-CoV-2に暴露されたことを示唆する2つの先行研究があるが、これらのネズミがどちらの研究でもどのSARS-CoV-2変異型に暴露されたかは不明だ。
今回の研究では、ヒトのSARS-CoV-2ウイルスが米国の都市部、特にニューヨークのネズミ集団に感染しているかどうか、また感染している場合、どのSARS-CoV-2変異型がそれらの感染を引き起こしたかを
細胞膜の "ブレブ"が抗がん剤の新たなターゲットになる可能性
 健康な細胞では通常、寿命の終わりを意味する「ブレブ」と呼ばれる細胞膜の突出が、メラノーマ細胞では逆に、生存と拡散を助ける細胞内のプロセスを活性化することが、テキサス大学サウスウェスタン校(UTSW)の研究により示唆された。この研究結果は、2023年3月1日にNature誌に掲載され、メラノーマや潜在的に他の広範ながんと戦うための新しい方法につながる可能性がある。このNature誌の論文は「ブレブはがん化シグナルハブを形成し、細胞の生存を促進する(Blebs Promote Cell Survival by Assembling Oncogenic Signalling Hubs)」と題されており、「がん細胞が死を免れるために必要な突起"ブレブ"(Bleb Protrusions Help Cancer Cells to Cheat Death)」 と題するNature News and Viewsの論文も添えられている。
生物学で昔から言われているのは、「形は機能に従う」ということだ。しかし、ここでは、その概念を覆すことに成功した。と、UTSWのLyda Hillバイオインフォマティクス学科長で細胞生物学の教授であるガウデンツ・ダヌーザー博士は語っている。ダヌーザー博士は、ダヌーザー研究室のバイオインフォマティクス講師であるアンドリュー・D・ウィームス博士と共同でこの研究を行った。
ウィームス博士の説明によると、大きな組織から分離した健康な細胞は、数時間以内に再接着できない限り、アノイキスというプロセスによってほぼ確実に死に至る。しかし、悪性腫瘍の特徴として、一度腫瘍組織から切り離された細胞はいつまでも生き続けることができるため、生き残り、体内の他の場所に移動して転移性腫瘍を形成することができる。健康な細胞は腫瘍組織から剥離した後、約1時間しか血栓を形成できないのに
健康な細胞では通常、寿命の終わりを意味する「ブレブ」と呼ばれる細胞膜の突出が、メラノーマ細胞では逆に、生存と拡散を助ける細胞内のプロセスを活性化することが、テキサス大学サウスウェスタン校(UTSW)の研究により示唆された。この研究結果は、2023年3月1日にNature誌に掲載され、メラノーマや潜在的に他の広範ながんと戦うための新しい方法につながる可能性がある。このNature誌の論文は「ブレブはがん化シグナルハブを形成し、細胞の生存を促進する(Blebs Promote Cell Survival by Assembling Oncogenic Signalling Hubs)」と題されており、「がん細胞が死を免れるために必要な突起"ブレブ"(Bleb Protrusions Help Cancer Cells to Cheat Death)」 と題するNature News and Viewsの論文も添えられている。
生物学で昔から言われているのは、「形は機能に従う」ということだ。しかし、ここでは、その概念を覆すことに成功した。と、UTSWのLyda Hillバイオインフォマティクス学科長で細胞生物学の教授であるガウデンツ・ダヌーザー博士は語っている。ダヌーザー博士は、ダヌーザー研究室のバイオインフォマティクス講師であるアンドリュー・D・ウィームス博士と共同でこの研究を行った。
ウィームス博士の説明によると、大きな組織から分離した健康な細胞は、数時間以内に再接着できない限り、アノイキスというプロセスによってほぼ確実に死に至る。しかし、悪性腫瘍の特徴として、一度腫瘍組織から切り離された細胞はいつまでも生き続けることができるため、生き残り、体内の他の場所に移動して転移性腫瘍を形成することができる。健康な細胞は腫瘍組織から剥離した後、約1時間しか血栓を形成できないのに
ノーベル賞受賞者のベルトッツィ博士が2023年AACR賞(がん研究における化学の優れた業績)を受賞へ
 米国がん研究協会(AACR)は、4月14日から19日までフロリダ州オーランドで開催される2023年AACR年次総会において、ノーベル賞受賞者のキャロライン・R・ベルトッツィ博士に「2023 AACR Award for Outstanding Achievement in Chemistry in Cancer Research」を授与すると発表された。ベルトッツィ博士は、スタンフォード大学人文科学部のAnne T. and Robert M. Bass化学教授、化学・システム生物学および放射線学の教授、ハワードヒューズ医学研究所の研究員、サラファンChEM-HのBakerファミリーディレクターである。ベルトッツィ博士は、バイオ直交化学と化学的糖鎖生物学を通じて、基礎的およびトランスレーショナルながん研究を推進したことが評価されている。
AACR Award for Outstanding Achievement in Chemistry in Cancer Researchは、2007年にAACRとそのChemistry in Cancer Research Working Groupがグラクソ・スミスクライン社の支援により、がん研究の進歩における化学の重要性を認識するために設立された。この賞は、がんの基礎研究、がんのトランスレーショナル・リサーチ、がんの診断、がんの予防、がん患者の治療において重要な貢献をもたらした、卓越した、新規性のある、重要な化学研究を表彰するものだ。このような研究には、発がんの化学的側面、化学生物学、創薬と設計、イメージング剤と放射線治療、メタボロミクスと質量分析、プロテオミクス、および構造生物学が含まれるが、これらに限定されない。
革新的なイメージング手法、ケモプロテオミクス、in vivoドラッグターゲティングなど、生物学研究における数
米国がん研究協会(AACR)は、4月14日から19日までフロリダ州オーランドで開催される2023年AACR年次総会において、ノーベル賞受賞者のキャロライン・R・ベルトッツィ博士に「2023 AACR Award for Outstanding Achievement in Chemistry in Cancer Research」を授与すると発表された。ベルトッツィ博士は、スタンフォード大学人文科学部のAnne T. and Robert M. Bass化学教授、化学・システム生物学および放射線学の教授、ハワードヒューズ医学研究所の研究員、サラファンChEM-HのBakerファミリーディレクターである。ベルトッツィ博士は、バイオ直交化学と化学的糖鎖生物学を通じて、基礎的およびトランスレーショナルながん研究を推進したことが評価されている。
AACR Award for Outstanding Achievement in Chemistry in Cancer Researchは、2007年にAACRとそのChemistry in Cancer Research Working Groupがグラクソ・スミスクライン社の支援により、がん研究の進歩における化学の重要性を認識するために設立された。この賞は、がんの基礎研究、がんのトランスレーショナル・リサーチ、がんの診断、がんの予防、がん患者の治療において重要な貢献をもたらした、卓越した、新規性のある、重要な化学研究を表彰するものだ。このような研究には、発がんの化学的側面、化学生物学、創薬と設計、イメージング剤と放射線治療、メタボロミクスと質量分析、プロテオミクス、および構造生物学が含まれるが、これらに限定されない。
革新的なイメージング手法、ケモプロテオミクス、in vivoドラッグターゲティングなど、生物学研究における数
相貌失認はこれまで考えられていたよりも多くの人で発症することが判明
 相貌失認(失顔症)は、初対面の人を見分けられると錯覚したり、見分けがつかなくなったりする不思議な症状で、これまで世界の2~2.5%の人が発症すると推定されてきた。このたび、ハーバード大学医学部と米軍ボストン病院(VA Boston Healthcare System)の研究者らによる新たな研究により、この疾患について新たな知見が得られ、現在考えられているよりも一般的である可能性が示唆された。2023年2月にCortex誌に掲載されたこの研究結果は、33人に1人(3.08%)もの人が相貌失認(prosopagnosia)の基準を満たしている可能性があることを示している。これは、1000万人以上のアメリカ人に相当すると研究チームは述べている。この論文は 「発達性相貌失認の有病率はどの程度か?診断基準値の違いによる経験的評価(What Is the Prevalence of Developmental Prosopagnosia? An Empirical Assessment of Different Diagnostic Cutoffs)」と題されている。
この研究では、より厳格な基準で相貌失認と診断された人と、より緩やかな基準で相貌失認と診断された人の間で、顔照合の成績がほぼ同じであることがわかった。その結果、この病気を持っているにもかかわらず、気づいていない何百万人もの人々が新たに診断されることになるかもしれない。
このたびの研究では、VA Bostonの精神科准教授であるジョセフ・デグティス博士が主導し、相貌失認は、個別のグループではなく、重症度や症状の幅が広いスペクトルにあることを明らかにした。また、精神障害の診断と統計マニュアル 第5版( 5th edition of the Diagnostic and Statistical Manual of Men
相貌失認(失顔症)は、初対面の人を見分けられると錯覚したり、見分けがつかなくなったりする不思議な症状で、これまで世界の2~2.5%の人が発症すると推定されてきた。このたび、ハーバード大学医学部と米軍ボストン病院(VA Boston Healthcare System)の研究者らによる新たな研究により、この疾患について新たな知見が得られ、現在考えられているよりも一般的である可能性が示唆された。2023年2月にCortex誌に掲載されたこの研究結果は、33人に1人(3.08%)もの人が相貌失認(prosopagnosia)の基準を満たしている可能性があることを示している。これは、1000万人以上のアメリカ人に相当すると研究チームは述べている。この論文は 「発達性相貌失認の有病率はどの程度か?診断基準値の違いによる経験的評価(What Is the Prevalence of Developmental Prosopagnosia? An Empirical Assessment of Different Diagnostic Cutoffs)」と題されている。
この研究では、より厳格な基準で相貌失認と診断された人と、より緩やかな基準で相貌失認と診断された人の間で、顔照合の成績がほぼ同じであることがわかった。その結果、この病気を持っているにもかかわらず、気づいていない何百万人もの人々が新たに診断されることになるかもしれない。
このたびの研究では、VA Bostonの精神科准教授であるジョセフ・デグティス博士が主導し、相貌失認は、個別のグループではなく、重症度や症状の幅が広いスペクトルにあることを明らかにした。また、精神障害の診断と統計マニュアル 第5版( 5th edition of the Diagnostic and Statistical Manual of Men
地球上の生命の起源を探る新たな手がかり:古代タンパク質の折り畳みやすさが進化を可能に
 ラボで初期の地球環境をシミュレートした結果、特定のアミノ酸がなければ、古代のタンパク質は植物、動物、ヒトなど、現在地球上で生きているすべてのものに進化する方法を持たなかったことを発見した。この発見は、アミノ酸が古代の微生物の遺伝暗号をどのように形成したかを詳細に示すもので、地球上で生命がどのように誕生したかという謎に光を当てるものだ。「ヒトからバクテリア、古細菌まで、全ての生物に同じアミノ酸が見られる。我々は、その祖先がなぜアミノ酸を獲得したのか形成のイベントを描いているのだ。」とジョンズ・ホプキンス大学の化学者で、チェコのカレル大学の科学者と共同研究を行ったスティーブン・フリード博士は語っている。この研究成果は、2023年2月24日、Journal of the American Chemical Societyに掲載され、「アミノ酸アルファベットの初期選択は、折りたたみ性の生物物理学的制約によって適応的に形作られた(Early Selection of the Amino Acid Alphabet Was Adaptively Shaped by Biophysical Constraints of Foldability)」と題されている。
研究者らは地球上に生命が誕生する前に大量に存在していたアミノ酸の代替品を用いて、40億年前の原始的なタンパク質合成を模倣した。その結果、古代の有機化合物が、タンパク質の折り畳みに最適なアミノ酸を生化学に組み込んでいることがわかった。つまり、生命が地球上で繁栄したのは、古代の生息地で一部のアミノ酸が入手可能で簡単に作れたからではなく、一部のアミノ酸が、タンパク質が特定の形をとって重要な機能を果たすのを助けるのに特に優れていたからだと考えられる。
フリード博士は、「タンパク質の折り畳みは、基本的に、我々の惑星に生命が存在する
ラボで初期の地球環境をシミュレートした結果、特定のアミノ酸がなければ、古代のタンパク質は植物、動物、ヒトなど、現在地球上で生きているすべてのものに進化する方法を持たなかったことを発見した。この発見は、アミノ酸が古代の微生物の遺伝暗号をどのように形成したかを詳細に示すもので、地球上で生命がどのように誕生したかという謎に光を当てるものだ。「ヒトからバクテリア、古細菌まで、全ての生物に同じアミノ酸が見られる。我々は、その祖先がなぜアミノ酸を獲得したのか形成のイベントを描いているのだ。」とジョンズ・ホプキンス大学の化学者で、チェコのカレル大学の科学者と共同研究を行ったスティーブン・フリード博士は語っている。この研究成果は、2023年2月24日、Journal of the American Chemical Societyに掲載され、「アミノ酸アルファベットの初期選択は、折りたたみ性の生物物理学的制約によって適応的に形作られた(Early Selection of the Amino Acid Alphabet Was Adaptively Shaped by Biophysical Constraints of Foldability)」と題されている。
研究者らは地球上に生命が誕生する前に大量に存在していたアミノ酸の代替品を用いて、40億年前の原始的なタンパク質合成を模倣した。その結果、古代の有機化合物が、タンパク質の折り畳みに最適なアミノ酸を生化学に組み込んでいることがわかった。つまり、生命が地球上で繁栄したのは、古代の生息地で一部のアミノ酸が入手可能で簡単に作れたからではなく、一部のアミノ酸が、タンパク質が特定の形をとって重要な機能を果たすのを助けるのに特に優れていたからだと考えられる。
フリード博士は、「タンパク質の折り畳みは、基本的に、我々の惑星に生命が存在する
アフリカの野生猿がマラリア感染の被害を受ける中、ボノボはヒトに似た免疫遺伝子変異で有効に防御していることが判明。
 絶滅危惧種である類人猿は、ヒトと同様にマラリアに感染する。野生のボノボから得られた新たな証拠は、マラリアが彼らにとっても有害であることを示している。マラリアは、感染した蚊に刺されることで感染する寄生虫によって引き起こされる壊滅的な病気だ。ヒトの場合、最初は発熱、頭痛、悪寒などの軽い症状から始まがるが、マラリア感染すると24時間以内に命に関わる。猿の場合、マラリアの病気がどのようなものか、またどの程度致命的なものなのか殆どわかっていない。
「症状や死亡リスクについては、まだよく分かっていない。」と、ワシントン大学セントルイス校のアート&サイエンスの生物人類学助教授であるエミリー・ウロブルフスキー博士は述べている。「飼育下において、病気の症状を示した感染動物の数は限られている。発熱など、感染に関連しそうな症状を示すこともあれば、そうでないこともある。そして、野生では、これらのことを追跡するのは非常に困難だ。」
科学者らは、野生のチンパンジーとゴリラの地理的範囲にマラリア感染が広がっていることを知っている(研究者が類人猿の糞便から寄生虫DNAを検出したため)。実際、アフリカの類人猿は少なくとも12種類の原虫を保有しており、そのうち7種類はヒトの死因の約95%を占める寄生虫と近縁であることが分かっている。しかし、猿の一種であるボノボは、これまで研究者が野生で調査した2カ所を除くすべての場所で感染を免れている。ボノボの38%が糞便から寄生虫のDNAを検出しており、感染した個体群と、コンゴ民主共和国の自然域にある他の10カ所のボノボの未感染個体群を比較することができる。
この違いは、マラリアが類人猿の健康と死亡率にどのような影響を与えるかについて、基本的な事実を解明しようとする機会を研究者に与えてくれた。ウロブルフスキー博士の新しい研究は、2023年2月23日にNature
絶滅危惧種である類人猿は、ヒトと同様にマラリアに感染する。野生のボノボから得られた新たな証拠は、マラリアが彼らにとっても有害であることを示している。マラリアは、感染した蚊に刺されることで感染する寄生虫によって引き起こされる壊滅的な病気だ。ヒトの場合、最初は発熱、頭痛、悪寒などの軽い症状から始まがるが、マラリア感染すると24時間以内に命に関わる。猿の場合、マラリアの病気がどのようなものか、またどの程度致命的なものなのか殆どわかっていない。
「症状や死亡リスクについては、まだよく分かっていない。」と、ワシントン大学セントルイス校のアート&サイエンスの生物人類学助教授であるエミリー・ウロブルフスキー博士は述べている。「飼育下において、病気の症状を示した感染動物の数は限られている。発熱など、感染に関連しそうな症状を示すこともあれば、そうでないこともある。そして、野生では、これらのことを追跡するのは非常に困難だ。」
科学者らは、野生のチンパンジーとゴリラの地理的範囲にマラリア感染が広がっていることを知っている(研究者が類人猿の糞便から寄生虫DNAを検出したため)。実際、アフリカの類人猿は少なくとも12種類の原虫を保有しており、そのうち7種類はヒトの死因の約95%を占める寄生虫と近縁であることが分かっている。しかし、猿の一種であるボノボは、これまで研究者が野生で調査した2カ所を除くすべての場所で感染を免れている。ボノボの38%が糞便から寄生虫のDNAを検出しており、感染した個体群と、コンゴ民主共和国の自然域にある他の10カ所のボノボの未感染個体群を比較することができる。
この違いは、マラリアが類人猿の健康と死亡率にどのような影響を与えるかについて、基本的な事実を解明しようとする機会を研究者に与えてくれた。ウロブルフスキー博士の新しい研究は、2023年2月23日にNature
自由に動き回るタコの脳波を世界で初めて記録に成功
 科学者らは、電極とデータロガーを生物に直接埋め込むことによって実現した、自由に動くタコの脳活動の記録に成功した。この研究は、2022年12月23日にCurrent Biology誌のオンライン版に掲載され、タコの脳がどのように行動を制御しているかを解明する上で重要な前進であり、知能や認知が起こるために必要な共通原理を知る手がかりになると考えられる。このオープンアクセス論文は「行動するタコの脳から電気活動を記録する(Recording Electrical Activity from the Brain of Behaving Octopus)」と題されている。
「脳の働きを理解したいのであれば、タコは哺乳類との比較対象として研究するのに最適な動物だ。大きな脳、驚くほどユニークな体、そして脊椎動物とはまったく異なる発達を遂げた高度な認知能力を備えている」と、筆頭著者で沖縄科学技術大学院大学(OIST)の物理・生物学ユニットの元ポスドク研究員であるタマル・グトニック博士は述べている。 しかし、タコの脳波を測定することは、技術的に本当に難しいことが判明した。タコは脊椎動物とは異なり、体が柔らかいため、記録装置が外れないように固定する頭蓋骨がないのだ。
「タコは8本の強力で柔軟な腕を持っていて、体のどこにでも手が届く。そのため、機器を皮膚の下に置くことで、完全に手の届かないところに置く方法が必要だった」とグトニック博士。
そこで、小型・軽量のデータロガーに着目。研究チームは、タコの体内に簡単に収まる大きさでありながら、防水性を持たせるためにこの装置を改良した。また、低温下で動作するバッテリーを使用することで、最大12時間の連続記録が可能となった。
研究チームは、一般的にワモンダコとして知られているOctopus cyaneaを、その大きさからモデル動物として選んだ。研究
科学者らは、電極とデータロガーを生物に直接埋め込むことによって実現した、自由に動くタコの脳活動の記録に成功した。この研究は、2022年12月23日にCurrent Biology誌のオンライン版に掲載され、タコの脳がどのように行動を制御しているかを解明する上で重要な前進であり、知能や認知が起こるために必要な共通原理を知る手がかりになると考えられる。このオープンアクセス論文は「行動するタコの脳から電気活動を記録する(Recording Electrical Activity from the Brain of Behaving Octopus)」と題されている。
「脳の働きを理解したいのであれば、タコは哺乳類との比較対象として研究するのに最適な動物だ。大きな脳、驚くほどユニークな体、そして脊椎動物とはまったく異なる発達を遂げた高度な認知能力を備えている」と、筆頭著者で沖縄科学技術大学院大学(OIST)の物理・生物学ユニットの元ポスドク研究員であるタマル・グトニック博士は述べている。 しかし、タコの脳波を測定することは、技術的に本当に難しいことが判明した。タコは脊椎動物とは異なり、体が柔らかいため、記録装置が外れないように固定する頭蓋骨がないのだ。
「タコは8本の強力で柔軟な腕を持っていて、体のどこにでも手が届く。そのため、機器を皮膚の下に置くことで、完全に手の届かないところに置く方法が必要だった」とグトニック博士。
そこで、小型・軽量のデータロガーに着目。研究チームは、タコの体内に簡単に収まる大きさでありながら、防水性を持たせるためにこの装置を改良した。また、低温下で動作するバッテリーを使用することで、最大12時間の連続記録が可能となった。
研究チームは、一般的にワモンダコとして知られているOctopus cyaneaを、その大きさからモデル動物として選んだ。研究
アッシャー症候群の非ヒト霊長類モデルを初めて確認。画期的な科学的成果だと研究者は語る。
 アッシャー症候群は、聴覚障害と失明を同時に引き起こす代表的な遺伝性疾患で、まだ治療法が確立されていない病気だ。アッシャー症候群は、遺伝子の変異により、生まれつき耳が聞こえず、平衡感覚に問題があり、徐々に視力を失っていく。10万人のうち4~17人がかかると言われているアッシャー症候群の治療法は、この病気が人に及ぼす影響を忠実に再現する動物モデルがないため、治療が進まないでいた。
オレゴン健康科学大学(OHSU)の研究チームは、そのギャップを埋めるべく取り組んできた。研究チームは、1年前に誕生したアカゲザルのモデルに、アッシャー症候群の最重症型である1B型の症状があることを確認し、2023年2月11日にフロリダ州オーランドで開催された耳鼻咽喉科学会第46回年次中間学術集会で発表した。研究グループは、遺伝子編集技術であるCRISPR/Cas9を用いてそのモデルを作成し、アッシャー症候群の実験的な遺伝子治療法の検証を可能にした。この発表タイトルは、「アッシャー症候群1B型アカゲザルモデルにおける先天性難聴、前庭機能障害、進行性視覚障害について(Congenital Deafness, Vestibular Dysfunction, and Progressive Visual Impairment in a Rhesus Macaque Model of Usher Syndrome Type 1B)」と題されている。 研究チームのリーダーであるOHSUのオレゴン国立霊長類研究センターの神経科学教授でOHSU医学部の眼科学研究准教授のマーサ・ノイリンガー博士は、「アッシャー1Bの子どもらは生まれつき耳が聞こえないが、人工内耳は、特に早期に埋め込むことができれば、良好な聴力を得ることができる。しかし、アッシャー1Bの子供に起こる着実に増加する視力低下を止める治療法は、今のところ
アッシャー症候群は、聴覚障害と失明を同時に引き起こす代表的な遺伝性疾患で、まだ治療法が確立されていない病気だ。アッシャー症候群は、遺伝子の変異により、生まれつき耳が聞こえず、平衡感覚に問題があり、徐々に視力を失っていく。10万人のうち4~17人がかかると言われているアッシャー症候群の治療法は、この病気が人に及ぼす影響を忠実に再現する動物モデルがないため、治療が進まないでいた。
オレゴン健康科学大学(OHSU)の研究チームは、そのギャップを埋めるべく取り組んできた。研究チームは、1年前に誕生したアカゲザルのモデルに、アッシャー症候群の最重症型である1B型の症状があることを確認し、2023年2月11日にフロリダ州オーランドで開催された耳鼻咽喉科学会第46回年次中間学術集会で発表した。研究グループは、遺伝子編集技術であるCRISPR/Cas9を用いてそのモデルを作成し、アッシャー症候群の実験的な遺伝子治療法の検証を可能にした。この発表タイトルは、「アッシャー症候群1B型アカゲザルモデルにおける先天性難聴、前庭機能障害、進行性視覚障害について(Congenital Deafness, Vestibular Dysfunction, and Progressive Visual Impairment in a Rhesus Macaque Model of Usher Syndrome Type 1B)」と題されている。 研究チームのリーダーであるOHSUのオレゴン国立霊長類研究センターの神経科学教授でOHSU医学部の眼科学研究准教授のマーサ・ノイリンガー博士は、「アッシャー1Bの子どもらは生まれつき耳が聞こえないが、人工内耳は、特に早期に埋め込むことができれば、良好な聴力を得ることができる。しかし、アッシャー1Bの子供に起こる着実に増加する視力低下を止める治療法は、今のところ
ECMの硬化とエクソソーム産生・放出量の増加に注目した腫瘍増殖メカニズムで新たな知見
 多くの場合、がんの物理的な症状やその後の診断方法は、変異した細胞や構造物が過剰に増殖した組織の塊である「腫瘍」を介して行われる。がんにおける異常事態を理解する上で大きな謎のひとつは、これらの構造物が成長する環境(一般に腫瘍微小環境と呼ばれる)に関連していることだ。これらの微小環境は、腫瘍の生存、成長、拡散を促進する役割を担っている。腫瘍は、血管系、免疫細胞、シグナル伝達分子、細胞外マトリックス(ECM:コラーゲンに富む細胞の足場となる3次元ネットワーク)の形で、自らのインフラを生成するのに役立つ。ECMはまた、細胞間のコミュニケーションを制御するのに役立つ。腫瘍微小環境では、ECMはがん細胞に構造的なサポートを提供し、成長を促進するシグナル伝達経路を調節することで、腫瘍成長の重要な促進因子となる可能性がある。
このたび、ペンシルベニア大学芸術科学部のウェイ・ガオ博士が主導し、2023年2月16日にNature Cell Biology誌に発表した新しい研究で、腫瘍微小環境内の複雑な構造の相互作用と腫瘍成長のきっかけとなるシグナルの橋渡しがなされた。研究者らは、硬さの異なるECM上で増殖したがん性肝細胞を研究し、腫瘍の成長に伴う硬直が、エクソソームとして知られる脂質封入小胞の生成を増加させるカスケードを開始させることを発見した。この論文は、「硬いマトリックスがエクソソーム分泌を誘導し、腫瘍の成長を促進する(Stiff Matrix Induces Exosome Secretion to Promote Tumour Growth)」と題されている。
ペンシルベニア大学工学部バイオエンジニアリング学科教授で、この論文の共著者であるラヴィ・ラドハクリシュナン博士は、「これらのエクソソームは、各細胞が送り出す荷物であり、住所に応じて他の細胞へと誘導される。配送された荷物の
多くの場合、がんの物理的な症状やその後の診断方法は、変異した細胞や構造物が過剰に増殖した組織の塊である「腫瘍」を介して行われる。がんにおける異常事態を理解する上で大きな謎のひとつは、これらの構造物が成長する環境(一般に腫瘍微小環境と呼ばれる)に関連していることだ。これらの微小環境は、腫瘍の生存、成長、拡散を促進する役割を担っている。腫瘍は、血管系、免疫細胞、シグナル伝達分子、細胞外マトリックス(ECM:コラーゲンに富む細胞の足場となる3次元ネットワーク)の形で、自らのインフラを生成するのに役立つ。ECMはまた、細胞間のコミュニケーションを制御するのに役立つ。腫瘍微小環境では、ECMはがん細胞に構造的なサポートを提供し、成長を促進するシグナル伝達経路を調節することで、腫瘍成長の重要な促進因子となる可能性がある。
このたび、ペンシルベニア大学芸術科学部のウェイ・ガオ博士が主導し、2023年2月16日にNature Cell Biology誌に発表した新しい研究で、腫瘍微小環境内の複雑な構造の相互作用と腫瘍成長のきっかけとなるシグナルの橋渡しがなされた。研究者らは、硬さの異なるECM上で増殖したがん性肝細胞を研究し、腫瘍の成長に伴う硬直が、エクソソームとして知られる脂質封入小胞の生成を増加させるカスケードを開始させることを発見した。この論文は、「硬いマトリックスがエクソソーム分泌を誘導し、腫瘍の成長を促進する(Stiff Matrix Induces Exosome Secretion to Promote Tumour Growth)」と題されている。
ペンシルベニア大学工学部バイオエンジニアリング学科教授で、この論文の共著者であるラヴィ・ラドハクリシュナン博士は、「これらのエクソソームは、各細胞が送り出す荷物であり、住所に応じて他の細胞へと誘導される。配送された荷物の
C2i Genomics社、PMWC2023でAIによるctDNAの全ゲノムシーケンスについて発表
 C2i Genomics社のCEO兼CSOのアサフ・ズビラン博士は、2023年1月25日、Precision Medicine World Conference (PMWC 2023)で、自身の会社の発表を行った。ズビラン博士は、イスラエル軍の退役軍人で、専門はレーダーだった。しかし、胸腺がんを発症し、その後、さまざまな家族ががんを患うのを見て、彼はがんに焦点を当て、高度な工学的知識と新しく学んだバイオテクノロジーを組み合わせて、このしばしば致命的な惨劇と戦うことを試みることにした。
C2i Genomics社で使用されている技術の共同発明者として、ズビラン博士は、学術研究のコンセプトからVCの支援を受けた成長段階の企業へと会社の発展を導いた。ズビラン博士は、ライフサイエンスおよび防衛分野における15年以上の研究開発のマネージメント経験があり、インパクトのある科学論文や特許を多数発表している。がんサバイバーであるズビラン博士は、がん患者のQOLと転帰の改善に尽力している。
C2informedは、がん領域における分子的残存病変(MRD)検出のための腫瘍情報に基づく個別化アッセイである。本検査は、全ゲノムシーケンス(WGS)を用い、高度なバイオインフォマティクスと人工知能技術により、低負荷の疾患であっても、再発の早期発見や疾患監視のための精密MRDモニタリングを可能にする。
C2i solution は、AIパターン認識と全ゲノムシーケンスを組み合わせることで、競合技術と比較して最大100倍の感度で、迅速かつ特異的に残存疾患を検出することができる。MRDを検出するための同社の新しいアプローチは、全ゲノムパターン認識を用いて、ゲノムの30億塩基対全体を活用するものだ。全ゲノムにわたって、C2informedは数千のデータポイントと同社独自の計算およびAI手法を使用して
C2i Genomics社のCEO兼CSOのアサフ・ズビラン博士は、2023年1月25日、Precision Medicine World Conference (PMWC 2023)で、自身の会社の発表を行った。ズビラン博士は、イスラエル軍の退役軍人で、専門はレーダーだった。しかし、胸腺がんを発症し、その後、さまざまな家族ががんを患うのを見て、彼はがんに焦点を当て、高度な工学的知識と新しく学んだバイオテクノロジーを組み合わせて、このしばしば致命的な惨劇と戦うことを試みることにした。
C2i Genomics社で使用されている技術の共同発明者として、ズビラン博士は、学術研究のコンセプトからVCの支援を受けた成長段階の企業へと会社の発展を導いた。ズビラン博士は、ライフサイエンスおよび防衛分野における15年以上の研究開発のマネージメント経験があり、インパクトのある科学論文や特許を多数発表している。がんサバイバーであるズビラン博士は、がん患者のQOLと転帰の改善に尽力している。
C2informedは、がん領域における分子的残存病変(MRD)検出のための腫瘍情報に基づく個別化アッセイである。本検査は、全ゲノムシーケンス(WGS)を用い、高度なバイオインフォマティクスと人工知能技術により、低負荷の疾患であっても、再発の早期発見や疾患監視のための精密MRDモニタリングを可能にする。
C2i solution は、AIパターン認識と全ゲノムシーケンスを組み合わせることで、競合技術と比較して最大100倍の感度で、迅速かつ特異的に残存疾患を検出することができる。MRDを検出するための同社の新しいアプローチは、全ゲノムパターン認識を用いて、ゲノムの30億塩基対全体を活用するものだ。全ゲノムにわたって、C2informedは数千のデータポイントと同社独自の計算およびAI手法を使用して
ヤマブシタケが神経の成長を促進し記憶力を向上させる
 オーストラリアのクイーンズランド大学の研究者らは、神経の成長を促進し、記憶力を高める活性化合物を食用キノコから発見した。クイーンズランド州脳研究所のフレデリック・ムニエ教授は、研究チームがヤマブシタケ(Hericium erinaceus)から新しい活性化合物を同定したと述べた。この活性化合物は前臨床試験において、脳細胞の成長と記憶を改善することが確認された。
「ヤマブシタケの抽出物は、何世紀にもわたってアジア諸国の伝統医学で使用されてきたが、我々は、脳細胞に対する潜在的効果を科学的に明らかにしたいと考えた。前臨床試験で、ヤマブシタケが脳細胞の成長と記憶力の向上に大きな影響を与えることがわかった。」
「実験室で培養脳細胞に対するHericium erinaceusから分離した化合物の神経栄養効果を測定したところ、驚くべきことに、活性化合物がニューロンの突起を促進し、他のニューロンへの伸長や接続を促すことがわかった。」
「超解像顕微鏡を用いて、このキノコの抽出物とその有効成分が、脳細胞が環境を感知し、脳内の他の神経細胞との新しい結合を確立するために特に重要な成長円錐のサイズを大きく増大させることを発見した。」と、ムニエ教授は述べている。
共著者であるクイーンズランド大学のラモン・マルティネス・マルモル博士は、この発見が、アルツハイマー病などの神経変性認知障害の治療や予防に応用できる可能性があると述べている。
「我々のアイデアは、脳に到達してニューロンの成長を制御し、結果として記憶形成を改善することができる天然由来の生物活性化合物を特定することだった。」
研究プロジェクトを支援・協力したCNGBio Coのイ・デヒ博士によると、ヤマブシタケの特性は、古代から中国の伝統医学で病気の治療や健康維持に使われてきたという。「この重要な研究は、ヤマブシタケの化合物の分子機
オーストラリアのクイーンズランド大学の研究者らは、神経の成長を促進し、記憶力を高める活性化合物を食用キノコから発見した。クイーンズランド州脳研究所のフレデリック・ムニエ教授は、研究チームがヤマブシタケ(Hericium erinaceus)から新しい活性化合物を同定したと述べた。この活性化合物は前臨床試験において、脳細胞の成長と記憶を改善することが確認された。
「ヤマブシタケの抽出物は、何世紀にもわたってアジア諸国の伝統医学で使用されてきたが、我々は、脳細胞に対する潜在的効果を科学的に明らかにしたいと考えた。前臨床試験で、ヤマブシタケが脳細胞の成長と記憶力の向上に大きな影響を与えることがわかった。」
「実験室で培養脳細胞に対するHericium erinaceusから分離した化合物の神経栄養効果を測定したところ、驚くべきことに、活性化合物がニューロンの突起を促進し、他のニューロンへの伸長や接続を促すことがわかった。」
「超解像顕微鏡を用いて、このキノコの抽出物とその有効成分が、脳細胞が環境を感知し、脳内の他の神経細胞との新しい結合を確立するために特に重要な成長円錐のサイズを大きく増大させることを発見した。」と、ムニエ教授は述べている。
共著者であるクイーンズランド大学のラモン・マルティネス・マルモル博士は、この発見が、アルツハイマー病などの神経変性認知障害の治療や予防に応用できる可能性があると述べている。
「我々のアイデアは、脳に到達してニューロンの成長を制御し、結果として記憶形成を改善することができる天然由来の生物活性化合物を特定することだった。」
研究プロジェクトを支援・協力したCNGBio Coのイ・デヒ博士によると、ヤマブシタケの特性は、古代から中国の伝統医学で病気の治療や健康維持に使われてきたという。「この重要な研究は、ヤマブシタケの化合物の分子機
モンキーフラワーの新種の進化:分類群特異的遺伝子が新種を生み出す鍵であることを解明。
 モンキーフラワーは、黄色、ピンク、濃い赤橙色など、さまざまな色に輝いている。しかし、約500万年前に、その一部は黄色を失ってしまった。コネチカット大学の植物学者が、遺伝学的に何が起きて黄色の色素が失われたのか、そして種の進化にどのような影響があったのかを解明した。このScience誌に掲載された論文は、「モンキーフラワーの種分化に関与する分類群特異的な段階的siRNAの発見(Taxon-Specific, Phased siRNAs Underlie a Speciation Locus in Monkeyflowers)」と題されている。
モンキーフラワーは、他の植物が育たないようなミネラル豊富な厳しい土壌で育つことで有名だ。また、形や色が多様であることでも知られている。そして、モンキーフラワーは、たった1つの遺伝子の変化で新種が誕生することを示す典型的な例である。この例では、約500万年前にモンキーフラワーの一種が花びらの黄色い色素を失い、ピンク色を獲得し、受粉のためにハチを引き寄せた。その後、子孫の種がYUPと呼ばれる遺伝子の変異を蓄積し、黄色の色素を回復して赤い花を咲かせるようになった。その結果、ハチが寄りつかなくなった代わりにハチドリが受粉し、赤い花は遺伝的に隔離され、新しい種が誕生したという。
コネチカット大学の植物学者のヨウフ・ユアン博士とポスドク研究員のメイ・リアン博士(現在、中国南部農業大学教授)は、他の4つの研究機関の共同研究者とともに、モンキーフラワーが黄色にならないよう変化した遺伝子を正確に特定した。彼らの研究は、新しい遺伝子が表現型の多様性を生み出し、さらには新しい種を生み出すという説に重みを加えるものである。
問題のYUP遺伝子は、モンキーフラワーのゲノムのうち、3つの新しい遺伝子を持つ遺伝子座(領域)に存在する。これらの新しい遺伝子は
モンキーフラワーは、黄色、ピンク、濃い赤橙色など、さまざまな色に輝いている。しかし、約500万年前に、その一部は黄色を失ってしまった。コネチカット大学の植物学者が、遺伝学的に何が起きて黄色の色素が失われたのか、そして種の進化にどのような影響があったのかを解明した。このScience誌に掲載された論文は、「モンキーフラワーの種分化に関与する分類群特異的な段階的siRNAの発見(Taxon-Specific, Phased siRNAs Underlie a Speciation Locus in Monkeyflowers)」と題されている。
モンキーフラワーは、他の植物が育たないようなミネラル豊富な厳しい土壌で育つことで有名だ。また、形や色が多様であることでも知られている。そして、モンキーフラワーは、たった1つの遺伝子の変化で新種が誕生することを示す典型的な例である。この例では、約500万年前にモンキーフラワーの一種が花びらの黄色い色素を失い、ピンク色を獲得し、受粉のためにハチを引き寄せた。その後、子孫の種がYUPと呼ばれる遺伝子の変異を蓄積し、黄色の色素を回復して赤い花を咲かせるようになった。その結果、ハチが寄りつかなくなった代わりにハチドリが受粉し、赤い花は遺伝的に隔離され、新しい種が誕生したという。
コネチカット大学の植物学者のヨウフ・ユアン博士とポスドク研究員のメイ・リアン博士(現在、中国南部農業大学教授)は、他の4つの研究機関の共同研究者とともに、モンキーフラワーが黄色にならないよう変化した遺伝子を正確に特定した。彼らの研究は、新しい遺伝子が表現型の多様性を生み出し、さらには新しい種を生み出すという説に重みを加えるものである。
問題のYUP遺伝子は、モンキーフラワーのゲノムのうち、3つの新しい遺伝子を持つ遺伝子座(領域)に存在する。これらの新しい遺伝子は
脾臓機能チップによる鎌状赤血球症の診断に成功
 毎日、何十億という赤血球が脾臓を通過する。脾臓は、古くなったり傷ついたりした血球をろ過する役割を担っている臓器だ。しかし、鎌状赤血球症の患者のように血球の形が悪いと、この作業はより困難になる。鎌状赤血球は脾臓のフィルターを詰まらせ、生命を脅かす事態を引き起こす可能性があるのだ。MIT、シンガポールの南洋理工大学、パリのパスツール研究所などの研究者らは、このたび、急性脾臓閉塞と呼ばれる現象の発生をモデル化できるマイクロ流体デバイス、すなわち「脾臓・オン・ア・チップ」を設計した。
研究チームは、この生体機能チップを用いて酸素濃度が低いと脾臓のフィルターが詰まりやすくなることを発見した。また、酸素濃度を上げるとフィルターの詰まりが解消されることも明らかにした。このことは、この症状に苦しむ患者に輸血が有効であることの説明につながるかもしれない。
「酸素濃度を上げれば、閉塞は元に戻る。これは、脾臓閉塞の危機が起こったときに行われることを真似ている。医師が最初にすることは輸血で、ほとんどの場合、それで患者はある程度安心するのだ。」とMITの材料科学工学科の主任研究員で、この研究の主執筆者の一人であるミン・ダオ博士は語った。
MITの前工学部長でヴァネヴァー・ブッシュ名誉教授、シンガポールの南洋理工大学元学長のスブラ・スレッシュ博士、パスツール研究所医長でパリ大学教授のピエール・ビュフェ博士、ブラウン大学応用数学のロビンソン・バーストウ教授のジョージ・カルニアダキス博士も、この研究の主執筆者である。そしてMITのポスドクであるユハオ・チアン博士は、今週(2023年2月3日)PNASに掲載された論文の主執筆者だ。
この論文は「ヒト脾臓による異常赤血球の保持と排出のマイクロ流体研究 -鎌状赤血球症への応用をめざして(Microfluidic Study of Retention
毎日、何十億という赤血球が脾臓を通過する。脾臓は、古くなったり傷ついたりした血球をろ過する役割を担っている臓器だ。しかし、鎌状赤血球症の患者のように血球の形が悪いと、この作業はより困難になる。鎌状赤血球は脾臓のフィルターを詰まらせ、生命を脅かす事態を引き起こす可能性があるのだ。MIT、シンガポールの南洋理工大学、パリのパスツール研究所などの研究者らは、このたび、急性脾臓閉塞と呼ばれる現象の発生をモデル化できるマイクロ流体デバイス、すなわち「脾臓・オン・ア・チップ」を設計した。
研究チームは、この生体機能チップを用いて酸素濃度が低いと脾臓のフィルターが詰まりやすくなることを発見した。また、酸素濃度を上げるとフィルターの詰まりが解消されることも明らかにした。このことは、この症状に苦しむ患者に輸血が有効であることの説明につながるかもしれない。
「酸素濃度を上げれば、閉塞は元に戻る。これは、脾臓閉塞の危機が起こったときに行われることを真似ている。医師が最初にすることは輸血で、ほとんどの場合、それで患者はある程度安心するのだ。」とMITの材料科学工学科の主任研究員で、この研究の主執筆者の一人であるミン・ダオ博士は語った。
MITの前工学部長でヴァネヴァー・ブッシュ名誉教授、シンガポールの南洋理工大学元学長のスブラ・スレッシュ博士、パスツール研究所医長でパリ大学教授のピエール・ビュフェ博士、ブラウン大学応用数学のロビンソン・バーストウ教授のジョージ・カルニアダキス博士も、この研究の主執筆者である。そしてMITのポスドクであるユハオ・チアン博士は、今週(2023年2月3日)PNASに掲載された論文の主執筆者だ。
この論文は「ヒト脾臓による異常赤血球の保持と排出のマイクロ流体研究 -鎌状赤血球症への応用をめざして(Microfluidic Study of Retention
膵臓がんはいかにして治療に逆らうか?エピジェネティックモジュレーターSMARCD3が新標的であることを示唆する新たな研究成果
 膵臓がんは、肺がん、大腸がんに次いで米国で3番目に死亡率の高いがんだが、その発生頻度ははるかに低くなっている。また、膵臓がんの幹細胞は、化学療法や新しい免疫療法などの従来の治療や標的治療に対して急速に耐性を獲得するため、効果的な治療が最も困難ながんの一つでもある。その結果、膵臓がんと診断された人の5年生存率はわずか10%だ。カリフォルニア大学サンディエゴ校(UCSD)医学部とサンフォード再生医療コンソーシアムの研究者が率いる国際研究チームは、最も耐性の高い膵臓がん細胞が、通常は腫瘍を抑制するタンパク質群の1つを利用して、がん細胞が治療を回避してより速く成長するのを助けることにより、治療に抗する別の方法を明らかにした。
この論文は「Smarcd3は膵臓管状腺癌における代謝ランドスケープのエピジェネティックな調節因子である(Smarcd3 Is an Epigenetic Modulator of the Metabolic Landscape in Pancreatic Ductal Adenocarcinoma)」と題されている。
これまでの研究で、膵臓がんの治療抵抗性は、腫瘍細胞の不均一性、特に治療抵抗性を促す幹細胞の特性によって、従来の薬剤に対する反応が異なるために起こることが分かっている。今回の研究では、主任研究者のタニシュタ・レヤ博士(元UCSD医科大学薬学・医学教授、がん生物学部長)らが、ゲノム上の変化(遺伝子そのものに特有の変化)ではなく、エピゲノム(ゲノムに何をすべきかを伝える多数のタンパク質)の変化が、耐性化を促進している可能性について検討した。
現在、コロンビア大学生理学・細胞生物物理学教授、ハーバート・アーヴィング総合がんセンター・トランスレーショナル・リサーチ副所長のレヤ博士は、「膵臓がん幹細胞は、従来の治療法に抵抗し腫瘍の再発を促す攻撃的な
膵臓がんは、肺がん、大腸がんに次いで米国で3番目に死亡率の高いがんだが、その発生頻度ははるかに低くなっている。また、膵臓がんの幹細胞は、化学療法や新しい免疫療法などの従来の治療や標的治療に対して急速に耐性を獲得するため、効果的な治療が最も困難ながんの一つでもある。その結果、膵臓がんと診断された人の5年生存率はわずか10%だ。カリフォルニア大学サンディエゴ校(UCSD)医学部とサンフォード再生医療コンソーシアムの研究者が率いる国際研究チームは、最も耐性の高い膵臓がん細胞が、通常は腫瘍を抑制するタンパク質群の1つを利用して、がん細胞が治療を回避してより速く成長するのを助けることにより、治療に抗する別の方法を明らかにした。
この論文は「Smarcd3は膵臓管状腺癌における代謝ランドスケープのエピジェネティックな調節因子である(Smarcd3 Is an Epigenetic Modulator of the Metabolic Landscape in Pancreatic Ductal Adenocarcinoma)」と題されている。
これまでの研究で、膵臓がんの治療抵抗性は、腫瘍細胞の不均一性、特に治療抵抗性を促す幹細胞の特性によって、従来の薬剤に対する反応が異なるために起こることが分かっている。今回の研究では、主任研究者のタニシュタ・レヤ博士(元UCSD医科大学薬学・医学教授、がん生物学部長)らが、ゲノム上の変化(遺伝子そのものに特有の変化)ではなく、エピゲノム(ゲノムに何をすべきかを伝える多数のタンパク質)の変化が、耐性化を促進している可能性について検討した。
現在、コロンビア大学生理学・細胞生物物理学教授、ハーバート・アーヴィング総合がんセンター・トランスレーショナル・リサーチ副所長のレヤ博士は、「膵臓がん幹細胞は、従来の治療法に抵抗し腫瘍の再発を促す攻撃的な
枯草菌がフェーズ2試験で黄色ブドウ球菌のコロニー形成を顕著に抑制。
 抗生物質の代わりにプロバイオティクスを使用することで、黄色ブドウ球菌の定着を抑制する有望な方法が、第2相臨床試験で安全かつ高い有効性を示した。Lancet Microbe誌に報告されたこの新しい研究では、プロバイオティクスとして枯草菌(Bacillus subtilis)が、人間に有益な細菌を含む腸内細菌叢を傷つけずに、試験参加者の黄色ブドウ球菌の定着を顕著に減少させることが明らかにされた。この研究は、国立アレルギー・感染症研究所(NIAID)の上級研究員であるマイケル・オットー博士率いるNIHの研究者によって行われた。
このLancet誌の論文は「タイにおけるプロバイオティクスによる病原性黄色ブドウ球菌の除菌: 第2相二重盲検プラセボ対照試験 (Probiotic for Pathogen-Specific Staphylococcus aureus Decolonisation in Thailand: A Phase 2, Double-Blind, Randomised, Placebo-Controlled Trial)」と題されている。
メチシリン耐性黄色ブドウ球菌(MRSA)は、重篤な疾患の原因として多くの人に親しまれている。あまり知られていないが、黄色ブドウ球菌は害を及ぼすことなく、しばしば鼻の中や体表、腸内に生息している。しかし、皮膚のバリアーが壊れたり、免疫力が低下したりすると、これらの定着菌が皮膚、骨、肺、血液の深刻な感染症を引き起こす可能性があるのだ。
抗生物質耐性菌の蔓延により治療法が限定される中、「脱コロニー」による黄色ブドウ球菌感染症の予防が注目されている。脱コロニー化戦略の中には、大量の抗生物質を必要とし、微生物叢へのダメージや抗生物質耐性の発達が懸念されるものもあり、議論を呼んでいる。今のところ、局所的な抗生物質であまり害を与える
抗生物質の代わりにプロバイオティクスを使用することで、黄色ブドウ球菌の定着を抑制する有望な方法が、第2相臨床試験で安全かつ高い有効性を示した。Lancet Microbe誌に報告されたこの新しい研究では、プロバイオティクスとして枯草菌(Bacillus subtilis)が、人間に有益な細菌を含む腸内細菌叢を傷つけずに、試験参加者の黄色ブドウ球菌の定着を顕著に減少させることが明らかにされた。この研究は、国立アレルギー・感染症研究所(NIAID)の上級研究員であるマイケル・オットー博士率いるNIHの研究者によって行われた。
このLancet誌の論文は「タイにおけるプロバイオティクスによる病原性黄色ブドウ球菌の除菌: 第2相二重盲検プラセボ対照試験 (Probiotic for Pathogen-Specific Staphylococcus aureus Decolonisation in Thailand: A Phase 2, Double-Blind, Randomised, Placebo-Controlled Trial)」と題されている。
メチシリン耐性黄色ブドウ球菌(MRSA)は、重篤な疾患の原因として多くの人に親しまれている。あまり知られていないが、黄色ブドウ球菌は害を及ぼすことなく、しばしば鼻の中や体表、腸内に生息している。しかし、皮膚のバリアーが壊れたり、免疫力が低下したりすると、これらの定着菌が皮膚、骨、肺、血液の深刻な感染症を引き起こす可能性があるのだ。
抗生物質耐性菌の蔓延により治療法が限定される中、「脱コロニー」による黄色ブドウ球菌感染症の予防が注目されている。脱コロニー化戦略の中には、大量の抗生物質を必要とし、微生物叢へのダメージや抗生物質耐性の発達が懸念されるものもあり、議論を呼んでいる。今のところ、局所的な抗生物質であまり害を与える
ススキの精密遺伝子編集に初成功。多年草を用いたバイオエネルギー生産の可能性が加速。
 持続可能なバイオエネルギー生産に有望な多年生作物であるススキの精密遺伝子編集が初成功した。米国エネルギー省が資金援助しているバイオエネルギー研究センター(BRC)の先進バイオエネルギー・バイオ製品イノベーションセンター(CABBI)のチームは、CRISPR/Cas9を用いて3種のススキのゲノムを編集し、従来の方法よりもはるかに対象を絞り込み、効率的に新しい品種を開発することに成功した。この成果は、バイオ燃料、再生可能なバイオ製品、炭素隔離の原料として、生産性は高いが遺伝的に複雑なこの草の大きな可能性を加速させるものだ。
2022年12月28日にBiotechnology for Biofuels and Bioproducts誌に掲載されたこの研究は、アラバマ州のハドソンアルファ生物工学研究所のCABBIススキ研究者の3名(教員研究員のカンクシータ・スワミナサン博士、研究員のアンソニー・チュウ博士、元ポスドクのモハマド・ベラフィフ博士)とミシシッピー州立大学生物科学部教授のナンシー・ライヒェルト博士によって主導されたものである。このオープンアクセス版の論文は「バイオエネルギーイネ科ススキの形質転換と遺伝子編集(Transformation and Gene Editing in the Bioenergy Grass Miscanthus)」と題されている。
スワミナサン博士は、2020年にススキのゲノム解読を行った国際チームを率いている。この成果は、ススキの生産性を最大限に高め、その望ましい形質の遺伝的基盤を解読する新たな方法を探る研究者に道筋を示すものであった。ススキは非常に適応性が高く、栽培が容易な植物だ。また、乾燥や低温に強く、より効率の良いC4光合成を行うことができる。
これまで、ススキを遺伝子工学的に改良する取り組みでは、特定の部位を狙ったり、既存の遺
持続可能なバイオエネルギー生産に有望な多年生作物であるススキの精密遺伝子編集が初成功した。米国エネルギー省が資金援助しているバイオエネルギー研究センター(BRC)の先進バイオエネルギー・バイオ製品イノベーションセンター(CABBI)のチームは、CRISPR/Cas9を用いて3種のススキのゲノムを編集し、従来の方法よりもはるかに対象を絞り込み、効率的に新しい品種を開発することに成功した。この成果は、バイオ燃料、再生可能なバイオ製品、炭素隔離の原料として、生産性は高いが遺伝的に複雑なこの草の大きな可能性を加速させるものだ。
2022年12月28日にBiotechnology for Biofuels and Bioproducts誌に掲載されたこの研究は、アラバマ州のハドソンアルファ生物工学研究所のCABBIススキ研究者の3名(教員研究員のカンクシータ・スワミナサン博士、研究員のアンソニー・チュウ博士、元ポスドクのモハマド・ベラフィフ博士)とミシシッピー州立大学生物科学部教授のナンシー・ライヒェルト博士によって主導されたものである。このオープンアクセス版の論文は「バイオエネルギーイネ科ススキの形質転換と遺伝子編集(Transformation and Gene Editing in the Bioenergy Grass Miscanthus)」と題されている。
スワミナサン博士は、2020年にススキのゲノム解読を行った国際チームを率いている。この成果は、ススキの生産性を最大限に高め、その望ましい形質の遺伝的基盤を解読する新たな方法を探る研究者に道筋を示すものであった。ススキは非常に適応性が高く、栽培が容易な植物だ。また、乾燥や低温に強く、より効率の良いC4光合成を行うことができる。
これまで、ススキを遺伝子工学的に改良する取り組みでは、特定の部位を狙ったり、既存の遺
UCLAの化学者がパーキンソン病に効く海綿状物質(リソデンドリン酸Aエナンチオマー)の化学合成に成功。
 UCLAの有機化学者は、最近海綿から発見されたパーキンソン病や同様の疾患の治療に役立つと考えられる分子の合成に成功した。この分子はリソデンドリン酸Aとして知られ、DNA、RNA、タンパク質を損傷し、さらには細胞全体を破壊する他の分子に対抗すると考えられている。さらに、研究チームは、環状アレンと呼ばれる長い間無視されてきた珍しい化合物を用いて、この分子の有用なバージョンを研究室で生産するために、必要な化学反応連鎖の重要なステップを制御するという興味深い試みも行っている。
この研究成果は、2023年 1月19日付のScience誌に掲載された。この論文は「歪んだ環状アレンの立体特異的トラッピングによるリソデンドリン酸Aの全合成(Total Synthesis of Lissodendoric Acid A Via Stereospecific Trapping of a Strained Cyclic Allene)」と題されている。
UCLAのKenneth N. Trueblood化学・生化学教授で、本研究の責任著者であるニール・ガーグ博士(写真)は、「現在の医薬品の大半は有機合成化学によって作られており、新しい化学反応を確立することが我々の学術的な役割の一つとなっている。」と述べている。
このような有機合成分子の開発を難しくしているのが、「キラリティー」(手のひら返し)と呼ばれるものだとガーグ博士は指摘する。リソデンドリン酸Aを含む多くの分子は、化学的には同じであるが、右手と左手のように3次元的に鏡像となる2種類の異なる形態で存在することができる。この2つの分子は、それぞれ「エナンチオマー」と呼ばれる。
医薬品の場合、ある分子の一方のエナンチオマーが有益な治療効果を示し、もう一方のエナンチオマーは全く効果がない、あるいは危険であることがある。しかし、実験室で有
UCLAの有機化学者は、最近海綿から発見されたパーキンソン病や同様の疾患の治療に役立つと考えられる分子の合成に成功した。この分子はリソデンドリン酸Aとして知られ、DNA、RNA、タンパク質を損傷し、さらには細胞全体を破壊する他の分子に対抗すると考えられている。さらに、研究チームは、環状アレンと呼ばれる長い間無視されてきた珍しい化合物を用いて、この分子の有用なバージョンを研究室で生産するために、必要な化学反応連鎖の重要なステップを制御するという興味深い試みも行っている。
この研究成果は、2023年 1月19日付のScience誌に掲載された。この論文は「歪んだ環状アレンの立体特異的トラッピングによるリソデンドリン酸Aの全合成(Total Synthesis of Lissodendoric Acid A Via Stereospecific Trapping of a Strained Cyclic Allene)」と題されている。
UCLAのKenneth N. Trueblood化学・生化学教授で、本研究の責任著者であるニール・ガーグ博士(写真)は、「現在の医薬品の大半は有機合成化学によって作られており、新しい化学反応を確立することが我々の学術的な役割の一つとなっている。」と述べている。
このような有機合成分子の開発を難しくしているのが、「キラリティー」(手のひら返し)と呼ばれるものだとガーグ博士は指摘する。リソデンドリン酸Aを含む多くの分子は、化学的には同じであるが、右手と左手のように3次元的に鏡像となる2種類の異なる形態で存在することができる。この2つの分子は、それぞれ「エナンチオマー」と呼ばれる。
医薬品の場合、ある分子の一方のエナンチオマーが有益な治療効果を示し、もう一方のエナンチオマーは全く効果がない、あるいは危険であることがある。しかし、実験室で有
PMWC2023で遺伝性水疱性皮膚疾患(ジストロフィー性表皮水疱症)の遺伝子治療の予備的成功が報告される
 2023年1月25日、カリフォルニア州サンタクララで開催された精密医療世界会議(PMWC 2023)の1日目、トラック1「遺伝子・細胞治療」の閉会式で、「ジストロフィー性表皮水疱症」として知られる遺伝性水疱性皮膚疾患に対する遺伝子治療で大きな進展が見られるとの発表があった。発表したのは、スタンフォード大学皮膚科准教授で、スタンフォード水疱症クリニックを率いるM.ピーター マリンコビッチ医学博士だ。
マリンコビッチ博士の研究室では、表皮水疱症の様々なサブタイプに対する分子療法の開発に長年にわたり注力してきた。大きな前進として、マリンコビッチ博士らは、2022年12月15日発行のNew England Journal of Medicineに「ジストロフィー型表皮水疱症に対するベレマゲン・ゲペルパベック(B-VEC)の試験 〈Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa.〉」と題された論文を発表した。この研究の結論は、ジストロフィー性表皮水疱症患者の3ヶ月と6ヶ月の創傷の完全治癒は、プラセボよりもB-VECの局所投与でより可能性が高いというものだ。B-VECを投与された患者では、掻痒感と軽度の全身性副作用が観察された。ジストロフィー型表皮水疱症は、VII型コラーゲン(C7)の組み立てに関与するタンパク質をコードするCOL7A1の変異によって起こるまれな遺伝性水疱性皮膚疾患である。
Beremagene geperpavec(B-VEC)は、単純ヘルペスウイルス1型(HSV-1)をベースにした局所的な遺伝子治療で、正常なCOL7A1を送達することによりC7タンパク質を回復させるよう設計されている。この疾患に対するB-VECの耐久性と副作用を明らかにするために、より長期
2023年1月25日、カリフォルニア州サンタクララで開催された精密医療世界会議(PMWC 2023)の1日目、トラック1「遺伝子・細胞治療」の閉会式で、「ジストロフィー性表皮水疱症」として知られる遺伝性水疱性皮膚疾患に対する遺伝子治療で大きな進展が見られるとの発表があった。発表したのは、スタンフォード大学皮膚科准教授で、スタンフォード水疱症クリニックを率いるM.ピーター マリンコビッチ医学博士だ。
マリンコビッチ博士の研究室では、表皮水疱症の様々なサブタイプに対する分子療法の開発に長年にわたり注力してきた。大きな前進として、マリンコビッチ博士らは、2022年12月15日発行のNew England Journal of Medicineに「ジストロフィー型表皮水疱症に対するベレマゲン・ゲペルパベック(B-VEC)の試験 〈Trial of Beremagene Geperpavec (B-VEC) for Dystrophic Epidermolysis Bullosa.〉」と題された論文を発表した。この研究の結論は、ジストロフィー性表皮水疱症患者の3ヶ月と6ヶ月の創傷の完全治癒は、プラセボよりもB-VECの局所投与でより可能性が高いというものだ。B-VECを投与された患者では、掻痒感と軽度の全身性副作用が観察された。ジストロフィー型表皮水疱症は、VII型コラーゲン(C7)の組み立てに関与するタンパク質をコードするCOL7A1の変異によって起こるまれな遺伝性水疱性皮膚疾患である。
Beremagene geperpavec(B-VEC)は、単純ヘルペスウイルス1型(HSV-1)をベースにした局所的な遺伝子治療で、正常なCOL7A1を送達することによりC7タンパク質を回復させるよう設計されている。この疾患に対するB-VECの耐久性と副作用を明らかにするために、より長期
遺伝的隔離の威力:FinnGenの研究により数百の新しい遺伝子が発見された。
 FinnGen研究コンソーシアムによる新しい成果は、フィンランドの健康研究環境がゲノム研究にとって紛れもない利点であることを示している。豊富な新規遺伝子の発見の中には、多くの衰弱性疾患に対するこれまで知られていなかった遺伝的危険因子が含まれている。これらの発見は、新しい治療法の開発を促進する可能性を秘めている。2017年の開始以来、FinnGen研究は、世界有数のバイオバンクに基づくゲノム研究プロジェクトに発展してきた。現在、FinnGenは、50万人のフィンランド人のゲノム情報と半世紀以上にわたる国民健康登録データを統合したリソースの構築を完了している。
2023 年 1 月 18 日に Nature に掲載されたFinnGen の主力研究は、フィンランドの健康データ、人口構造、法的枠組み、バイオバンキング組織など、フィンランドならではのビジネスチャンスを証明するもので、他では見ることができないものだ。このオープンアクセス論文は、「FinnGen は、十分に表現型が特定された孤立集団からの遺伝的洞察を提供する(FinnGen Provides Genetic Insights from a Well-Phenotyped Isolated Population)」と題されている。
2017年の開始以来、FinnGen研究は、世界有数のバイオバンクに基づくゲノム研究プロジェクトに発展している。現在、FinnGenは50万人のフィンランド人のゲノム情報と半世紀以上にわたる国民健康登録データを統合したリソースの構築を完了しつつある。Nature誌に掲載されたFinnGenの代表的な研究は、フィンランドの健康データ、人口構造、法的枠組み、バイオバンキング組織など、他では見られないフィンランド独自の機会を説得力ある形で証明している。
ここでは、FinnGenのチームが、2
FinnGen研究コンソーシアムによる新しい成果は、フィンランドの健康研究環境がゲノム研究にとって紛れもない利点であることを示している。豊富な新規遺伝子の発見の中には、多くの衰弱性疾患に対するこれまで知られていなかった遺伝的危険因子が含まれている。これらの発見は、新しい治療法の開発を促進する可能性を秘めている。2017年の開始以来、FinnGen研究は、世界有数のバイオバンクに基づくゲノム研究プロジェクトに発展してきた。現在、FinnGenは、50万人のフィンランド人のゲノム情報と半世紀以上にわたる国民健康登録データを統合したリソースの構築を完了している。
2023 年 1 月 18 日に Nature に掲載されたFinnGen の主力研究は、フィンランドの健康データ、人口構造、法的枠組み、バイオバンキング組織など、フィンランドならではのビジネスチャンスを証明するもので、他では見ることができないものだ。このオープンアクセス論文は、「FinnGen は、十分に表現型が特定された孤立集団からの遺伝的洞察を提供する(FinnGen Provides Genetic Insights from a Well-Phenotyped Isolated Population)」と題されている。
2017年の開始以来、FinnGen研究は、世界有数のバイオバンクに基づくゲノム研究プロジェクトに発展している。現在、FinnGenは50万人のフィンランド人のゲノム情報と半世紀以上にわたる国民健康登録データを統合したリソースの構築を完了しつつある。Nature誌に掲載されたFinnGenの代表的な研究は、フィンランドの健康データ、人口構造、法的枠組み、バイオバンキング組織など、他では見られないフィンランド独自の機会を説得力ある形で証明している。
ここでは、FinnGenのチームが、2
PMWC 2023が閉幕。バイオテック界の巨匠、リロイ・フッド博士の講演で熱気あふれる会議となった。
 2023年1月27日、シリコンバレーの中心地であるカリフォルニア州サンタクララにて、3日間にわたるPrecision Medicine World Conference 2023 (PMWC 2023) (Jan 25-27) "Celebrating 14 Years of Precision Medicine Innovation" が終了し、6つのトピックトラック(ファーマコゲノミクス、創薬・臨床研究におけるAI・データサイエンス、ポピュレーションスケールオミックス、イメージングアプリケーション、そして2つのショーケースセッション〈AI・データサイエンス、新興治療薬、ゲノム・微生物プロファイリング、臨床診断、臨床・研究ツール〉)が開催された。また、PMWCパイオニア賞4件、PMWCルミナリー賞2件が授与された。パイオニア賞は、デビッド・ベントリー博士, ダン・M・ローデン博士, リー・T・グリンバーグ博士, ダニエラ・ウシジマ博士に授与された。ルミナリー賞は、ガッド・ゲッツ博士とケリー・コードル博士に贈られた。最後に、バイオテクノロジーの伝説的人物で先駆者であるリロイ・フッド医学博士が、力強い未来志向のプレゼンテーションを行い、会議は閉幕した。
PMWCパイオニア賞は、精密医療に対する先見性と画期的な貢献により、初期の精密医療を推進し、今日の標準治療へと発展させる勢いをつけた由緒ある人物に贈られる賞だ。PMWCルミナリーアワードは、精密医療の臨床応用を加速させた著名人の最近の貢献を称えるものだ。
ベントリー博士は、「精密医療を変革したヒトゲノム計画やその他の大規模な遺伝的集団研究における指導的役割」が評価され、パイオニア賞を受賞した。ベントリー博士は、世界中の集団スケールでの精密医療を変革するために、高速で正確なヒト全ゲノム配列決定(WGS)の開発と展開に注力
2023年1月27日、シリコンバレーの中心地であるカリフォルニア州サンタクララにて、3日間にわたるPrecision Medicine World Conference 2023 (PMWC 2023) (Jan 25-27) "Celebrating 14 Years of Precision Medicine Innovation" が終了し、6つのトピックトラック(ファーマコゲノミクス、創薬・臨床研究におけるAI・データサイエンス、ポピュレーションスケールオミックス、イメージングアプリケーション、そして2つのショーケースセッション〈AI・データサイエンス、新興治療薬、ゲノム・微生物プロファイリング、臨床診断、臨床・研究ツール〉)が開催された。また、PMWCパイオニア賞4件、PMWCルミナリー賞2件が授与された。パイオニア賞は、デビッド・ベントリー博士, ダン・M・ローデン博士, リー・T・グリンバーグ博士, ダニエラ・ウシジマ博士に授与された。ルミナリー賞は、ガッド・ゲッツ博士とケリー・コードル博士に贈られた。最後に、バイオテクノロジーの伝説的人物で先駆者であるリロイ・フッド医学博士が、力強い未来志向のプレゼンテーションを行い、会議は閉幕した。
PMWCパイオニア賞は、精密医療に対する先見性と画期的な貢献により、初期の精密医療を推進し、今日の標準治療へと発展させる勢いをつけた由緒ある人物に贈られる賞だ。PMWCルミナリーアワードは、精密医療の臨床応用を加速させた著名人の最近の貢献を称えるものだ。
ベントリー博士は、「精密医療を変革したヒトゲノム計画やその他の大規模な遺伝的集団研究における指導的役割」が評価され、パイオニア賞を受賞した。ベントリー博士は、世界中の集団スケールでの精密医療を変革するために、高速で正確なヒト全ゲノム配列決定(WGS)の開発と展開に注力
8つの遺伝子発現で細菌感染とウイルス感染を90%の精度で識別可能。感染症を特定する新しい血液検査法が誕生。
 発展途上国では、抗生物質の処方のほとんどは無意味であるばかりでなく、その70〜80%は薬で治らないウイルス感染症に投与されていると推定されている。米国でも同様の問題があり、抗生物質の処方箋の30〜50%がウイルス感染症に投与されていると推定されている。このたび、スタンフォード大学医学部の研究者らが開発した遺伝子発現に基づく新しい検査法により、世界中の医師が細菌感染とウイルス感染を迅速かつ正確に区別できるようになり、抗生物質の過剰使用を減らせるようになるかもしれない。この検査は、患者の免疫系が感染症にどのように反応するかに基づいて行われるものだ。
これは、より広い範囲の細菌感染を考慮して、多様な世界集団で検証された最初の診断テストであり、抗生物質耐性に対処するために世界保健機関(WHO)と革新的新診断薬財団(Foundation for Innovative New Diagnostics)によって設定された精度目標を満たす唯一のテストである。この目標値には、細菌感染とウイルス感染を識別するために、少なくとも感度90%(真陽性を正しく識別すること)、特異度80%(真陰性を正しく識別すること)が設定されている。この新しいテストは、2023年12月20日のCell Reports Medicineに掲載され、「宿主反応に基づく頑健なシグネチャーが、世界の多様な集団における細菌感染とウイルス感染を識別する(A Robust Host-Response-Based Signature Distinguishes Bacterial and Viral Infections Across Diverse Global Populations)」 と題されている。
「抗菌剤耐性が継続的に上昇しているため、不適切な抗生物質の使用を減らすための努力がなされてきた。」と、この論文の主執
発展途上国では、抗生物質の処方のほとんどは無意味であるばかりでなく、その70〜80%は薬で治らないウイルス感染症に投与されていると推定されている。米国でも同様の問題があり、抗生物質の処方箋の30〜50%がウイルス感染症に投与されていると推定されている。このたび、スタンフォード大学医学部の研究者らが開発した遺伝子発現に基づく新しい検査法により、世界中の医師が細菌感染とウイルス感染を迅速かつ正確に区別できるようになり、抗生物質の過剰使用を減らせるようになるかもしれない。この検査は、患者の免疫系が感染症にどのように反応するかに基づいて行われるものだ。
これは、より広い範囲の細菌感染を考慮して、多様な世界集団で検証された最初の診断テストであり、抗生物質耐性に対処するために世界保健機関(WHO)と革新的新診断薬財団(Foundation for Innovative New Diagnostics)によって設定された精度目標を満たす唯一のテストである。この目標値には、細菌感染とウイルス感染を識別するために、少なくとも感度90%(真陽性を正しく識別すること)、特異度80%(真陰性を正しく識別すること)が設定されている。この新しいテストは、2023年12月20日のCell Reports Medicineに掲載され、「宿主反応に基づく頑健なシグネチャーが、世界の多様な集団における細菌感染とウイルス感染を識別する(A Robust Host-Response-Based Signature Distinguishes Bacterial and Viral Infections Across Diverse Global Populations)」 と題されている。
「抗菌剤耐性が継続的に上昇しているため、不適切な抗生物質の使用を減らすための努力がなされてきた。」と、この論文の主執
高齢の父親が子供に多くの遺伝子変異を受け継ぐ理由
 男性の生殖器官は、新しい遺伝子が出現するためのホットスポットとして機能している。そのため、父親から受け継ぐ突然変異の数が母親から受け継ぐ突然変異の数よりも多いということが説明できるかもしれない。しかし、なぜ年配の父親の方が若い父親よりも多くの突然変異を受け渡すのか、その理由は明らかにされていなかった。このようなよく知られた傾向の背景にあるメカニズムは、長い間謎のままだった。
このたび、ロックフェラー大学の研究者らが2023年1月12日にNature Ecology & Evolution誌に発表した新しい研究によると、高齢のオスのショウジョウバエが子孫に突然変異を受け渡す可能性が高い理由について述べられており、ヒトにおける遺伝性疾患のリスクに光を当てている。この論文は「ショウジョウバエの老化生殖線の転写および突然変異の特徴(Transcriptional and Mutational Signatures of the Drosophila Ageing Germline)」と題されている。
ロックフェラー大学のリ・ザオ博士の研究室では、精子形成として知られる生殖細胞から精子が作られる過程で生じる突然変異を研究している。その結果、突然変異は若いハエと年老いたハエの両方の精巣でよく見られるが、年老いたハエでは最初からより多く見られることが判明した。さらに、これらの変異の多くは、若いハエの精子形成過程では体内のゲノム修復機構によって除去されるようだが、年をとったハエの精巣では固定化されないことが判明した。
筆頭著者のエヴァン・ウィット博士(同研究室の元大学院生で、現在はバイオマリン製薬の計算生物学者)は、「我々は、古い生殖細胞ほど突然変異の修復効率が悪いのか、それとも単に古い生殖細胞ほど突然変異が多いのかを検証しようとしていた。我々の結果は、実際にはその両方で
男性の生殖器官は、新しい遺伝子が出現するためのホットスポットとして機能している。そのため、父親から受け継ぐ突然変異の数が母親から受け継ぐ突然変異の数よりも多いということが説明できるかもしれない。しかし、なぜ年配の父親の方が若い父親よりも多くの突然変異を受け渡すのか、その理由は明らかにされていなかった。このようなよく知られた傾向の背景にあるメカニズムは、長い間謎のままだった。
このたび、ロックフェラー大学の研究者らが2023年1月12日にNature Ecology & Evolution誌に発表した新しい研究によると、高齢のオスのショウジョウバエが子孫に突然変異を受け渡す可能性が高い理由について述べられており、ヒトにおける遺伝性疾患のリスクに光を当てている。この論文は「ショウジョウバエの老化生殖線の転写および突然変異の特徴(Transcriptional and Mutational Signatures of the Drosophila Ageing Germline)」と題されている。
ロックフェラー大学のリ・ザオ博士の研究室では、精子形成として知られる生殖細胞から精子が作られる過程で生じる突然変異を研究している。その結果、突然変異は若いハエと年老いたハエの両方の精巣でよく見られるが、年老いたハエでは最初からより多く見られることが判明した。さらに、これらの変異の多くは、若いハエの精子形成過程では体内のゲノム修復機構によって除去されるようだが、年をとったハエの精巣では固定化されないことが判明した。
筆頭著者のエヴァン・ウィット博士(同研究室の元大学院生で、現在はバイオマリン製薬の計算生物学者)は、「我々は、古い生殖細胞ほど突然変異の修復効率が悪いのか、それとも単に古い生殖細胞ほど突然変異が多いのかを検証しようとしていた。我々の結果は、実際にはその両方で
ワニだけが持つ超効率的ヘモグロビンの謎を解明
 インパラは時速80キロ以上のスピードで駆け抜け、9メートルもの距離を一気に跳び越えることができる。しかし、その金メダル級の運動能力は、サハラ砂漠以南の川辺では通用しない。水中から姿を現したナイルワニがインパラを捕らえるとき、その悪名高い歯は後ろ足に食らいつき、2000キログラム以上の力で顎を食い込ませる。しかし、インパラが死ぬのは水が原因である。深い呼吸をするワニは獲物を深いところまで引きずり込んで溺死させるのだ。ワニが待ち伏せに成功したのは、ナノサイズのスキューバタンクであるヘモグロビンが血流に乗って、肺から組織へゆっくりと、しかし着実に酸素を送り込むからである。この特殊なヘモグロビンの超効率性から、生物学者の中には、なぜ世界中の顎のある脊椎動物の中で、ワニだけが呼吸を最大限に活用する最適な方法を発見したのだろうと考える者もいる。
ネブラスカ大学リンカーン校のジェイ・ストルツ博士らは、ワニや鳥類の祖先である2億4千万年前の古生物のヘモグロビンを統計的に復元し、実験的に復活させることによって、その理由について新たな洞察を得た。ワニのヘモグロビンのユニークな特性は、以前の研究で示唆されたようなわずか数個の重要な突然変異を必要とするのではなく、赤血球の複雑な構成要素を散在させる相互に関連した21個の突然変異に由来していることが判明したのである。この複雑さと、1つの突然変異がヘモグロビンに引き起こす複数のノックオン効果により、自然界が数千万年かけても辿り着けないほど迷宮入りの進化経路が形成されたのかもしれないと、この研究者は述べている。
この研究の筆頭著者で、ネブラスカ大学のウィラ・キャザー生物科学教授であるストルツ博士は、「もし、そんな簡単なことなら、ほんの少し変えるだけで、誰もがやっていることだろう。」と語った。ヘモグロビンはすべて、肺で酸素と結合してから血流に乗り、
インパラは時速80キロ以上のスピードで駆け抜け、9メートルもの距離を一気に跳び越えることができる。しかし、その金メダル級の運動能力は、サハラ砂漠以南の川辺では通用しない。水中から姿を現したナイルワニがインパラを捕らえるとき、その悪名高い歯は後ろ足に食らいつき、2000キログラム以上の力で顎を食い込ませる。しかし、インパラが死ぬのは水が原因である。深い呼吸をするワニは獲物を深いところまで引きずり込んで溺死させるのだ。ワニが待ち伏せに成功したのは、ナノサイズのスキューバタンクであるヘモグロビンが血流に乗って、肺から組織へゆっくりと、しかし着実に酸素を送り込むからである。この特殊なヘモグロビンの超効率性から、生物学者の中には、なぜ世界中の顎のある脊椎動物の中で、ワニだけが呼吸を最大限に活用する最適な方法を発見したのだろうと考える者もいる。
ネブラスカ大学リンカーン校のジェイ・ストルツ博士らは、ワニや鳥類の祖先である2億4千万年前の古生物のヘモグロビンを統計的に復元し、実験的に復活させることによって、その理由について新たな洞察を得た。ワニのヘモグロビンのユニークな特性は、以前の研究で示唆されたようなわずか数個の重要な突然変異を必要とするのではなく、赤血球の複雑な構成要素を散在させる相互に関連した21個の突然変異に由来していることが判明したのである。この複雑さと、1つの突然変異がヘモグロビンに引き起こす複数のノックオン効果により、自然界が数千万年かけても辿り着けないほど迷宮入りの進化経路が形成されたのかもしれないと、この研究者は述べている。
この研究の筆頭著者で、ネブラスカ大学のウィラ・キャザー生物科学教授であるストルツ博士は、「もし、そんな簡単なことなら、ほんの少し変えるだけで、誰もがやっていることだろう。」と語った。ヘモグロビンはすべて、肺で酸素と結合してから血流に乗り、
英国グロスターシャー州に墜落した隕石から生命の構成要素を発見
 2021年に英国グロスターシャー州ウィンチコムの車道に不時着したウィンチコム隕石の有機物分析に関する新しい研究結果が発表された。ロンドン大学ロイヤル・ホロウェイ校地球科学科のクイニー・チャン博士を中心とした研究で、生命の起源の秘密を握る宇宙からの有機化合物が発見された。この研究は、2023年1月9日にMeteoritics & Planetary Science誌に掲載された。このオープンアクセスの論文は「早期回収されたCM2 Winchcombe炭素質コンドライトのアミノ酸および多環芳香族炭化水素組成について(The Amino Acid and Polycyclic Aromatic Hydrocarbon Compositions of the Promptly Recovered CM2 Winchcombe Carbonaceous Chondrite)」と題されている。
この研究では、分析により様々な有機物が見つかり、この隕石がかつて液体の水が存在した小惑星の一部であり、もしその小惑星が水にアクセスできたならば、化学反応が起こり、生命の構成要素であるアミノ酸やタンパク質に変化する分子が増えたかもしれないことが明らかにされている。
ウィンチコム隕石は、希少な炭素を多く含むコンドライト隕石(回収された全隕石の約4%、最大3.5重量%の炭素を含む)で、この種の隕石としては英国で初めて隕石落下現象が観測され、1000人以上の目撃者と多数の火球の映像が残っている。
ウィンチコム隕石のアミノ酸の存在量は、他の種類の炭素質コンドライト隕石に比べて10倍も低く、アミノ酸の検出量も限られていたため、研究は困難だった。しかし、この隕石が非常に迅速に回収・調査されたことにより、研究チームは地球環境と相互作用する前の隕石の有機物を調べることができた。この有機物は、この
2021年に英国グロスターシャー州ウィンチコムの車道に不時着したウィンチコム隕石の有機物分析に関する新しい研究結果が発表された。ロンドン大学ロイヤル・ホロウェイ校地球科学科のクイニー・チャン博士を中心とした研究で、生命の起源の秘密を握る宇宙からの有機化合物が発見された。この研究は、2023年1月9日にMeteoritics & Planetary Science誌に掲載された。このオープンアクセスの論文は「早期回収されたCM2 Winchcombe炭素質コンドライトのアミノ酸および多環芳香族炭化水素組成について(The Amino Acid and Polycyclic Aromatic Hydrocarbon Compositions of the Promptly Recovered CM2 Winchcombe Carbonaceous Chondrite)」と題されている。
この研究では、分析により様々な有機物が見つかり、この隕石がかつて液体の水が存在した小惑星の一部であり、もしその小惑星が水にアクセスできたならば、化学反応が起こり、生命の構成要素であるアミノ酸やタンパク質に変化する分子が増えたかもしれないことが明らかにされている。
ウィンチコム隕石は、希少な炭素を多く含むコンドライト隕石(回収された全隕石の約4%、最大3.5重量%の炭素を含む)で、この種の隕石としては英国で初めて隕石落下現象が観測され、1000人以上の目撃者と多数の火球の映像が残っている。
ウィンチコム隕石のアミノ酸の存在量は、他の種類の炭素質コンドライト隕石に比べて10倍も低く、アミノ酸の検出量も限られていたため、研究は困難だった。しかし、この隕石が非常に迅速に回収・調査されたことにより、研究チームは地球環境と相互作用する前の隕石の有機物を調べることができた。この有機物は、この
運動はなぜアンチエイジングに有効なのか?その理由を細胞レベルで解明
 運動は様々な病気から身を守ることが証明されており、科学的に知られている中で最も強力なアンチエイジングの手段かもしれない。しかし、運動は加齢に伴う健康状態の改善をもたらすが、その効果は加齢に伴い必然的に減少する。運動、体力、加齢の関係の根底にある細胞メカニズムは、まだ十分に解明されていない。2023年1月3日にPNASに掲載された論文では、ジョスリン糖尿病センターの研究者が、運動トレーニングによる体力向上における一つの細胞メカニズムの役割を調べ、モデル生物において老化に伴って起こる衰えを遅らせるアンチエイジング介入を特定した。この研究成果は、加齢に伴う筋肉機能向上のための新たな戦略への扉を開くものだ。この論文は「運動は、AMPKとミトコンドリアダイナミクスを通じて、老化中の体力を維持する(Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics)」と題されている。
「運動は、生活の質を向上させ、変性疾患から身を守るために広く採用されており、ヒトでは、長期の運動療法により総死亡率が低下する。我々のデータは、運動反応性に不可欠なメディエーターを特定し、加齢に伴う筋肉機能維持のための介入の入り口になるものだ。」と、ジョスリン糖尿病センターの上級研究員で膵島細胞・再生生物学部門長の T. キース・ブラックウェル博士は共同研究者として語っている。
その重要なメディエーターが、すべての真核細胞の中にあるエネルギー産生を担う特殊な構造体(オルガネラ)、ミトコンドリアの断片化と修復のサイクルである。ミトコンドリアの機能は健康に不可欠であり、機能不全に陥ったミトコンドリアを修復し、エネルギー産生小器官間の結合を回復させるというミトコンドリア動態の破綻は、心臓病や2型糖
運動は様々な病気から身を守ることが証明されており、科学的に知られている中で最も強力なアンチエイジングの手段かもしれない。しかし、運動は加齢に伴う健康状態の改善をもたらすが、その効果は加齢に伴い必然的に減少する。運動、体力、加齢の関係の根底にある細胞メカニズムは、まだ十分に解明されていない。2023年1月3日にPNASに掲載された論文では、ジョスリン糖尿病センターの研究者が、運動トレーニングによる体力向上における一つの細胞メカニズムの役割を調べ、モデル生物において老化に伴って起こる衰えを遅らせるアンチエイジング介入を特定した。この研究成果は、加齢に伴う筋肉機能向上のための新たな戦略への扉を開くものだ。この論文は「運動は、AMPKとミトコンドリアダイナミクスを通じて、老化中の体力を維持する(Exercise preserves physical fitness during aging through AMPK and mitochondrial dynamics)」と題されている。
「運動は、生活の質を向上させ、変性疾患から身を守るために広く採用されており、ヒトでは、長期の運動療法により総死亡率が低下する。我々のデータは、運動反応性に不可欠なメディエーターを特定し、加齢に伴う筋肉機能維持のための介入の入り口になるものだ。」と、ジョスリン糖尿病センターの上級研究員で膵島細胞・再生生物学部門長の T. キース・ブラックウェル博士は共同研究者として語っている。
その重要なメディエーターが、すべての真核細胞の中にあるエネルギー産生を担う特殊な構造体(オルガネラ)、ミトコンドリアの断片化と修復のサイクルである。ミトコンドリアの機能は健康に不可欠であり、機能不全に陥ったミトコンドリアを修復し、エネルギー産生小器官間の結合を回復させるというミトコンドリア動態の破綻は、心臓病や2型糖
脳を保護し感染や炎症を監視する脳の構成要素が発見された
 神経ネットワークの複雑さから基本的な生物学的機能・構造に至るまで、人間の脳はその秘密を不本意ながら明らかにしてくれるに過ぎない。神経イメージングと分子生物学の進歩により、科学者らはつい最近、生きた脳をこれまで達成できなかったレベルで詳細に研究し、その謎の多くを解き明かすことができるようになった。今回発見されたのは、これまで知られていなかった脳の構成要素で、脳を保護するバリアとして、また免疫細胞が脳に感染や炎症が起きないかどうかを監視するプラットフォームとして機能していることが、2023年1月5日付の米科学誌サイエンスに発表された。この論文は「クモ膜下腔を機能的に分割する中皮膜(A Mesothelium Divides the Subarachnoid Space into Functional Compartments)」と題されている。
この新しい研究は、ロチェスター大学およびコペンハーゲン大学のトランスレーショナル神経医学センターの共同ディレクターであるマイケン・ネーデルガード医学博士と、コペンハーゲン大学の神経解剖学教授であるシェルド・ムルゴード医学博士の研究室から発表されたものだ。ネーデルガード博士とその同僚らは、人間の脳の基本的な仕組みに関する理解を一変させ、神経科学の分野に重要な発見をした。その中には、これまで見落とされていたグリアと呼ばれる脳の細胞の多くの重要な機能や、グリンパティックシステムと名付けられた脳独自の排泄プロセスの詳細が含まれている。
ネーデルガード博士は、「脳内とその周辺の脳脊髄液(CSF)の流れを分離して制御する新しい解剖学的構造が発見されたことで、CSFが脳からの老廃物の輸送と除去だけでなく、脳の免疫防御をサポートするという高度な役割を果たすことが、より明確になった」と述べている。
この研究では、体の他の部分とバリアを作り、脳脊
神経ネットワークの複雑さから基本的な生物学的機能・構造に至るまで、人間の脳はその秘密を不本意ながら明らかにしてくれるに過ぎない。神経イメージングと分子生物学の進歩により、科学者らはつい最近、生きた脳をこれまで達成できなかったレベルで詳細に研究し、その謎の多くを解き明かすことができるようになった。今回発見されたのは、これまで知られていなかった脳の構成要素で、脳を保護するバリアとして、また免疫細胞が脳に感染や炎症が起きないかどうかを監視するプラットフォームとして機能していることが、2023年1月5日付の米科学誌サイエンスに発表された。この論文は「クモ膜下腔を機能的に分割する中皮膜(A Mesothelium Divides the Subarachnoid Space into Functional Compartments)」と題されている。
この新しい研究は、ロチェスター大学およびコペンハーゲン大学のトランスレーショナル神経医学センターの共同ディレクターであるマイケン・ネーデルガード医学博士と、コペンハーゲン大学の神経解剖学教授であるシェルド・ムルゴード医学博士の研究室から発表されたものだ。ネーデルガード博士とその同僚らは、人間の脳の基本的な仕組みに関する理解を一変させ、神経科学の分野に重要な発見をした。その中には、これまで見落とされていたグリアと呼ばれる脳の細胞の多くの重要な機能や、グリンパティックシステムと名付けられた脳独自の排泄プロセスの詳細が含まれている。
ネーデルガード博士は、「脳内とその周辺の脳脊髄液(CSF)の流れを分離して制御する新しい解剖学的構造が発見されたことで、CSFが脳からの老廃物の輸送と除去だけでなく、脳の免疫防御をサポートするという高度な役割を果たすことが、より明確になった」と述べている。
この研究では、体の他の部分とバリアを作り、脳脊
細胞内のイベントを長期記憶することができる自己組織化タンパク質による新手法が発明された
 細胞が日常的な機能を果たすとき、さまざまな遺伝子や細胞内経路がオンになる。このたびMITの技術者らは、これらのイベントの履歴を、光顕微鏡で画像化できる長いタンパク質鎖に書き込むよう、細胞を誘導した。この鎖を作るようにプログラムされた細胞は、特定の細胞事象をコード化するビルディングブロックを継続的に追加していった。その後、秩序だったタンパク質鎖を蛍光分子で標識し、顕微鏡で読み取ると、イベントのタイミングを再構築することができた。この技術は、記憶の形成、薬物治療への反応、遺伝子発現などのプロセスの根底にあるステップを明らかにするのに役立つと考えられる。
MITのエドワード・ボイデン博士(Y. Eva Tan神経技術 教授、MIT生物工学・脳認知科学教授、ハワードヒューズ医学研究所研究員、MITマクガバン脳研究所およびコーク統合がん研究所)は、「臓器と体のスケールで、数時間から数週間にわたって起こる多くの変化があるが、これは、長期間追跡することができない」と述べている。この研究者らは、この技術をより長い時間使えるように拡張できれば、老化や病気の進行などのプロセスの研究にも利用できるだろうと言う。
ボイデン博士は、2023年1月2日にNature Biotechnologyに掲載されたこの研究の筆頭著者だ。マクガバン研究所の元J. Douglas Tan博士研究員で、現在はミシガン大学の助教授であるチャンヤン・リンホウ博士は、この論文の主執筆者だ。このオープンアクセス論文は「光学的に読み取り可能な自己組織化タンパク質鎖に沿った細胞生理学的歴史の記録(Recording of Cellular Physiological Histories Alongically Readable Self-Asembling Protein Chains)」と題されている。
細胞の歴史
細胞が日常的な機能を果たすとき、さまざまな遺伝子や細胞内経路がオンになる。このたびMITの技術者らは、これらのイベントの履歴を、光顕微鏡で画像化できる長いタンパク質鎖に書き込むよう、細胞を誘導した。この鎖を作るようにプログラムされた細胞は、特定の細胞事象をコード化するビルディングブロックを継続的に追加していった。その後、秩序だったタンパク質鎖を蛍光分子で標識し、顕微鏡で読み取ると、イベントのタイミングを再構築することができた。この技術は、記憶の形成、薬物治療への反応、遺伝子発現などのプロセスの根底にあるステップを明らかにするのに役立つと考えられる。
MITのエドワード・ボイデン博士(Y. Eva Tan神経技術 教授、MIT生物工学・脳認知科学教授、ハワードヒューズ医学研究所研究員、MITマクガバン脳研究所およびコーク統合がん研究所)は、「臓器と体のスケールで、数時間から数週間にわたって起こる多くの変化があるが、これは、長期間追跡することができない」と述べている。この研究者らは、この技術をより長い時間使えるように拡張できれば、老化や病気の進行などのプロセスの研究にも利用できるだろうと言う。
ボイデン博士は、2023年1月2日にNature Biotechnologyに掲載されたこの研究の筆頭著者だ。マクガバン研究所の元J. Douglas Tan博士研究員で、現在はミシガン大学の助教授であるチャンヤン・リンホウ博士は、この論文の主執筆者だ。このオープンアクセス論文は「光学的に読み取り可能な自己組織化タンパク質鎖に沿った細胞生理学的歴史の記録(Recording of Cellular Physiological Histories Alongically Readable Self-Asembling Protein Chains)」と題されている。
細胞の歴史
新しいタイプのCRISPR遺伝子ハサミ(Cas12a2)を発見
 人間と同じように、細菌や古細菌もウイルスに攻撃されることがある。これらの微生物は、病原体に対する免疫防御戦略を独自に開発してきた。CRISPR-Casシステムなど、細菌が外敵から身を守るための防御システムは、多様なタンパク質と機能を有している。CRISPRリボ核酸(crRNA)は、「ガイドRNA」として、ウイルスのDNAなど、外来ゲノムの標的を切断するための領域を検出する。crRNAによって誘導されたCRISPR関連ヌクレアーゼ(Cas)は、ハサミのように標的を切断することができ、この自然界の戦略を人間は多くの技術で利用してきた。
「これまでさまざまなヌクレアーゼが新しい技術や改良技術に応用されてきたことを考えると、この分野の発見は社会に新たな利益をもたらすかもしれない」と、ヴュルツブルク・ヘルムホルツRNAベース感染症研究所(HIRI)のチェイス・バイゼル博士は研究動機を語っている。この研究所は、ブラウンシュヴァイク・ヘルムホルツ感染研究センターとヴュルツブルクのユリウス・マクシミリアン大学(JMU)の協力のもとで運営されている。バイゼル博士は、Benson Hill社(ミズーリ州)のマシュー・ベゲマン博士、米国ユタ州立大学のライアン・ジャクソン博士とともに、CRISPR-Casシステムの特定のセットに関する今回の研究を開始した。
この成果は、2023年1月4日付のNature誌に掲載され、同じくライアン・ジャクソン博士が率いる第2チームとテキサス大学のデイビッド・テイラー博士による詳細な構造解析も併せて発表された。このオープンアクセス論文は「Cas12a2はRNAをトリガーとしたdsDNAの破壊により、感染を中断させる(Cas12a2 Elicits Abortive Infection Through RNA-Triggered Destruction of
人間と同じように、細菌や古細菌もウイルスに攻撃されることがある。これらの微生物は、病原体に対する免疫防御戦略を独自に開発してきた。CRISPR-Casシステムなど、細菌が外敵から身を守るための防御システムは、多様なタンパク質と機能を有している。CRISPRリボ核酸(crRNA)は、「ガイドRNA」として、ウイルスのDNAなど、外来ゲノムの標的を切断するための領域を検出する。crRNAによって誘導されたCRISPR関連ヌクレアーゼ(Cas)は、ハサミのように標的を切断することができ、この自然界の戦略を人間は多くの技術で利用してきた。
「これまでさまざまなヌクレアーゼが新しい技術や改良技術に応用されてきたことを考えると、この分野の発見は社会に新たな利益をもたらすかもしれない」と、ヴュルツブルク・ヘルムホルツRNAベース感染症研究所(HIRI)のチェイス・バイゼル博士は研究動機を語っている。この研究所は、ブラウンシュヴァイク・ヘルムホルツ感染研究センターとヴュルツブルクのユリウス・マクシミリアン大学(JMU)の協力のもとで運営されている。バイゼル博士は、Benson Hill社(ミズーリ州)のマシュー・ベゲマン博士、米国ユタ州立大学のライアン・ジャクソン博士とともに、CRISPR-Casシステムの特定のセットに関する今回の研究を開始した。
この成果は、2023年1月4日付のNature誌に掲載され、同じくライアン・ジャクソン博士が率いる第2チームとテキサス大学のデイビッド・テイラー博士による詳細な構造解析も併せて発表された。このオープンアクセス論文は「Cas12a2はRNAをトリガーとしたdsDNAの破壊により、感染を中断させる(Cas12a2 Elicits Abortive Infection Through RNA-Triggered Destruction of
ヒト細胞の内部設計 20万枚の細胞画像データベースから、細胞がどのように自己組織化するかを見る新手法を開発
 アレン研究所の一部門であるアレン細胞科学研究所のチームは、数十万枚の高解像度画像を用いて、これまで定量化が極めて困難とされてきたヒト細胞の内部組織を数値化した。この研究により、同一条件下で培養された遺伝的に同一の細胞であっても、細胞の形状には様々なバリエーションがあることが明らかになった。この研究チームは、2023年1月4日にNatureに掲載された論文で、研究成果を報告している。このオープンアクセス論文は「 ヒトiPS細胞における細胞内組織統合とその変動(Integrated Intracellular Organization and Its Variations in Human iPS Cells)」 と題されている。
アレン細胞科学研究所の副所長で、主任研究員のマテウス・ヴィアナ博士と共にこの研究を率いたスザンヌ・ラフェルスキー博士は、「健康や病気において細胞がどのように変化するかを理解しようとするこの分野に欠けているものは、この種の組織を厳密に取り扱う方法だ。我々はまだその情報を利用できていないのだ。」と語っている。
この研究は、生物学者がさまざまな種類の細胞の組織化を測定可能かつ定量的に理解するためのロードマップを提供するものである、とラフェルスキー博士は語っている。また、アレン研究所のチームが研究しているヒト人工多能性幹細胞の組織化に関するいくつかの重要な原則も明らかになった。健康な状態で細胞がどのように組織化されるのか、また、「正常」に含まれるあらゆる変動性を理解することは、病気の際に何が問題となるのかを科学者がよりよく理解するのに役立つ。この研究に使用された画像データセット、遺伝子操作された幹細胞、コードはすべて一般に公開されており、他の科学者も利用することができる。
「細胞生物学が難解に感じられる理由の一つは、同じ種類の細胞であっても、一つひ
アレン研究所の一部門であるアレン細胞科学研究所のチームは、数十万枚の高解像度画像を用いて、これまで定量化が極めて困難とされてきたヒト細胞の内部組織を数値化した。この研究により、同一条件下で培養された遺伝的に同一の細胞であっても、細胞の形状には様々なバリエーションがあることが明らかになった。この研究チームは、2023年1月4日にNatureに掲載された論文で、研究成果を報告している。このオープンアクセス論文は「 ヒトiPS細胞における細胞内組織統合とその変動(Integrated Intracellular Organization and Its Variations in Human iPS Cells)」 と題されている。
アレン細胞科学研究所の副所長で、主任研究員のマテウス・ヴィアナ博士と共にこの研究を率いたスザンヌ・ラフェルスキー博士は、「健康や病気において細胞がどのように変化するかを理解しようとするこの分野に欠けているものは、この種の組織を厳密に取り扱う方法だ。我々はまだその情報を利用できていないのだ。」と語っている。
この研究は、生物学者がさまざまな種類の細胞の組織化を測定可能かつ定量的に理解するためのロードマップを提供するものである、とラフェルスキー博士は語っている。また、アレン研究所のチームが研究しているヒト人工多能性幹細胞の組織化に関するいくつかの重要な原則も明らかになった。健康な状態で細胞がどのように組織化されるのか、また、「正常」に含まれるあらゆる変動性を理解することは、病気の際に何が問題となるのかを科学者がよりよく理解するのに役立つ。この研究に使用された画像データセット、遺伝子操作された幹細胞、コードはすべて一般に公開されており、他の科学者も利用することができる。
「細胞生物学が難解に感じられる理由の一つは、同じ種類の細胞であっても、一つひ
シングルセルRNAシーケンスを用い、アルツハイマー病などの認知機能障害における脳脊髄液の役割が明らかに。
 重さ約1300gの脳が重く感じないのは、脳と脊髄の中を流れる脳脊髄液の中に浮いているからだ。脳と頭蓋骨の間にあるこの液体バリアは、頭を打ったときに脳を保護し、脳に栄養を補給する。しかし、脳脊髄液にはもう一つ、あまり知られていないが、脳を免疫的に保護する重要な働きがある。しかし、この機能はこれまであまり研究されてこなかった。今回、ノースウェスタン大学の研究により、アルツハイマー病などの認知機能障害における脳脊髄液の役割が明らかになった。
この発見は、神経変性のプロセスに新たな手がかりを与えるものだと、研究主導者であるノースウェスタン大学ファインバーグ医学部神経学助教授のデビッド・ゲート博士は述べている。
本研究は、2022年12月13日、Cell誌に掲載された。このオープンアクセス論文は「健康な脳の老化と認知機能障害における脳脊髄液の免疫調節障害(Cerebrospinal Fluid Immune Dysregulation During Healthy Brain Aging and Cognitive Impairment)」と題されている。
本研究では、加齢に伴い、髄液の免疫系が制御不能になることを明らかにした。また、アルツハイマー病などの認知機能障害を持つ人では、脳脊髄液の免疫系が健康な人とは大きく異なっていることも発見された。
「我々は今、健康な老化と神経変性に伴う脳の免疫システムを垣間見ることができた。この免疫リザーバーは、脳の炎症の治療に使われたり、認知症の人の脳の炎症レベルを判断する診断薬として使われる可能性がある。」と、ゲート博士は語っている。
「我々は、健康な脳と病気の脳に存在するこの重要な免疫リザーバーを徹底的に分析した。」とゲート博士。彼のチームはデータを公開しており、その結果はオンラインでアクセスすることができる。
脳脊髄液を分析す
重さ約1300gの脳が重く感じないのは、脳と脊髄の中を流れる脳脊髄液の中に浮いているからだ。脳と頭蓋骨の間にあるこの液体バリアは、頭を打ったときに脳を保護し、脳に栄養を補給する。しかし、脳脊髄液にはもう一つ、あまり知られていないが、脳を免疫的に保護する重要な働きがある。しかし、この機能はこれまであまり研究されてこなかった。今回、ノースウェスタン大学の研究により、アルツハイマー病などの認知機能障害における脳脊髄液の役割が明らかになった。
この発見は、神経変性のプロセスに新たな手がかりを与えるものだと、研究主導者であるノースウェスタン大学ファインバーグ医学部神経学助教授のデビッド・ゲート博士は述べている。
本研究は、2022年12月13日、Cell誌に掲載された。このオープンアクセス論文は「健康な脳の老化と認知機能障害における脳脊髄液の免疫調節障害(Cerebrospinal Fluid Immune Dysregulation During Healthy Brain Aging and Cognitive Impairment)」と題されている。
本研究では、加齢に伴い、髄液の免疫系が制御不能になることを明らかにした。また、アルツハイマー病などの認知機能障害を持つ人では、脳脊髄液の免疫系が健康な人とは大きく異なっていることも発見された。
「我々は今、健康な老化と神経変性に伴う脳の免疫システムを垣間見ることができた。この免疫リザーバーは、脳の炎症の治療に使われたり、認知症の人の脳の炎症レベルを判断する診断薬として使われる可能性がある。」と、ゲート博士は語っている。
「我々は、健康な脳と病気の脳に存在するこの重要な免疫リザーバーを徹底的に分析した。」とゲート博士。彼のチームはデータを公開しており、その結果はオンラインでアクセスすることができる。
脳脊髄液を分析す
これまで知られていなかった老化を促進するメカニズムが明らかに。転写産物の長さが老化に関与。
 ノースウェスタン大学の研究者は、これまで知られていなかった老化を促進するメカニズムを発見した。彼らは新しい研究で、ヒト、マウス、ラット、メダカから採取したさまざまな組織のトランスクリプトームデータを人工知能で解析した結果、遺伝子の転写産物の長さが、加齢に伴う分子レベルの変化のほとんどを説明できることを発見した。その結果、遺伝子の転写産物の長さが、加齢に伴って起こる分子レベルの変化のほとんどを説明できることを発見した。
すべての細胞は、長い遺伝子と短い遺伝子の活性のバランスをとる必要がある。研究者らは、長い遺伝子は長寿に、短い遺伝子は短寿につながることを発見した。また、老化した遺伝子は長さに応じて活性が変化することもわかった。具体的には、加齢に伴い、短い遺伝子に活性が移行するのだ。そのため、細胞内の遺伝子活性のバランスが崩れてしまうのだ。驚くべきことにこの発見はほぼ全世界共通であった。研究チームは、このパターンを、ヒトを含む複数の動物、および研究で分析した多くの組織(血液、筋肉、骨、および肝臓、心臓、腸、脳、肺などの臓器)で発見したのである。この新たな発見は、老化のスピードを遅らせたり、逆に老化させたりするための介入策につながる可能性がある。
このオープンアクセス論文は、2022年12月9日にNature Agingに掲載され、「老化は全身の長さに関連するトランスクリプトームの不均衡 (Aging Is Associated with Systemic Length-Associated Transcriptome Imbalance.)」と題されている。
「遺伝子の活性の変化はとてもとても小さく、この小さな変化が何千もの遺伝子に関わっている。」「この変化は、異なる組織、異なる動物で一貫していることがわかった。この変化は、異なる組織、異なる動物で一貫していることがわ
ノースウェスタン大学の研究者は、これまで知られていなかった老化を促進するメカニズムを発見した。彼らは新しい研究で、ヒト、マウス、ラット、メダカから採取したさまざまな組織のトランスクリプトームデータを人工知能で解析した結果、遺伝子の転写産物の長さが、加齢に伴う分子レベルの変化のほとんどを説明できることを発見した。その結果、遺伝子の転写産物の長さが、加齢に伴って起こる分子レベルの変化のほとんどを説明できることを発見した。
すべての細胞は、長い遺伝子と短い遺伝子の活性のバランスをとる必要がある。研究者らは、長い遺伝子は長寿に、短い遺伝子は短寿につながることを発見した。また、老化した遺伝子は長さに応じて活性が変化することもわかった。具体的には、加齢に伴い、短い遺伝子に活性が移行するのだ。そのため、細胞内の遺伝子活性のバランスが崩れてしまうのだ。驚くべきことにこの発見はほぼ全世界共通であった。研究チームは、このパターンを、ヒトを含む複数の動物、および研究で分析した多くの組織(血液、筋肉、骨、および肝臓、心臓、腸、脳、肺などの臓器)で発見したのである。この新たな発見は、老化のスピードを遅らせたり、逆に老化させたりするための介入策につながる可能性がある。
このオープンアクセス論文は、2022年12月9日にNature Agingに掲載され、「老化は全身の長さに関連するトランスクリプトームの不均衡 (Aging Is Associated with Systemic Length-Associated Transcriptome Imbalance.)」と題されている。
「遺伝子の活性の変化はとてもとても小さく、この小さな変化が何千もの遺伝子に関わっている。」「この変化は、異なる組織、異なる動物で一貫していることがわかった。この変化は、異なる組織、異なる動物で一貫していることがわ
脳組織のビタミンD濃度を初めて調べた研究で、ビタミンDが多い脳は認知機能が高いことが判明。
 認知症を患う人の数は世界で5,500万人と推定されており、この数は高齢化社会の到来とともに増加すると予想されている。認知症の進行を遅らせたり、止めたりする治療法を見つけるには、認知症を引き起こす要因についてより深く理解する必要がある。タフツ大学の研究者らは、認知機能の低下の程度が異なる成人の脳組織におけるビタミンD濃度を調べた初めての研究を完了した。その結果、脳内のビタミンD濃度が高い人ほど、認知機能が優れていることが分かった。このオープンアクセス論文は、2022年12月7日にアルツハイマー病協会誌Alzheimer's & Dementiaに掲載され、「地域在住の高齢者における脳内ビタミンD群と認知機能低下および神経病理学的変化(Brain Vitamin D Forms, Cognitive Decline, and Neuropathology in Community-Dwelling Older Adults)」と題されている。
タフツ大学Jean Mayer USDA Human Nutrition Research Center on Aging(HNRCA)所長で、HNRCAビタミンKチームの主任研究員であるサラ・ブース博士は、「この研究は、アルツハイマー病やその他の認知症のような疾患から加齢脳を守るために、食物や栄養素でどのように回復力を生み出すかを研究することの重要性を補強するのもだ」と述べている。ビタミンDは、免疫反応や健康な骨の維持など、体内の多くの機能をサポートしている。食事では、脂肪分の多い魚や強化飲料(牛乳やオレンジジュースなど)、短時間の日光浴でビタミンDを摂取することができる。
ビタミンKチームの科学者であり、タフツ大学フリードマン栄養科学・政策大学院の准教授である筆頭著者のカイラ・シー博士は、「ビタミンDに関する多くの研究
認知症を患う人の数は世界で5,500万人と推定されており、この数は高齢化社会の到来とともに増加すると予想されている。認知症の進行を遅らせたり、止めたりする治療法を見つけるには、認知症を引き起こす要因についてより深く理解する必要がある。タフツ大学の研究者らは、認知機能の低下の程度が異なる成人の脳組織におけるビタミンD濃度を調べた初めての研究を完了した。その結果、脳内のビタミンD濃度が高い人ほど、認知機能が優れていることが分かった。このオープンアクセス論文は、2022年12月7日にアルツハイマー病協会誌Alzheimer's & Dementiaに掲載され、「地域在住の高齢者における脳内ビタミンD群と認知機能低下および神経病理学的変化(Brain Vitamin D Forms, Cognitive Decline, and Neuropathology in Community-Dwelling Older Adults)」と題されている。
タフツ大学Jean Mayer USDA Human Nutrition Research Center on Aging(HNRCA)所長で、HNRCAビタミンKチームの主任研究員であるサラ・ブース博士は、「この研究は、アルツハイマー病やその他の認知症のような疾患から加齢脳を守るために、食物や栄養素でどのように回復力を生み出すかを研究することの重要性を補強するのもだ」と述べている。ビタミンDは、免疫反応や健康な骨の維持など、体内の多くの機能をサポートしている。食事では、脂肪分の多い魚や強化飲料(牛乳やオレンジジュースなど)、短時間の日光浴でビタミンDを摂取することができる。
ビタミンKチームの科学者であり、タフツ大学フリードマン栄養科学・政策大学院の准教授である筆頭著者のカイラ・シー博士は、「ビタミンDに関する多くの研究
UCSFの研究者らが、組織再生、傷の治癒、神経再生に役立つ細胞接着剤を合成。この成果は再生医療に活力を与える可能性がある。
 カリフォルニア大学サンフランシスコ校(UCSF)の研究者らは、「細胞接着剤」のような働きをする分子を設計し、細胞同士の結合を正確に指示することを可能にした。この発見は、再生医療の長年の目標である組織や臓器の形成に向けた大きな一歩となる。接着剤分子は、体内の至るところに自然に存在し、何十兆個もの細胞を高度に組織化されたパターンで結びつけている。この分子は、構造体を形成し、神経回路を作り、免疫細胞を標的へ誘導する。また、接着は細胞間のコミュニケーションを促進し、身体が全体として自己調節機能を維持するのに役立っている。2022年12月12日付のNature誌に掲載されたこの論文「合成細胞接着分子による多細胞体形成のプログラミング(Programming Multicellular Assembly with Synthetic Cell Adhesion Molecules)」では、研究者らが特定のパートナー細胞と予測可能な方法で結合し、複雑な多細胞集合体を形成する、カスタマイズした接着分子を含む細胞を工学的に作製したことが報告されている。
バイヤーズ細胞分子薬理学の特別教授であり、UCSFの細胞デザイン研究所の所長である筆頭著者のウェンデル・リム博士は、「我々は、細胞がどの細胞と相互作用するかを制御し、その相互作用の性質も制御できるような方法で細胞を設計することができた。これは、組織や臓器のような新しい構造を構築するための扉を開くものだ。」と語っている。
細胞間の結合を再生する
身体の組織や臓器は子宮内で形成され始め、幼少期まで発達を続ける。大人になるまでに、これらの生成過程を導く分子的な指示の多くは消失し、神経など一部の組織は怪我や病気から回復することができなくなる。リム博士は、成体細胞が新しい結合を作るように工学的に設計することで、この問題を克服したいと考えている
カリフォルニア大学サンフランシスコ校(UCSF)の研究者らは、「細胞接着剤」のような働きをする分子を設計し、細胞同士の結合を正確に指示することを可能にした。この発見は、再生医療の長年の目標である組織や臓器の形成に向けた大きな一歩となる。接着剤分子は、体内の至るところに自然に存在し、何十兆個もの細胞を高度に組織化されたパターンで結びつけている。この分子は、構造体を形成し、神経回路を作り、免疫細胞を標的へ誘導する。また、接着は細胞間のコミュニケーションを促進し、身体が全体として自己調節機能を維持するのに役立っている。2022年12月12日付のNature誌に掲載されたこの論文「合成細胞接着分子による多細胞体形成のプログラミング(Programming Multicellular Assembly with Synthetic Cell Adhesion Molecules)」では、研究者らが特定のパートナー細胞と予測可能な方法で結合し、複雑な多細胞集合体を形成する、カスタマイズした接着分子を含む細胞を工学的に作製したことが報告されている。
バイヤーズ細胞分子薬理学の特別教授であり、UCSFの細胞デザイン研究所の所長である筆頭著者のウェンデル・リム博士は、「我々は、細胞がどの細胞と相互作用するかを制御し、その相互作用の性質も制御できるような方法で細胞を設計することができた。これは、組織や臓器のような新しい構造を構築するための扉を開くものだ。」と語っている。
細胞間の結合を再生する
身体の組織や臓器は子宮内で形成され始め、幼少期まで発達を続ける。大人になるまでに、これらの生成過程を導く分子的な指示の多くは消失し、神経など一部の組織は怪我や病気から回復することができなくなる。リム博士は、成体細胞が新しい結合を作るように工学的に設計することで、この問題を克服したいと考えている
地球温暖化の影響にどう対処するか?200万年前の古代DNAが進化の歴史から伝えること。
 グリーンランド北部の氷河期の堆積物から、環境DNAの微小な断片が発見された。このDNA断片は、これまでシベリアのマンモスの骨から採取されたDNAの記録よりも100万年古いものであり、最先端の技術を使って発見された。この古代DNAは、極端な気候変動を乗り越えた200万年前の生態系をマッピングするために使用された。この研究者らは、今回の結果が現在の地球温暖化がもたらす長期的な環境破壊を予測するのに役立つと期待している。この発見は、エスケ・ウィラースレフ教授とカート H. ケアー教授が率いる科学者チームによってなされた。ウィラースレフ教授はケンブリッジ大学セントジョンズカレッジのフェローであり、コペンハーゲン大学のルンドベック財団ジオジェネティクスセンターのディレクターで、地質学の専門家であるケアー教授もここを拠点としている。
粘土や石英の中に隠れていた41個の使用可能なサンプルを発見した結果が、2022年12月7日、Nature誌に掲載された。このオープンアクセスの論文は「環境DNAが解き明かすグリーンランドの200万年前の生態系 (A 2-Million-Old Ecosystem in Greenland Uncovered By Environmental DNA)」と題されている。
ウィラースレフ教授は「100万年以上の歴史にまたがる新章がついに開かれ、我々は初めて、そこまで遡った過去の生態系のDNAを直接見ることができるようになった。DNAはすぐに劣化してしまうが、適切な環境下であれば、今では誰もが想像もつかないほど過去に遡ることができる。」と述べている。
ケアー教授は「この古代DNAサンプルは、2万年以上にわたって蓄積された堆積物の奥深くに埋もれているものが発見された。その堆積物は最終的に氷や永久凍土の中に保存され、重要なことは、200万年の間、人間に邪魔
グリーンランド北部の氷河期の堆積物から、環境DNAの微小な断片が発見された。このDNA断片は、これまでシベリアのマンモスの骨から採取されたDNAの記録よりも100万年古いものであり、最先端の技術を使って発見された。この古代DNAは、極端な気候変動を乗り越えた200万年前の生態系をマッピングするために使用された。この研究者らは、今回の結果が現在の地球温暖化がもたらす長期的な環境破壊を予測するのに役立つと期待している。この発見は、エスケ・ウィラースレフ教授とカート H. ケアー教授が率いる科学者チームによってなされた。ウィラースレフ教授はケンブリッジ大学セントジョンズカレッジのフェローであり、コペンハーゲン大学のルンドベック財団ジオジェネティクスセンターのディレクターで、地質学の専門家であるケアー教授もここを拠点としている。
粘土や石英の中に隠れていた41個の使用可能なサンプルを発見した結果が、2022年12月7日、Nature誌に掲載された。このオープンアクセスの論文は「環境DNAが解き明かすグリーンランドの200万年前の生態系 (A 2-Million-Old Ecosystem in Greenland Uncovered By Environmental DNA)」と題されている。
ウィラースレフ教授は「100万年以上の歴史にまたがる新章がついに開かれ、我々は初めて、そこまで遡った過去の生態系のDNAを直接見ることができるようになった。DNAはすぐに劣化してしまうが、適切な環境下であれば、今では誰もが想像もつかないほど過去に遡ることができる。」と述べている。
ケアー教授は「この古代DNAサンプルは、2万年以上にわたって蓄積された堆積物の奥深くに埋もれているものが発見された。その堆積物は最終的に氷や永久凍土の中に保存され、重要なことは、200万年の間、人間に邪魔
新アプローチで自己免疫の起源を解明。自己免疫疾患の診断や治療法開発に道を拓く。
 自己免疫疾患は、人違えの結果であると考えられている。侵入してきた病原体から体を守るために武装してパトロール中の免疫細胞が、正常なヒトの細胞を感染した細胞と勘違いして、自分の健康な組織に武器を突きつけてしまうのである。しかし、ほとんどの場合、その間違いの原因である、病原体のタンパク質と危険なほど似ている正常なヒトのタンパク質の断片を見つけることは、科学者にとって困難であった。そのため、多くの自己免疫疾患に対する効果的な診断法や特異的な治療法の開発には、このパズルの欠片が妨げになっていた。しかし、その状況はようやく変わりつつある。ワシントン大学医学部(セントルイス)、スタンフォード大学医学部、オックスフォード大学の研究チームが、自己免疫を引き起こす重要なタンパク質断片と、それに反応する免疫細胞を見つける方法を開発した。
この研究成果は、2022年12月7日にNature誌に掲載され、自己免疫疾患の診断と治療に有望な道を開くものだ。この論文は、「自己免疫関連T細胞レセプターはHLA-B*27結合ペプチドを認識する(Autoimmune-Associated T Cell Receptors Recognize HLA-B*27-Bound Peptides)」と題されている。
「すべての遺伝子の中で、HLA遺伝子はヒト集団の中で最も多くのバリエーションを持っている。この論文は、ある種のHLA遺伝子変異がなぜ特定の疾患と関連しているのかを解明するための戦略を概説している。また、ヒトと微生物のタンパク質間の交差反応性が、少なくとも2つの疾患、そしておそらく他の多くの疾患において自己免疫を促進するという強力な証拠も示している。今、我々は、根本的なドライバーを理解し、患者のために利益をもたらす可能性が最も高いアプローチに焦点を当て始めている。」と、ワシントン大学のSam J. L
自己免疫疾患は、人違えの結果であると考えられている。侵入してきた病原体から体を守るために武装してパトロール中の免疫細胞が、正常なヒトの細胞を感染した細胞と勘違いして、自分の健康な組織に武器を突きつけてしまうのである。しかし、ほとんどの場合、その間違いの原因である、病原体のタンパク質と危険なほど似ている正常なヒトのタンパク質の断片を見つけることは、科学者にとって困難であった。そのため、多くの自己免疫疾患に対する効果的な診断法や特異的な治療法の開発には、このパズルの欠片が妨げになっていた。しかし、その状況はようやく変わりつつある。ワシントン大学医学部(セントルイス)、スタンフォード大学医学部、オックスフォード大学の研究チームが、自己免疫を引き起こす重要なタンパク質断片と、それに反応する免疫細胞を見つける方法を開発した。
この研究成果は、2022年12月7日にNature誌に掲載され、自己免疫疾患の診断と治療に有望な道を開くものだ。この論文は、「自己免疫関連T細胞レセプターはHLA-B*27結合ペプチドを認識する(Autoimmune-Associated T Cell Receptors Recognize HLA-B*27-Bound Peptides)」と題されている。
「すべての遺伝子の中で、HLA遺伝子はヒト集団の中で最も多くのバリエーションを持っている。この論文は、ある種のHLA遺伝子変異がなぜ特定の疾患と関連しているのかを解明するための戦略を概説している。また、ヒトと微生物のタンパク質間の交差反応性が、少なくとも2つの疾患、そしておそらく他の多くの疾患において自己免疫を促進するという強力な証拠も示している。今、我々は、根本的なドライバーを理解し、患者のために利益をもたらす可能性が最も高いアプローチに焦点を当て始めている。」と、ワシントン大学のSam J. L
アルツハイマー病の症状が現れる何年も前に "毒性"タンパク質を検出する新しい血液検査法が開発された。
 現在では、アルツハイマー病の診断を受けるのは、物忘れなどの症状が現れてからというのが一般的だ。その時点では、最良の治療法は、症状の進行を遅らせるだけだ。しかし、アルツハイマー病の種は、診断が可能になるような認知機能障害が現れるずっと前に、何年も、あるいは何十年も前に播かれていることが研究で明らかにされている。この種はアミロイドβタンパク質で、これが誤って折り畳まれて塊となり、オリゴマーと呼ばれる小さな凝集体を形成する。このアミロイドβの「毒性」オリゴマーが、現在も解明されていないプロセスを経て、やがてアルツハイマー病に発展すると考えられている。
ワシントン大学の研究者が率いるチームは、血液サンプル中のアミロイドβオリゴマーレベルを測定できるラボ検査を開発した。研究チームが2022年12月5日にPNAS誌で発表した論文では、頭文字をとってSOBAと呼ばれるこの検査は、アルツハイマー病患者の血液からはオリゴマーを検出できたが、血液サンプルを採取した時点で認知障害の兆候のなかった対照群のほとんどのメンバーからは検出できなかったという。
このPNASの論文は「SOBA アミロイド誘発性毒性オリゴマー検出のための可溶性オリゴマー結合アッセイの開発とテスト。(SOBA: Development and Testing of a Soluble Oligomer Binding Assay for Detection of Amyloidogenic Toxic Oligomers.)」と題されている。
SOBAは対照群の11人の血液中でオリゴマーを検出したが、このうち10人は、数年後に軽度認知障害またはアルツハイマー病と思われる脳病理を発症していた。つまり、これらの10人は、症状が現れる前にSOBAによって毒性オリゴマーが検出されていたのである。
「臨床医や研究者が待ち望ん
現在では、アルツハイマー病の診断を受けるのは、物忘れなどの症状が現れてからというのが一般的だ。その時点では、最良の治療法は、症状の進行を遅らせるだけだ。しかし、アルツハイマー病の種は、診断が可能になるような認知機能障害が現れるずっと前に、何年も、あるいは何十年も前に播かれていることが研究で明らかにされている。この種はアミロイドβタンパク質で、これが誤って折り畳まれて塊となり、オリゴマーと呼ばれる小さな凝集体を形成する。このアミロイドβの「毒性」オリゴマーが、現在も解明されていないプロセスを経て、やがてアルツハイマー病に発展すると考えられている。
ワシントン大学の研究者が率いるチームは、血液サンプル中のアミロイドβオリゴマーレベルを測定できるラボ検査を開発した。研究チームが2022年12月5日にPNAS誌で発表した論文では、頭文字をとってSOBAと呼ばれるこの検査は、アルツハイマー病患者の血液からはオリゴマーを検出できたが、血液サンプルを採取した時点で認知障害の兆候のなかった対照群のほとんどのメンバーからは検出できなかったという。
このPNASの論文は「SOBA アミロイド誘発性毒性オリゴマー検出のための可溶性オリゴマー結合アッセイの開発とテスト。(SOBA: Development and Testing of a Soluble Oligomer Binding Assay for Detection of Amyloidogenic Toxic Oligomers.)」と題されている。
SOBAは対照群の11人の血液中でオリゴマーを検出したが、このうち10人は、数年後に軽度認知障害またはアルツハイマー病と思われる脳病理を発症していた。つまり、これらの10人は、症状が現れる前にSOBAによって毒性オリゴマーが検出されていたのである。
「臨床医や研究者が待ち望ん
血液中の細胞外小胞を音波を利用して分離・選別し、多様な診断や治療に役立てる可能性を発見。
 デューク大学のエンジニア達は、音波を利用して血液中に見られる最も小さな粒子を数分で分離・選別する装置を開発した。この技術は「バーチャル・ピラー」と呼ばれる概念に基づいており、科学研究と医療応用の両方に恩恵をもたらす可能性がある。小細胞外小胞(small extracellular vesicles;sEV)と呼ばれる小さな生体ナノ粒子は、体内のあらゆる種類の細胞から放出され、細胞間のコミュニケーションや病気の感染に大きな役割を果たすと考えられている。波柱励起共振による音響ナノスケール分離(Acoustic Nanoscale Separation via Wave-Pillar Excitation Resonance;略称ANSWER)と名付けられたこの新技術は、10分以内に生体流体からこれらのナノ粒子を引き抜くだけでなく、生物学的役割が異なると考えられるサイズカテゴリーに分類することも可能だという。
この成果は、2022年11月23日、Science Advancesのオンライン版に掲載された。オープンアクセス論文は「細胞外ベシクルの生物物理学的分画への解決策。波柱励起共鳴による音響ナノスケール分離 (ANSWER) [A Solution to the Biophysical Fractionation of Extracellular Vesicles: Acoustic Nanoscale Separation via Wave-Pillar Excitation Resonance (ANSWER) ]」と題されている。
デューク大学ウィリアム・ベバン特別教授(機械工学・材料科学)のトニー・ジュン・ホァン博士は、「これらのナノ粒子は医療診断や治療に大きな可能性を秘めているが、現在の分離・選別技術では数時間から数日かかり、一貫性がなく、生産量や純度が低く、
デューク大学のエンジニア達は、音波を利用して血液中に見られる最も小さな粒子を数分で分離・選別する装置を開発した。この技術は「バーチャル・ピラー」と呼ばれる概念に基づいており、科学研究と医療応用の両方に恩恵をもたらす可能性がある。小細胞外小胞(small extracellular vesicles;sEV)と呼ばれる小さな生体ナノ粒子は、体内のあらゆる種類の細胞から放出され、細胞間のコミュニケーションや病気の感染に大きな役割を果たすと考えられている。波柱励起共振による音響ナノスケール分離(Acoustic Nanoscale Separation via Wave-Pillar Excitation Resonance;略称ANSWER)と名付けられたこの新技術は、10分以内に生体流体からこれらのナノ粒子を引き抜くだけでなく、生物学的役割が異なると考えられるサイズカテゴリーに分類することも可能だという。
この成果は、2022年11月23日、Science Advancesのオンライン版に掲載された。オープンアクセス論文は「細胞外ベシクルの生物物理学的分画への解決策。波柱励起共鳴による音響ナノスケール分離 (ANSWER) [A Solution to the Biophysical Fractionation of Extracellular Vesicles: Acoustic Nanoscale Separation via Wave-Pillar Excitation Resonance (ANSWER) ]」と題されている。
デューク大学ウィリアム・ベバン特別教授(機械工学・材料科学)のトニー・ジュン・ホァン博士は、「これらのナノ粒子は医療診断や治療に大きな可能性を秘めているが、現在の分離・選別技術では数時間から数日かかり、一貫性がなく、生産量や純度が低く、
空間トランスクリプトミクス解析を駆使してアルツハイマー病のリスク遺伝子の脳内における役割を特定
 アルツハイマー病の主要な発症メカニズムとして知られる炎症と、ミクログリアと呼ばれる脳の掃除屋細胞に集中して存在する遺伝子との関連について、マウントサイナイ医科大学とニューヨーク大学医学部の研究者による新たな研究結果が発表された。この研究結果は、難治性疾患であるアルツハイマー病の治療法の新たなターゲットとなる可能性がある。この遺伝子はイノシトールポリリン酸-5-ホスファターゼD(INPP5D)として知られており、The Journal of the Alzheimer's Associationの「アルツハイマー病と認知症」 誌 の11月30日号に掲載された。
ミクログリアは、アルツハイマー病の認知症に関連する死にかけた細胞やアミロイド斑を除去するスカベンジャーとして働く脳内の免疫細胞だ。ヒト遺伝学的研究により、当初、INPP5Dはアルツハイマー病のリスクと関連していた。他の研究により、アルツハイマー病患者の死後脳組織においてINPP5Dのレベルが上昇していることが明らかになったが、この遺伝子が病気の初期または後期に果たす特定の役割や、これらの機能変化に寄与するメカニズムはまだ分かっていなかった。
脳内のINPP5Dはミクログリアに集中しているため、共同研究者のマウントサイナイ医科大学のミシェル・E・エーリック医学博士(神経学、小児科、遺伝学・ゲノム科学教授)は、遺伝子操作により、病変の発生時にマウスINPP5D遺伝子をミクログリア内で「ノックダウン」(機能を停止)させたマウスを用いて実験を行った。これにより、欠損した遺伝子が脳組織に及ぼす具体的な影響をより正確に把握することができた。その後、約3ヵ月後にプラークの蓄積とミクログリアの挙動を測定した。INPP5Dはアルツハイマー病患者の脳で発現していることが知られていたため、この遺伝子を不活性化したマウスは、アルツハイ
アルツハイマー病の主要な発症メカニズムとして知られる炎症と、ミクログリアと呼ばれる脳の掃除屋細胞に集中して存在する遺伝子との関連について、マウントサイナイ医科大学とニューヨーク大学医学部の研究者による新たな研究結果が発表された。この研究結果は、難治性疾患であるアルツハイマー病の治療法の新たなターゲットとなる可能性がある。この遺伝子はイノシトールポリリン酸-5-ホスファターゼD(INPP5D)として知られており、The Journal of the Alzheimer's Associationの「アルツハイマー病と認知症」 誌 の11月30日号に掲載された。
ミクログリアは、アルツハイマー病の認知症に関連する死にかけた細胞やアミロイド斑を除去するスカベンジャーとして働く脳内の免疫細胞だ。ヒト遺伝学的研究により、当初、INPP5Dはアルツハイマー病のリスクと関連していた。他の研究により、アルツハイマー病患者の死後脳組織においてINPP5Dのレベルが上昇していることが明らかになったが、この遺伝子が病気の初期または後期に果たす特定の役割や、これらの機能変化に寄与するメカニズムはまだ分かっていなかった。
脳内のINPP5Dはミクログリアに集中しているため、共同研究者のマウントサイナイ医科大学のミシェル・E・エーリック医学博士(神経学、小児科、遺伝学・ゲノム科学教授)は、遺伝子操作により、病変の発生時にマウスINPP5D遺伝子をミクログリア内で「ノックダウン」(機能を停止)させたマウスを用いて実験を行った。これにより、欠損した遺伝子が脳組織に及ぼす具体的な影響をより正確に把握することができた。その後、約3ヵ月後にプラークの蓄積とミクログリアの挙動を測定した。INPP5Dはアルツハイマー病患者の脳で発現していることが知られていたため、この遺伝子を不活性化したマウスは、アルツハイ
脊髄組織修復用のハイブリッド生体材料の合成に成功。脊髄損傷治療に応用の可能性。
 アイルランドのリムリック大学で開発されたユニークな新素材が、脊髄損傷の治療に大きな可能性を示した。リムリック大学バーナル研究所で行われた全く新しい研究が、2022年11月22日にBiomaterials Researchに掲載され、脊髄組織修復の分野でエキサイティングな進歩を遂げた。このオープンアクセス論文は、「脊髄組織修復のための導電性PEDOTナノ粒子集積足場(Electroconductive PEDOT Nanoparticle Integrated Scaffolds for Spinal Cord Tissue Repair)」と題されている。
リムリック大学で開発されたナノ粒子状の新しいハイブリッドバイオマテリアルが、組織工学分野における既存の実践を基に、脊髄損傷後の修復・再生を促進するための合成に成功した。リムリック大学工学部モーリス・N・コリンズ准教授と筆頭著者のアレキサンドラ・セラフィン氏(リムリック大学博士課程)率いる研究チームは、新しい種類の足場材料と独自の新しい導電性ポリマー複合体を用いて、脊髄損傷の治療を前進させる可能性のある新しい組織の成長・生成を促進させることに成功した。
「脊髄損傷(Spinal Cord Injury: SCI)は、人が生涯に負う可能性のある外傷の中で最も衰弱しやすいものの1つであり、その人の生活のあらゆる側面に影響を及ぼす。この衰弱性疾患は、損傷レベル以下の麻痺をもたらし、米国だけでも、SCI患者ケアのための年間医療費は97億ドルにのぼる。現在、広く利用できる治療法がないため、この分野の継続的な研究は、患者の生活の質を向上させる治療法を見つけるために非常に重要であり、研究分野は、新しい治療戦略のための組織工学に目を向けている。」「組織工学の分野は、提供される臓器や組織の不足という世界的な問題の解決を目指しており、
アイルランドのリムリック大学で開発されたユニークな新素材が、脊髄損傷の治療に大きな可能性を示した。リムリック大学バーナル研究所で行われた全く新しい研究が、2022年11月22日にBiomaterials Researchに掲載され、脊髄組織修復の分野でエキサイティングな進歩を遂げた。このオープンアクセス論文は、「脊髄組織修復のための導電性PEDOTナノ粒子集積足場(Electroconductive PEDOT Nanoparticle Integrated Scaffolds for Spinal Cord Tissue Repair)」と題されている。
リムリック大学で開発されたナノ粒子状の新しいハイブリッドバイオマテリアルが、組織工学分野における既存の実践を基に、脊髄損傷後の修復・再生を促進するための合成に成功した。リムリック大学工学部モーリス・N・コリンズ准教授と筆頭著者のアレキサンドラ・セラフィン氏(リムリック大学博士課程)率いる研究チームは、新しい種類の足場材料と独自の新しい導電性ポリマー複合体を用いて、脊髄損傷の治療を前進させる可能性のある新しい組織の成長・生成を促進させることに成功した。
「脊髄損傷(Spinal Cord Injury: SCI)は、人が生涯に負う可能性のある外傷の中で最も衰弱しやすいものの1つであり、その人の生活のあらゆる側面に影響を及ぼす。この衰弱性疾患は、損傷レベル以下の麻痺をもたらし、米国だけでも、SCI患者ケアのための年間医療費は97億ドルにのぼる。現在、広く利用できる治療法がないため、この分野の継続的な研究は、患者の生活の質を向上させる治療法を見つけるために非常に重要であり、研究分野は、新しい治療戦略のための組織工学に目を向けている。」「組織工学の分野は、提供される臓器や組織の不足という世界的な問題の解決を目指しており、
正常な脳細胞から神経膠芽腫細胞への進化を研究。新たな抗癌剤標的の発見にも期待。
 癌細胞が健康な脳細胞から進化して治療を回避する仕組みを理解することで、最も一般的で致死的な脳腫瘍の1つである膠芽腫の新しい薬物療法の可能性が開けることが、新研究で明らかになった。南オーストラリアのフリンダース大学と南オーストラリア保健医療研究所(SAHMRI)の研究チームは、神経科学と腫瘍学を融合させることで、この致命的な疾患を治療する新しい方法を見出すことができると期待している。
フリンダース大学のセドリック・バーディ准教授(SAHMRIのヒト神経生理学・遺伝学研究室のグループリーダー)は、「膠芽腫は誰もがかかる可能性があり、診断後5年以上生存する患者はわずか5%だ。治療上の大きな課題は、このような脳腫瘍細胞の多様性と適応性だ。患者によって、膠芽腫の腫瘍はさまざまな割合の数種類の細胞で構成されている。根絶を困難にしているのは、これらのバリエーションと、治療から隠れて逃れるために素早くその正体を変える驚くべき能力なのだ。しかし、最近の遺伝学の進歩により、膠芽腫の中に見られる細胞型は、癌化する前の元の細胞とある程度の類似性を保ち、成長・生存のため、あるいはそのアイデンティティを変えるときに脳細胞と共通の分子パスウェイを使用することが分かってきた。」と述べている。
研究チームは、Trends in Cancer誌に掲載されたこの新研究で、腫瘍細胞が治療から逃れるために用いる可能性のあるパスウェイを明らかにするために、これらの類似点と相違点を探った。
この研究の主執筆者である博士課程学生のイヌシ・デ・シルバ氏は、「我々の研究が示唆するのは、健康な脳細胞の遺伝学から学んで、膠芽腫癌細胞の脆弱性を狙えるかもしれないということだ。脳細胞は、環境変化に応じて素早くアイデンティティを変えることができる点では、癌細胞ほど優れていない。もし、癌細胞のこの隠れた遺伝的弱点を利用し増幅す
癌細胞が健康な脳細胞から進化して治療を回避する仕組みを理解することで、最も一般的で致死的な脳腫瘍の1つである膠芽腫の新しい薬物療法の可能性が開けることが、新研究で明らかになった。南オーストラリアのフリンダース大学と南オーストラリア保健医療研究所(SAHMRI)の研究チームは、神経科学と腫瘍学を融合させることで、この致命的な疾患を治療する新しい方法を見出すことができると期待している。
フリンダース大学のセドリック・バーディ准教授(SAHMRIのヒト神経生理学・遺伝学研究室のグループリーダー)は、「膠芽腫は誰もがかかる可能性があり、診断後5年以上生存する患者はわずか5%だ。治療上の大きな課題は、このような脳腫瘍細胞の多様性と適応性だ。患者によって、膠芽腫の腫瘍はさまざまな割合の数種類の細胞で構成されている。根絶を困難にしているのは、これらのバリエーションと、治療から隠れて逃れるために素早くその正体を変える驚くべき能力なのだ。しかし、最近の遺伝学の進歩により、膠芽腫の中に見られる細胞型は、癌化する前の元の細胞とある程度の類似性を保ち、成長・生存のため、あるいはそのアイデンティティを変えるときに脳細胞と共通の分子パスウェイを使用することが分かってきた。」と述べている。
研究チームは、Trends in Cancer誌に掲載されたこの新研究で、腫瘍細胞が治療から逃れるために用いる可能性のあるパスウェイを明らかにするために、これらの類似点と相違点を探った。
この研究の主執筆者である博士課程学生のイヌシ・デ・シルバ氏は、「我々の研究が示唆するのは、健康な脳細胞の遺伝学から学んで、膠芽腫癌細胞の脆弱性を狙えるかもしれないということだ。脳細胞は、環境変化に応じて素早くアイデンティティを変えることができる点では、癌細胞ほど優れていない。もし、癌細胞のこの隠れた遺伝的弱点を利用し増幅す
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill