前立腺癌がどのように二次腫瘍を引き起こすかについて新しい洞察が発表された
 前立腺癌細胞が動き広がり始めるためにどのようなメカニズムが使用されるのかについて、分子レベルでの理解の高まりは、長期的には、進行性の前立腺癌の治療のための新しい機会を提供するかもしれない。これについて、スウェーデンのウメオ大学病理学教授のMaréne Landström医学博士(写真)が発表したばかりの新しい研究成果が示唆している。この研究はウプサラ大学の研究者および日本の昭和薬科大学の伊東 進 博士と共同で行われたものだ。この研究は、2020年9月3日にiScienceでオンラインで公開された。 このオープンアクセスの論文は「Smad7がTGF-βによって誘導されるc-Junの転写を促進し、HDAC6が前立腺癌細胞の浸潤を促進する(Smad7 Enhances TGF-β-Induced Transcription of c-Jun and HDAC6 Promoting Invasion of Prostate Cancer Cells.)」と題されている。
「シグナル伝達分子内の特定のアミノ酸が癌細胞の動員に重要な役割を果たし、そのようにして転移のリスクを高めていることを示すことができる」とLandström博士は述べている。
この研究では、細胞の成長と特殊化の方法を調節する成長因子TGF-β(トランスフォーミング成長因子ベータ)を研究した。 以前の研究では、多くの形態の癌におけるTGF-βの過剰産生が示されている。1つは前立腺癌だ。 高レベルのTGF-βは、癌細胞を刺激して人体に拡散し、生命を脅かす二次腫瘍、いわゆる転移を引き起こす成長因子の結果として、予後不良および低生存率と強く関連していることが証明されている。TGF-βは、TGF-βシグナル伝達鎖の活性成分であるタンパク質Smad7の発現を調節する。 健康な細胞では、Smad7は負のフィードバックを介して継
前立腺癌細胞が動き広がり始めるためにどのようなメカニズムが使用されるのかについて、分子レベルでの理解の高まりは、長期的には、進行性の前立腺癌の治療のための新しい機会を提供するかもしれない。これについて、スウェーデンのウメオ大学病理学教授のMaréne Landström医学博士(写真)が発表したばかりの新しい研究成果が示唆している。この研究はウプサラ大学の研究者および日本の昭和薬科大学の伊東 進 博士と共同で行われたものだ。この研究は、2020年9月3日にiScienceでオンラインで公開された。 このオープンアクセスの論文は「Smad7がTGF-βによって誘導されるc-Junの転写を促進し、HDAC6が前立腺癌細胞の浸潤を促進する(Smad7 Enhances TGF-β-Induced Transcription of c-Jun and HDAC6 Promoting Invasion of Prostate Cancer Cells.)」と題されている。
「シグナル伝達分子内の特定のアミノ酸が癌細胞の動員に重要な役割を果たし、そのようにして転移のリスクを高めていることを示すことができる」とLandström博士は述べている。
この研究では、細胞の成長と特殊化の方法を調節する成長因子TGF-β(トランスフォーミング成長因子ベータ)を研究した。 以前の研究では、多くの形態の癌におけるTGF-βの過剰産生が示されている。1つは前立腺癌だ。 高レベルのTGF-βは、癌細胞を刺激して人体に拡散し、生命を脅かす二次腫瘍、いわゆる転移を引き起こす成長因子の結果として、予後不良および低生存率と強く関連していることが証明されている。TGF-βは、TGF-βシグナル伝達鎖の活性成分であるタンパク質Smad7の発現を調節する。 健康な細胞では、Smad7は負のフィードバックを介して継
Johnson&Johnsonは6万人の被験者を対象としたCOVID-19ワクチン候補のフェーズ3有効性試験を開始
 COVID-19 のほとんどの人は比較的軽度の症状だが、一部の人は重度の肺炎と呼吸不全を発症し、死に至る可能性がある。Beth Israel Deaconess Medical Center(BIDMC)の免疫学者Dan H. Barouch医学博士らは、最近発表されたこれまでの研究で、COVID-19ワクチン候補が中和抗体を産生し、COVID-19を引き起こすウイルスSARS-CoV-2から非ヒト霊長類(NHP)を強力に保護することを示した。2020年9月3日にNature Medicineでオンラインで公開された新しい研究で、Barouch博士らは、最適なワクチンがシリアンハムスターに強力な免疫反応を誘発し、体重減少、肺炎、死亡などの重篤な臨床疾患を予防することを実証した。 このオープンアクセス論文は「Ad26ワクチンがハムスターのSARS-CoV-2重症臨床疾患から保護する(Ad26 Vaccine Protects Against SARS-CoV-2 Severe Clinical Disease in Hamsters.)」と題されている。
「最近、Ad26ベースのSARS-CoV-2ワクチンがアカゲザルに強力な防御を提供したことを報告した。このワクチンは現在、ヒトで評価されている」と、BIDMCのウイルス学およびワクチン研究センターの所長であるBarouch博士は述べている。 「しかし、ヒト以外の霊長類は通常、重篤な臨床疾患を発症しないため、このワクチンが、臨床疾患の影響を受けやすいハムスターのSARS-CoV-2による重度の肺炎と死亡を予防できるかどうかを研究することが重要だった。」
BIDMCとJohnson&Johnson(J&J)の共同開発により開発されたワクチンは、アデノウイルス血清型26(Ad26)と呼ばれる一般的な風邪ウイルスを使用して、S
COVID-19 のほとんどの人は比較的軽度の症状だが、一部の人は重度の肺炎と呼吸不全を発症し、死に至る可能性がある。Beth Israel Deaconess Medical Center(BIDMC)の免疫学者Dan H. Barouch医学博士らは、最近発表されたこれまでの研究で、COVID-19ワクチン候補が中和抗体を産生し、COVID-19を引き起こすウイルスSARS-CoV-2から非ヒト霊長類(NHP)を強力に保護することを示した。2020年9月3日にNature Medicineでオンラインで公開された新しい研究で、Barouch博士らは、最適なワクチンがシリアンハムスターに強力な免疫反応を誘発し、体重減少、肺炎、死亡などの重篤な臨床疾患を予防することを実証した。 このオープンアクセス論文は「Ad26ワクチンがハムスターのSARS-CoV-2重症臨床疾患から保護する(Ad26 Vaccine Protects Against SARS-CoV-2 Severe Clinical Disease in Hamsters.)」と題されている。
「最近、Ad26ベースのSARS-CoV-2ワクチンがアカゲザルに強力な防御を提供したことを報告した。このワクチンは現在、ヒトで評価されている」と、BIDMCのウイルス学およびワクチン研究センターの所長であるBarouch博士は述べている。 「しかし、ヒト以外の霊長類は通常、重篤な臨床疾患を発症しないため、このワクチンが、臨床疾患の影響を受けやすいハムスターのSARS-CoV-2による重度の肺炎と死亡を予防できるかどうかを研究することが重要だった。」
BIDMCとJohnson&Johnson(J&J)の共同開発により開発されたワクチンは、アデノウイルス血清型26(Ad26)と呼ばれる一般的な風邪ウイルスを使用して、S
新しく発見された樹状細胞は、呼吸器感染症に対する免疫応答に重要な役割を果たすことが判明
 新しいタイプの抗原提示免疫細胞を特定したという免疫学の教科書が変わる可能性がある発見が、ベルギーのVIB-UGent Center for Inflammation ResearchのBart Lambrecht 博士、Martin Guilliams 博士 Hamida Hammad 博士、Charlotte Scott 博士を含む国際的な研究チームによって行われた。2020年5月8日にImmunityのオンラインで公開されたこの論文は、「炎症性2型cDCがcDC1とマクロファージの機能を獲得して呼吸器ウイルス感染に対する免疫を調整する(Inflammatory Type 2 cDCs Acquire Features of cDC1s and Macrophages to Orchestrate Immunity to Respiratory Virus Infection.)」と題されている。
樹状細胞の拡張ファミリーの一部であるこれらの細胞は、呼吸器ウイルス感染時に他の免疫細胞に抗原を提示する上で重要な役割を果たし、回復期の血漿がウイルス感染患者の免疫応答を高めるのにどのように役立つかを説明できるという。人体が感染に直面すると、炎症と発熱で反応する。これは、免疫システムが機能していることを示しており、軍の兵士のように多くの細胞の活性化につながる。樹状細胞はその軍隊の将軍だ。彼らは、「侵入者」に由来する抗原を免疫系の細胞に提示することにより、感染した細胞を殺すように兵士を正確に活性化し、指示することができる。体内で抗原提示機能を実行する樹状細胞 にはいくつかの種類がある。従来の初期の樹状細胞は、感染がない場合でも、危険な侵入者がないか継続的に身体をスキャンする。感染によって引き起こされた炎症があると、樹状細胞の別のサブセットが炎症性単球から出現する。単球由来樹状細胞
新しいタイプの抗原提示免疫細胞を特定したという免疫学の教科書が変わる可能性がある発見が、ベルギーのVIB-UGent Center for Inflammation ResearchのBart Lambrecht 博士、Martin Guilliams 博士 Hamida Hammad 博士、Charlotte Scott 博士を含む国際的な研究チームによって行われた。2020年5月8日にImmunityのオンラインで公開されたこの論文は、「炎症性2型cDCがcDC1とマクロファージの機能を獲得して呼吸器ウイルス感染に対する免疫を調整する(Inflammatory Type 2 cDCs Acquire Features of cDC1s and Macrophages to Orchestrate Immunity to Respiratory Virus Infection.)」と題されている。
樹状細胞の拡張ファミリーの一部であるこれらの細胞は、呼吸器ウイルス感染時に他の免疫細胞に抗原を提示する上で重要な役割を果たし、回復期の血漿がウイルス感染患者の免疫応答を高めるのにどのように役立つかを説明できるという。人体が感染に直面すると、炎症と発熱で反応する。これは、免疫システムが機能していることを示しており、軍の兵士のように多くの細胞の活性化につながる。樹状細胞はその軍隊の将軍だ。彼らは、「侵入者」に由来する抗原を免疫系の細胞に提示することにより、感染した細胞を殺すように兵士を正確に活性化し、指示することができる。体内で抗原提示機能を実行する樹状細胞 にはいくつかの種類がある。従来の初期の樹状細胞は、感染がない場合でも、危険な侵入者がないか継続的に身体をスキャンする。感染によって引き起こされた炎症があると、樹状細胞の別のサブセットが炎症性単球から出現する。単球由来樹状細胞
既存薬物のエブセレンがCOVID-19の新しい治療戦略の開発に役立つ可能性
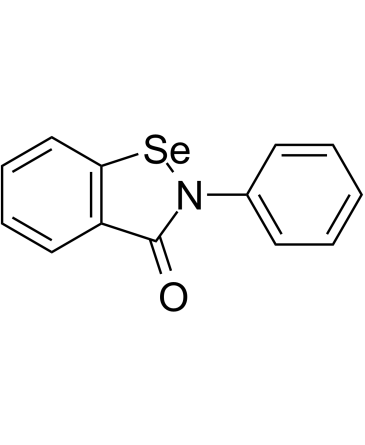 2019年後半に中国の武漢市で初めて出現したSARS-CoV-2ウイルスは、世界中で病気と死を引き起こしている。 既に承認された医薬品の転用を含め、 COVID-19 を治療するための複数のソリューションが検討されてきたが、この研究は非常に有望な治療オプションを指摘している。シカゴ大学のプリツカー分子工学大学院(PME)の研究チームは、最先端のコンピューターシミュレーションを使用して、この世界的なパンデミックの解決策を迅速に追跡できる既存の薬物を特定した。 彼らの発見は、2020年8月14日にScience Advancesのオンラインで公開された。このオープンアクセス論文は「SARS CoV 2 Main 4 Proteaseへのエブセレン結合活性の分子特性(Molecular Characterization of Ebselen Binding Activity to SARS CoV 2 Main 4 Protease)」と題されている。
2月初旬、パンデミックの急速な進展を懸念して、Juan de Pablo 博士とその生徒らは、分子モデリングの専門知識を利用して、病気の治療法を見つけた。 彼らだけではなかった。 世界中の他のグループは、SARS-CoV-2ウイルスに対する潜在的な使用について、既存の何千もの化合物を迅速にスクリーニングするためにスーパーコンピューターを使用し始めていた。「ハイスループットスクリーニングに用いられる化合物は多数あるので、それらの計算は必然的にいくつかの単純化を伴う必要があり、その結果は実験とより洗練された計算を使用して評価されなければならない。」de Pablo 博士はそう説明した。研究者らはまず、標的とするウイルスの弱点を見つけることに集中した。 彼らは主なプロテアーゼであるMproを選んだ。 Mproは、ウイルスのライフサイク
2019年後半に中国の武漢市で初めて出現したSARS-CoV-2ウイルスは、世界中で病気と死を引き起こしている。 既に承認された医薬品の転用を含め、 COVID-19 を治療するための複数のソリューションが検討されてきたが、この研究は非常に有望な治療オプションを指摘している。シカゴ大学のプリツカー分子工学大学院(PME)の研究チームは、最先端のコンピューターシミュレーションを使用して、この世界的なパンデミックの解決策を迅速に追跡できる既存の薬物を特定した。 彼らの発見は、2020年8月14日にScience Advancesのオンラインで公開された。このオープンアクセス論文は「SARS CoV 2 Main 4 Proteaseへのエブセレン結合活性の分子特性(Molecular Characterization of Ebselen Binding Activity to SARS CoV 2 Main 4 Protease)」と題されている。
2月初旬、パンデミックの急速な進展を懸念して、Juan de Pablo 博士とその生徒らは、分子モデリングの専門知識を利用して、病気の治療法を見つけた。 彼らだけではなかった。 世界中の他のグループは、SARS-CoV-2ウイルスに対する潜在的な使用について、既存の何千もの化合物を迅速にスクリーニングするためにスーパーコンピューターを使用し始めていた。「ハイスループットスクリーニングに用いられる化合物は多数あるので、それらの計算は必然的にいくつかの単純化を伴う必要があり、その結果は実験とより洗練された計算を使用して評価されなければならない。」de Pablo 博士はそう説明した。研究者らはまず、標的とするウイルスの弱点を見つけることに集中した。 彼らは主なプロテアーゼであるMproを選んだ。 Mproは、ウイルスのライフサイク
COVID-19の病原性は、宿主MicroRNAの枯渇によるものという仮説が発表された
 なぜ COVID-19 ウイルスは致命的であるのに、他の多くのコロナウイルスは無害で風邪をひくだけなのか? ポーランドとアメリカのアラバマ大学バーミンガム校(UAB)の研究チームがその答えを提案した。COVID-19ウイルスはマイクロRNAの「スポンジ」として機能するという。ポーランドのグダニスク医科大学の Rafal Bartoszewski 博士らによるこの仮説は、American Journal of Physiology-Lung Cellular and Molecular Physiologyの展望として、2020年8月5日にオンラインで公開された。 この論文は、「SARS-CoV-2は特定の宿主miRNAの枯渇を通じて細胞応答を調節する可能性がある(SARS-CoV-2 May Regulate Cellular Responses Through Depletion of Specific Host miRNAs)」と題されている。
この作用は、ウイルスの複製を助け、宿主の免疫反応を妨げる方法で宿主のマイクロRNAレベルを調節する。 この検証可能な仮説は、現在の文献の分析およびCOVID-19ウイルスと他の6つのコロナウイルスのバイオインフォマティクス研究から導かれた。 ヒトマイクロRNA(miRNA)は、約22の塩基で構成される短いノンコーディングRNAだ。 それらは、細胞の特定のメッセンジャーRNAとの相補的なペアリングによって遺伝子発現を調節するように作用する。 そのペアリングはメッセンジャーRNAをサイレンシングさせ、タンパク質に翻訳されるのを防ぐ。したがって、miRNAは、細胞代謝や、ストレスやウイルス感染などの有害な課題に対する細胞の応答を微調整するコントローラーだ。 COVID-19ウイルスのようなウイルスRNAを複製することは、全細胞
なぜ COVID-19 ウイルスは致命的であるのに、他の多くのコロナウイルスは無害で風邪をひくだけなのか? ポーランドとアメリカのアラバマ大学バーミンガム校(UAB)の研究チームがその答えを提案した。COVID-19ウイルスはマイクロRNAの「スポンジ」として機能するという。ポーランドのグダニスク医科大学の Rafal Bartoszewski 博士らによるこの仮説は、American Journal of Physiology-Lung Cellular and Molecular Physiologyの展望として、2020年8月5日にオンラインで公開された。 この論文は、「SARS-CoV-2は特定の宿主miRNAの枯渇を通じて細胞応答を調節する可能性がある(SARS-CoV-2 May Regulate Cellular Responses Through Depletion of Specific Host miRNAs)」と題されている。
この作用は、ウイルスの複製を助け、宿主の免疫反応を妨げる方法で宿主のマイクロRNAレベルを調節する。 この検証可能な仮説は、現在の文献の分析およびCOVID-19ウイルスと他の6つのコロナウイルスのバイオインフォマティクス研究から導かれた。 ヒトマイクロRNA(miRNA)は、約22の塩基で構成される短いノンコーディングRNAだ。 それらは、細胞の特定のメッセンジャーRNAとの相補的なペアリングによって遺伝子発現を調節するように作用する。 そのペアリングはメッセンジャーRNAをサイレンシングさせ、タンパク質に翻訳されるのを防ぐ。したがって、miRNAは、細胞代謝や、ストレスやウイルス感染などの有害な課題に対する細胞の応答を微調整するコントローラーだ。 COVID-19ウイルスのようなウイルスRNAを複製することは、全細胞
臓器オンチップマイクロシステムの使用で卵巣癌転移の機序解明に成果が得られた
 テキサスA&M大学の生物医学工学部および医学生理学部の助教授Abhishek Jain博士(写真)は、MDアンダーソン癌センターの婦人科腫瘍学および癌生物学の研究者らと協力して、卵巣癌腫瘍、血管、血小板の間の相互作用について研究を行っている。この研究者らは、腫瘍が血管の障壁を破り、これが血小板を含む血液細胞とのコミュニケーションを可能にすることを発見した。 これらの腫瘍が血小板と接触すると、転移する可能性がある。 この共同研究の成果は、2020年7月27日にBlood Advancesのオンラインに掲載された。 この論文は「OvCa-Chip Microsystemが卵巣癌の血管内皮介在性血小板溢出を再現する(OvCa-Chip Microsystem Recreates Vascular Endothelium–Mediated Platelet Extravasation in Ovarian Cancer.)」と題されている。
以前、研究者らは血小板が卵巣癌転移の開始因子の1つであることを理解していたが、何が血小板を腫瘍細胞に導入することにつながったのか分からなかった。動物モデルでこの関係を観察するので苦労する代わりに、Jain博士のチームは新しい解決策を創り出した。それは、USBドライブサイズのマイクロ流体医療デバイス「organ-on-a-chip」だ。このチームはOvCa-Chip(ovarian cancer chip)を設計して、腫瘍と血小板の間の生物学的プロセスを研究者がより簡単に確認できるようにした。血栓症と止血に関する国際学会へのインタビューで、Jain博士は次のように説明した。 「血管と共培養でき、血液細胞と相互作用できる。これらの相互作用について学習したら、次に、薬物がこれらの種類の相互作用にどのように影響するかを調査するために進むことがで
テキサスA&M大学の生物医学工学部および医学生理学部の助教授Abhishek Jain博士(写真)は、MDアンダーソン癌センターの婦人科腫瘍学および癌生物学の研究者らと協力して、卵巣癌腫瘍、血管、血小板の間の相互作用について研究を行っている。この研究者らは、腫瘍が血管の障壁を破り、これが血小板を含む血液細胞とのコミュニケーションを可能にすることを発見した。 これらの腫瘍が血小板と接触すると、転移する可能性がある。 この共同研究の成果は、2020年7月27日にBlood Advancesのオンラインに掲載された。 この論文は「OvCa-Chip Microsystemが卵巣癌の血管内皮介在性血小板溢出を再現する(OvCa-Chip Microsystem Recreates Vascular Endothelium–Mediated Platelet Extravasation in Ovarian Cancer.)」と題されている。
以前、研究者らは血小板が卵巣癌転移の開始因子の1つであることを理解していたが、何が血小板を腫瘍細胞に導入することにつながったのか分からなかった。動物モデルでこの関係を観察するので苦労する代わりに、Jain博士のチームは新しい解決策を創り出した。それは、USBドライブサイズのマイクロ流体医療デバイス「organ-on-a-chip」だ。このチームはOvCa-Chip(ovarian cancer chip)を設計して、腫瘍と血小板の間の生物学的プロセスを研究者がより簡単に確認できるようにした。血栓症と止血に関する国際学会へのインタビューで、Jain博士は次のように説明した。 「血管と共培養でき、血液細胞と相互作用できる。これらの相互作用について学習したら、次に、薬物がこれらの種類の相互作用にどのように影響するかを調査するために進むことがで
家畜および野生生物の炭疽症に対する経口ワクチン開発に進展
 テキサスA&M大学獣医学部(CVMBS)での画期的な研究により、野生生物における何世紀にも渡る炭疽菌との戦いにおいて、新しい武器が間もなく登場するかもしれない。炭疽症は炭疽菌と呼ばれる細菌によって表面の土壌や草が汚染され、家畜や放牧野生生物が摂取または吸入することで引き起こされる病気である。 これは、テキサス州西部で特に一般的で、毎年この病気によって家畜と野生生物が死んでいる。 普段は注意を引く問題ではないが、2019年の急増により州全体に注目が集まった。
CVMBS獣医病理学部(VTPB)のWalt Cook 博士率いるクックワイルドライフラボのポスドク研究員であるJamie Benn Felix 博士によると、2019年に10,000頭以上の動物の死亡の原因となった可能性があるという。「各動物の経済的価値が1,000ドルであると仮定しても、わずか数か月で1,000万ドルの経済的損失が見られた」と彼女は語った。「そして、この事件のレポートよりもかなり高くなる可能性がある」良いニュースは、炭疽菌に対するワクチンがすでにあり、多くの家畜所有者が毎年管理していることだ。 残念ながら、それは家畜にとって時間のかかる注射でのみ投与でき、野生生物にとっては実行不可能だ。 そのことを念頭に置いて、Benn Felix 博士とクックワイルドライフラボチームは、VTPBの研究者であるAllison Rice-Ficht 博士とThomas Ficht 博士と協力して、野生生物への潜在的な投与を可能にする経口ワクチン投与するための製剤の開発に取り組んだ。Benn Felix 博士と同僚は最近、Natureでパイロット研究の結果を発表し、現在、次のテストに移っている。 このオープンアクセスのNatureの論文は2020年7月10日にオンラインで公開され、「マイクロカプセル化された炭疽菌菌株3
テキサスA&M大学獣医学部(CVMBS)での画期的な研究により、野生生物における何世紀にも渡る炭疽菌との戦いにおいて、新しい武器が間もなく登場するかもしれない。炭疽症は炭疽菌と呼ばれる細菌によって表面の土壌や草が汚染され、家畜や放牧野生生物が摂取または吸入することで引き起こされる病気である。 これは、テキサス州西部で特に一般的で、毎年この病気によって家畜と野生生物が死んでいる。 普段は注意を引く問題ではないが、2019年の急増により州全体に注目が集まった。
CVMBS獣医病理学部(VTPB)のWalt Cook 博士率いるクックワイルドライフラボのポスドク研究員であるJamie Benn Felix 博士によると、2019年に10,000頭以上の動物の死亡の原因となった可能性があるという。「各動物の経済的価値が1,000ドルであると仮定しても、わずか数か月で1,000万ドルの経済的損失が見られた」と彼女は語った。「そして、この事件のレポートよりもかなり高くなる可能性がある」良いニュースは、炭疽菌に対するワクチンがすでにあり、多くの家畜所有者が毎年管理していることだ。 残念ながら、それは家畜にとって時間のかかる注射でのみ投与でき、野生生物にとっては実行不可能だ。 そのことを念頭に置いて、Benn Felix 博士とクックワイルドライフラボチームは、VTPBの研究者であるAllison Rice-Ficht 博士とThomas Ficht 博士と協力して、野生生物への潜在的な投与を可能にする経口ワクチン投与するための製剤の開発に取り組んだ。Benn Felix 博士と同僚は最近、Natureでパイロット研究の結果を発表し、現在、次のテストに移っている。 このオープンアクセスのNatureの論文は2020年7月10日にオンラインで公開され、「マイクロカプセル化された炭疽菌菌株3
ヒトの読書能力は下側頭葉皮質のリサイクルがもたらしたとの仮説をMITの神経科学者が提唱
 ヒトが読み書きのシステムを開発し始めたのは過去数千年以内のことだ。 我々の読書能力は他の動物種と一線を画すものだが、数千年はヒトの脳が特に読書に専念する新しい領域を進化させるにはあまりにも短い時間枠だ。 このスキルの発達を説明するために、一部の科学者は、元々他の目的のために進化した脳の部分が読書のために「リサイクル」されたと仮定した。2020年8月4日にNature Communicationsのオンラインで掲載されたMITの神経科学者らによるこの論文は、「下側頭皮質は未訓練のサルの正射図処理の皮質前駆体である可能性」と題されている。
ヒトが読み書きのシステムを開発し始めたのは過去数千年以内のことだ。 我々の読書能力は他の動物種と一線を画すものだが、数千年はヒトの脳が特に読書に専念する新しい領域を進化させるにはあまりにも短い時間枠だ。 このスキルの発達を説明するために、一部の科学者は、元々他の目的のために進化した脳の部分が読書のために「リサイクル」されたと仮定した。一例として、彼らは、オブジェクト認識の実行に特化した視覚システムの一部が、正字法と呼ばれる読書の主要なコンポーネント、つまり書かれた文字や単語を認識する機能に転用されたことを示唆している。 MITの神経科学者らによる新研究は、この仮説の証拠を提供している。この研究成果は、読む方法を知らない非ヒト霊長類であっても、下側頭葉皮質( inferotemporal cortex)と呼ばれる脳の一部が、意味のない単語と単語を区別したり、単語から特定の文字を取り出すなどのタスクを実行できることを示唆している 。「この研究は、視覚処理の神経メカニズムの急速な発達への理解と霊長類の重要な行動(ヒトの読書)との間の潜在的なつながりを紐解いた」と Rishi Rajalingham博士(MIT 脳・認知科学部門の責任者、マクガバン
ヒトが読み書きのシステムを開発し始めたのは過去数千年以内のことだ。 我々の読書能力は他の動物種と一線を画すものだが、数千年はヒトの脳が特に読書に専念する新しい領域を進化させるにはあまりにも短い時間枠だ。 このスキルの発達を説明するために、一部の科学者は、元々他の目的のために進化した脳の部分が読書のために「リサイクル」されたと仮定した。2020年8月4日にNature Communicationsのオンラインで掲載されたMITの神経科学者らによるこの論文は、「下側頭皮質は未訓練のサルの正射図処理の皮質前駆体である可能性」と題されている。
ヒトが読み書きのシステムを開発し始めたのは過去数千年以内のことだ。 我々の読書能力は他の動物種と一線を画すものだが、数千年はヒトの脳が特に読書に専念する新しい領域を進化させるにはあまりにも短い時間枠だ。 このスキルの発達を説明するために、一部の科学者は、元々他の目的のために進化した脳の部分が読書のために「リサイクル」されたと仮定した。一例として、彼らは、オブジェクト認識の実行に特化した視覚システムの一部が、正字法と呼ばれる読書の主要なコンポーネント、つまり書かれた文字や単語を認識する機能に転用されたことを示唆している。 MITの神経科学者らによる新研究は、この仮説の証拠を提供している。この研究成果は、読む方法を知らない非ヒト霊長類であっても、下側頭葉皮質( inferotemporal cortex)と呼ばれる脳の一部が、意味のない単語と単語を区別したり、単語から特定の文字を取り出すなどのタスクを実行できることを示唆している 。「この研究は、視覚処理の神経メカニズムの急速な発達への理解と霊長類の重要な行動(ヒトの読書)との間の潜在的なつながりを紐解いた」と Rishi Rajalingham博士(MIT 脳・認知科学部門の責任者、マクガバン
致命的なプリオン病のアンチセンスオリゴヌクレオチド療法に関する画期的な論文が発表された
 ハーバード大学医学部とブロードインスティチュートのSonia Vallabh博士(写真)とEric Minikel 博士、イオニスファーマシューティカルズ のHoni Kordasiewicz博士、そしてマクラフリン研究所のDeborah Cabin 博士が率いる研究チームは、2020年8月10日に Nucleic Acids Research のオンラインで発表された「プリオンタンパク質の低下は疾患修飾因子である(Prion Protein Lowering is a Disease-modifying Therapy Across Prion Strains, Stages, and Endpoints.)」と題された論文で、メカニズムの実験と動物モデルシステムでの検証を含む、プリオン障害のさまざまな プリオン株 、病期、およびエンドポイントに対するアンチセンス療法の前臨床研究の結果を報告している。
この論文は、NARによって「画期的な論文」、つまり「新しい研究の機会と方向性を明確に動機づけ、導く研究分野について、卓越した新しい洞察と理解を提供する研究を説明する論文」として指定された。 「画期的な論文」は、NARが出版のためにアクセプトする上位の論文を表しており、編集者は、レビュアーと編集委員による推薦とその後の推奨に基づいて選択する。プリオン病は火急に致命的であり、現在治療不可能な神経変性疾患だ。 これらには、クロイツフェルトヤコブ病、致命的な家族性不眠症、クールー病、牛の牛海綿状脳炎(BSE)(狂牛病)、羊のスクレイピーが含まれる。 これらの疾患は、正常なプリオンタンパク質(PrP)の構造の破壊によって引き起こされる。 破壊されたプリオンタンパク質は、通常のプリオンタンパク質を特徴付けるアルファヘリックス構造ではなく、ベータシート構造を特徴としている。 破壊
ハーバード大学医学部とブロードインスティチュートのSonia Vallabh博士(写真)とEric Minikel 博士、イオニスファーマシューティカルズ のHoni Kordasiewicz博士、そしてマクラフリン研究所のDeborah Cabin 博士が率いる研究チームは、2020年8月10日に Nucleic Acids Research のオンラインで発表された「プリオンタンパク質の低下は疾患修飾因子である(Prion Protein Lowering is a Disease-modifying Therapy Across Prion Strains, Stages, and Endpoints.)」と題された論文で、メカニズムの実験と動物モデルシステムでの検証を含む、プリオン障害のさまざまな プリオン株 、病期、およびエンドポイントに対するアンチセンス療法の前臨床研究の結果を報告している。
この論文は、NARによって「画期的な論文」、つまり「新しい研究の機会と方向性を明確に動機づけ、導く研究分野について、卓越した新しい洞察と理解を提供する研究を説明する論文」として指定された。 「画期的な論文」は、NARが出版のためにアクセプトする上位の論文を表しており、編集者は、レビュアーと編集委員による推薦とその後の推奨に基づいて選択する。プリオン病は火急に致命的であり、現在治療不可能な神経変性疾患だ。 これらには、クロイツフェルトヤコブ病、致命的な家族性不眠症、クールー病、牛の牛海綿状脳炎(BSE)(狂牛病)、羊のスクレイピーが含まれる。 これらの疾患は、正常なプリオンタンパク質(PrP)の構造の破壊によって引き起こされる。 破壊されたプリオンタンパク質は、通常のプリオンタンパク質を特徴付けるアルファヘリックス構造ではなく、ベータシート構造を特徴としている。 破壊
深海アンコウの驚くべき繁殖戦略/性的寄生について1世紀に渡る難問が解決
 深海アンコウは、驚くべき繁殖戦略を採用している。 小さな子供のオスは、比較的巨大なメスに永久に付着し、組織を融合させ、その後、共通の血液循環を確立する。 このようにして、母親の子宮の発達中の胎児や移植患者のドナー臓器のように、オスは栄養供給に関してメスに完全に依存するようになる。アンコウの、この異常な現象は性的寄生と呼ばれ、雌雄がめったに出会わない深海の広大な空間に住むこれらの動物の繁殖成功に貢献している。 オスのメスへの永久的な愛着は、解剖学的な結合の一種を表しており、遺伝的に同一の双生児でまれにしか発生しないことを除いて、本来は未知だ。 免疫システムはここでは並外れた支障を表す。 病原体に感染した細胞を破壊する様に、外来組織を攻撃する。
臓器移植の長期生存を確実にするために、免疫抑制薬と一緒にドナーとレシピエントの組織特性を注意深くクロスマッチングする必要があるヒトの臓器移植を取り巻く問題がある。 しかし、アンコウの場合、組織拒絶が起きずに、同じ種の個体が互いに簡単に受け入れることができるのはなぜだろうか?性的寄生の現象は、最初のペアが1920年にアイスランドの漁業生物学者によって発見されて以来、100年間謎だった。現在、ドイツと米国の科学者らは、この1世紀に渡る難問を解決し、2020年7月30日にサイエンスで彼らの発見をオンラインで報告している。 この論文は「性的寄生の免疫遺伝学(The Immunogenetics of Sexual Parasitism.)」と題されている。数年前、ドイツのフライブルクにあるマックスプランク研究所(MPI)の免疫生物学およびエピジェネティクス部門で働くThomas Boehm 医学博士(医師であり免疫学者)と、アメリカのシアトルにあるワシントン大学のTheodore W. Pietsch 博士(魚類学者であり国際的に有名な
深海アンコウは、驚くべき繁殖戦略を採用している。 小さな子供のオスは、比較的巨大なメスに永久に付着し、組織を融合させ、その後、共通の血液循環を確立する。 このようにして、母親の子宮の発達中の胎児や移植患者のドナー臓器のように、オスは栄養供給に関してメスに完全に依存するようになる。アンコウの、この異常な現象は性的寄生と呼ばれ、雌雄がめったに出会わない深海の広大な空間に住むこれらの動物の繁殖成功に貢献している。 オスのメスへの永久的な愛着は、解剖学的な結合の一種を表しており、遺伝的に同一の双生児でまれにしか発生しないことを除いて、本来は未知だ。 免疫システムはここでは並外れた支障を表す。 病原体に感染した細胞を破壊する様に、外来組織を攻撃する。
臓器移植の長期生存を確実にするために、免疫抑制薬と一緒にドナーとレシピエントの組織特性を注意深くクロスマッチングする必要があるヒトの臓器移植を取り巻く問題がある。 しかし、アンコウの場合、組織拒絶が起きずに、同じ種の個体が互いに簡単に受け入れることができるのはなぜだろうか?性的寄生の現象は、最初のペアが1920年にアイスランドの漁業生物学者によって発見されて以来、100年間謎だった。現在、ドイツと米国の科学者らは、この1世紀に渡る難問を解決し、2020年7月30日にサイエンスで彼らの発見をオンラインで報告している。 この論文は「性的寄生の免疫遺伝学(The Immunogenetics of Sexual Parasitism.)」と題されている。数年前、ドイツのフライブルクにあるマックスプランク研究所(MPI)の免疫生物学およびエピジェネティクス部門で働くThomas Boehm 医学博士(医師であり免疫学者)と、アメリカのシアトルにあるワシントン大学のTheodore W. Pietsch 博士(魚類学者であり国際的に有名な
BBOX1酵素の阻害は、トリプルネガティブ乳癌の効果的な治療アプローチになる可能性がある。
 UT サウスウェスタン(UTSW)の研究者らによる新たな研究で、酸素感知酵素の1種がトリプルネガティブ乳癌(TNBC)療法の有効なターゲットになる可能性があることが報告された。2020年7月20日にCancer Discoveryのオンラインで発表されたこの研究成果は、有効な治療オプションがほとんどなく、予後不良に直面することが多いこの患者のサブセットに希望をもたらすかもしれない。 この論文は、「トリプルネガティブ乳癌の治療標的としてのBBOX1の特定(Identification of BBOX1 as a Therapeutic Target in Triple-Negative Breast Cancer.)」と題されている。エストロゲン受容体、プロゲステロン受容体、および成長促進タンパク質HER2の過剰発現がないためにトリプルネガティブ乳癌と呼ばれ、これはすべての乳癌の15〜20%にすぎない。
ただし、UTSWの病理学部の准教授およびテキサス州立癌予防研究所(CPRIT)の学者であるQing Zhang博士は、これはすべての乳癌の中で最も致命的であり、5年生存率は 他のタイプの93%と比較して77%。 ホルモン受容体またはHER2陽性である他の癌とは異なり、TNBCは標的治療を行わないため、患者は手術、化学療法、および放射線のみに依存する必要があり、標的治療よりも効果が低く、健康な組織に害を及ぼす可能性があるという。Zhang博士の研究室は、低酸素環境で癌がどのよう拡大するかを研究している。 Zhang博士と彼の同僚は、TNBCの実行可能な薬物ターゲットを探して、細胞内の酸素センサーとして機能する70酵素を含む、2-オキソグルタル酸(2-OG)依存酵素に注目した。 TNBCでの役割を決定するために、この研究者らは特定の遺伝子の発現を遮断できる遺伝物質の断片で
UT サウスウェスタン(UTSW)の研究者らによる新たな研究で、酸素感知酵素の1種がトリプルネガティブ乳癌(TNBC)療法の有効なターゲットになる可能性があることが報告された。2020年7月20日にCancer Discoveryのオンラインで発表されたこの研究成果は、有効な治療オプションがほとんどなく、予後不良に直面することが多いこの患者のサブセットに希望をもたらすかもしれない。 この論文は、「トリプルネガティブ乳癌の治療標的としてのBBOX1の特定(Identification of BBOX1 as a Therapeutic Target in Triple-Negative Breast Cancer.)」と題されている。エストロゲン受容体、プロゲステロン受容体、および成長促進タンパク質HER2の過剰発現がないためにトリプルネガティブ乳癌と呼ばれ、これはすべての乳癌の15〜20%にすぎない。
ただし、UTSWの病理学部の准教授およびテキサス州立癌予防研究所(CPRIT)の学者であるQing Zhang博士は、これはすべての乳癌の中で最も致命的であり、5年生存率は 他のタイプの93%と比較して77%。 ホルモン受容体またはHER2陽性である他の癌とは異なり、TNBCは標的治療を行わないため、患者は手術、化学療法、および放射線のみに依存する必要があり、標的治療よりも効果が低く、健康な組織に害を及ぼす可能性があるという。Zhang博士の研究室は、低酸素環境で癌がどのよう拡大するかを研究している。 Zhang博士と彼の同僚は、TNBCの実行可能な薬物ターゲットを探して、細胞内の酸素センサーとして機能する70酵素を含む、2-オキソグルタル酸(2-OG)依存酵素に注目した。 TNBCでの役割を決定するために、この研究者らは特定の遺伝子の発現を遮断できる遺伝物質の断片で
GTPase Rab11aエクソソームが癌の成長と治療抵抗性を促進すると新研究が示唆
 英国の助成を受けたオックスフォード大学の研究者による共同研究では、癌細胞が成長し治療によるストレスに癌細胞が適応する新しいメカニズムが明らかになった。 このメカニズムには、細胞がエクソソームとして知られている小さな小胞を放出することが含まれる。 これらの エクソソーム は、タンパク質、RNA、および他の分子の複雑な混合物を含み、周囲の細胞を再プログラムすることができる。エクソソームは、体内のすべての細胞によって放出され、免疫や生殖などの健康な個人の多くのプロセスで重要な役割を果たすと考えられている。 しかし、癌では、腫瘍の成長や転移などの病理学的変化を引き起こすことがある。 これまでの研究では、エクソソームは後期エンドソームとして知られている細胞のコンパートメントで作られることが示唆されており、損傷したタンパク質や細胞構造を取り除くことで細胞を健康に保つためにも使用されている。
ショウジョウバエとヒトの癌細胞の補完分析を組み合わせることにより、共同チームは、細胞のリサイクルシステムでもエクソソームが作られ、再利用可能なタンパク質を廃棄物処理システムからそらすことを示した。 それらはRab11a-エクソソームと呼ばれ、癌が成長し、現在の治療から生き延びるのを助けるかもしれない異なるカーゴを運ぶという。
腫瘍が大きくなると、腫瘍内の細胞はアミノ酸などの主要な栄養素が不足し、これらのストレスを受けた細胞は、癌細胞によって作られた分子を搭載したRab11aエクソソームを生成する。研究を率いたDeborah Goberdhan 准教授(写真)によると、「これらの『悪いエクソソーム』は、周囲の他の細胞に成長を促進し、より攻撃的な細胞タイプの選択とより悪い結果につながる可能性がある。 Rab11aエクソソームの産生は、一部の患者が特定の治療に反応しない理由と、他の患者が治療法に
英国の助成を受けたオックスフォード大学の研究者による共同研究では、癌細胞が成長し治療によるストレスに癌細胞が適応する新しいメカニズムが明らかになった。 このメカニズムには、細胞がエクソソームとして知られている小さな小胞を放出することが含まれる。 これらの エクソソーム は、タンパク質、RNA、および他の分子の複雑な混合物を含み、周囲の細胞を再プログラムすることができる。エクソソームは、体内のすべての細胞によって放出され、免疫や生殖などの健康な個人の多くのプロセスで重要な役割を果たすと考えられている。 しかし、癌では、腫瘍の成長や転移などの病理学的変化を引き起こすことがある。 これまでの研究では、エクソソームは後期エンドソームとして知られている細胞のコンパートメントで作られることが示唆されており、損傷したタンパク質や細胞構造を取り除くことで細胞を健康に保つためにも使用されている。
ショウジョウバエとヒトの癌細胞の補完分析を組み合わせることにより、共同チームは、細胞のリサイクルシステムでもエクソソームが作られ、再利用可能なタンパク質を廃棄物処理システムからそらすことを示した。 それらはRab11a-エクソソームと呼ばれ、癌が成長し、現在の治療から生き延びるのを助けるかもしれない異なるカーゴを運ぶという。
腫瘍が大きくなると、腫瘍内の細胞はアミノ酸などの主要な栄養素が不足し、これらのストレスを受けた細胞は、癌細胞によって作られた分子を搭載したRab11aエクソソームを生成する。研究を率いたDeborah Goberdhan 准教授(写真)によると、「これらの『悪いエクソソーム』は、周囲の他の細胞に成長を促進し、より攻撃的な細胞タイプの選択とより悪い結果につながる可能性がある。 Rab11aエクソソームの産生は、一部の患者が特定の治療に反応しない理由と、他の患者が治療法に
MicroRNA-218-5pを含む皮膚エクソソームが毛髪の再生を促進することが判明
 ノースカロライナ州立大学の研究者は、毛髪の再生を促進する可能性のあるマイクロRNA(miRNA)を特定した。 このmiRNA(miR-218-5p)は、毛包の再生に関与するパスウェイの調節に重要な役割を果たしており、将来の薬剤開発の候補となる可能性がある。毛髪の成長は、毛包の成長サイクルを調節する真皮乳頭(dermal papillae)細胞の健康に依存する。 脱毛のための現在の治療は、侵襲的な手術から望ましい結果をもたらさない化学的治療に至るまで、費用がかかり、効果的でない場合がある。 最近の脱毛の研究によると、脱毛が起こっても毛包は消えず、収縮するだけである。 それらのサイトで真皮乳頭細胞を補充できれば、毛包は回復するかもしれない。ノースカロライナ州立大学獣医学部の再生医学で著名な教授でありノースカロライナ州/ UNCの生物医学工学部の教授であるKe Cheng博士が率いる研究チームは、真皮乳頭細胞を二次元培養と三次元細胞培養によるスフェロイドの両方で培養した。
この研究は、2020年7月24日にサイエンスアドバンスでオンライン公開された。このオープンアクセス論文は、「miR-218-5pを含む皮膚エクソソームは、β-カテニンシグナル伝達を調節することにより、毛髪の再生を促進する。(Dermal Exosomes Containing miR-218-5p Promote Hair Regeneration by Regulating β-catenin Signaling.)」と題されている。
スフェロイドは、細胞の自然な微小環境を効果的に再現する三次元の細胞構造だ。 Cheng博士は、毛髪の再生のマウスモデルで、二次元培養真皮乳頭細胞、三次元スフェロイド培養真皮乳頭細胞をケラチン足場に入れ、市販の脱毛治療用ミノキシジルで処理したマウスの毛がどれだけ早く再生
ノースカロライナ州立大学の研究者は、毛髪の再生を促進する可能性のあるマイクロRNA(miRNA)を特定した。 このmiRNA(miR-218-5p)は、毛包の再生に関与するパスウェイの調節に重要な役割を果たしており、将来の薬剤開発の候補となる可能性がある。毛髪の成長は、毛包の成長サイクルを調節する真皮乳頭(dermal papillae)細胞の健康に依存する。 脱毛のための現在の治療は、侵襲的な手術から望ましい結果をもたらさない化学的治療に至るまで、費用がかかり、効果的でない場合がある。 最近の脱毛の研究によると、脱毛が起こっても毛包は消えず、収縮するだけである。 それらのサイトで真皮乳頭細胞を補充できれば、毛包は回復するかもしれない。ノースカロライナ州立大学獣医学部の再生医学で著名な教授でありノースカロライナ州/ UNCの生物医学工学部の教授であるKe Cheng博士が率いる研究チームは、真皮乳頭細胞を二次元培養と三次元細胞培養によるスフェロイドの両方で培養した。
この研究は、2020年7月24日にサイエンスアドバンスでオンライン公開された。このオープンアクセス論文は、「miR-218-5pを含む皮膚エクソソームは、β-カテニンシグナル伝達を調節することにより、毛髪の再生を促進する。(Dermal Exosomes Containing miR-218-5p Promote Hair Regeneration by Regulating β-catenin Signaling.)」と題されている。
スフェロイドは、細胞の自然な微小環境を効果的に再現する三次元の細胞構造だ。 Cheng博士は、毛髪の再生のマウスモデルで、二次元培養真皮乳頭細胞、三次元スフェロイド培養真皮乳頭細胞をケラチン足場に入れ、市販の脱毛治療用ミノキシジルで処理したマウスの毛がどれだけ早く再生
バークホルデリアが10代と成人の嚢胞性線維症患者にのみ感染する理由の手掛かりが得られた
 いくつかの異なる種類の細菌が嚢胞性線維症 (CF: Cystic Fibrosis)の人々に肺感染症を引き起こす可能性がある。 肺炎を引き起こす可能性のある緑膿菌は、通常、乳幼児に感染し、生涯持続するが、バークホルデリアセパシア(Burkholderia cepacia)複合種は10代と成人にのみ感染する。バークホルデリア感染症は希だが、定着した場合には致命的だ。 現在、UNC微生物学および免疫学部の教授であるPeggy Cotter 博士が率いるUNC医学部の科学者らは、この病原体の明らかな年齢差別の理由を発見した。
2020年8月4日にオンラインでCell Host&Microbeに掲載されたこの研究は、シュードモナスとバークホルデリアの両方がタイプVI分泌システム(T6SS)と呼ばれる有毒な兵器を使用して競合し、優位を確立していることを示している。 科学者がこの兵器を標的とする、または模倣して、細菌が患者の肺に回復不能な害を及ぼす前に細菌を倒すことができる可能性がある。 この論文は、「宿主の適応により、緑膿菌がバークホルデリアセパシアコンプレックスによるタイプVI分泌システムを介した捕食にかかりやすくなる(Host Adaptation Predisposes Pseudomonas aeruginosa to Type VI Secretion System-Mediated Predation by the Burkholderia cepacia Complex.)」と題されている。科学者らは、なぜバークホルデリアが乳幼児に感染しないのか長い間疑問に思ってきた。 筆頭著者で元Cotter ラボの大学院生であるAndrew Perault博士は、乳幼児から分離されたシュードモナス菌がモリのようなT6SSを使用して、バークホルデリアなどの競合する細菌に毒素を
いくつかの異なる種類の細菌が嚢胞性線維症 (CF: Cystic Fibrosis)の人々に肺感染症を引き起こす可能性がある。 肺炎を引き起こす可能性のある緑膿菌は、通常、乳幼児に感染し、生涯持続するが、バークホルデリアセパシア(Burkholderia cepacia)複合種は10代と成人にのみ感染する。バークホルデリア感染症は希だが、定着した場合には致命的だ。 現在、UNC微生物学および免疫学部の教授であるPeggy Cotter 博士が率いるUNC医学部の科学者らは、この病原体の明らかな年齢差別の理由を発見した。
2020年8月4日にオンラインでCell Host&Microbeに掲載されたこの研究は、シュードモナスとバークホルデリアの両方がタイプVI分泌システム(T6SS)と呼ばれる有毒な兵器を使用して競合し、優位を確立していることを示している。 科学者がこの兵器を標的とする、または模倣して、細菌が患者の肺に回復不能な害を及ぼす前に細菌を倒すことができる可能性がある。 この論文は、「宿主の適応により、緑膿菌がバークホルデリアセパシアコンプレックスによるタイプVI分泌システムを介した捕食にかかりやすくなる(Host Adaptation Predisposes Pseudomonas aeruginosa to Type VI Secretion System-Mediated Predation by the Burkholderia cepacia Complex.)」と題されている。科学者らは、なぜバークホルデリアが乳幼児に感染しないのか長い間疑問に思ってきた。 筆頭著者で元Cotter ラボの大学院生であるAndrew Perault博士は、乳幼児から分離されたシュードモナス菌がモリのようなT6SSを使用して、バークホルデリアなどの競合する細菌に毒素を
タスマニアデビルの研究からヒトの癌治療の新洞察が得られる可能性
 伝染性のまれな腫瘍によりタスマニアデビルは絶滅の危機に瀕しているが、ワシントン州立大学とシアトルのフレッドハッチンソン癌研究センターの科学者らによる新しい研究は、この動物の生存とヒトの癌の新しい治療への希望を示している。2020年8月1日にGeneticsのオンラインで公開されたこの研究では、野生のタスマニアデビルの伝染性癌の成長を抑制する単一の遺伝子変異(RASL11Aの活性化)が見付かった。 この論文は、「RASL11Aの活性化に関連するタスマニアデビルでの腫瘍の自然退縮(Spontaneous Tumor Regression in Tasmanian Devils Associated with RASL11A Activation.)」と題されている。
「この遺伝子は、ヒトの前立腺癌および結腸癌に関係している」とワシントン州立大学の生物科学教授であるAndrew Storfer博士は述べた。 「この調査結果は、世界の数少ないタスマニアデビルを救うのに役立つが、これらの結果はいつの日かヒトの健康につながる可能性もある。」Storfer博士とMark Margres博士が率いる研究チームは、現在ハーバード大学の博士研究員であり、自然に退行した、つまり、癌が自ら消え始めたdevil facial tumor disease(DFTD)症例のゲノムを調査した。
彼らは、腫瘍の退行に寄与する変異が遺伝子機能を変化させず、代わりに腫瘍の細胞増殖を遅らせる遺伝子をオンにしたことを発見して驚いた。 少なくとも、ラボではそのように動作する。 現在のヒトの癌治療は、多くの場合、毒性または衰弱により腫瘍のすべての痕跡を取り除くことに重点を置いていると、治療を通じて研究に貢献した癌生物学者でありフレッドハッチの教授であるDavid Hockenbery医師は述べている。「細胞毒性薬を
伝染性のまれな腫瘍によりタスマニアデビルは絶滅の危機に瀕しているが、ワシントン州立大学とシアトルのフレッドハッチンソン癌研究センターの科学者らによる新しい研究は、この動物の生存とヒトの癌の新しい治療への希望を示している。2020年8月1日にGeneticsのオンラインで公開されたこの研究では、野生のタスマニアデビルの伝染性癌の成長を抑制する単一の遺伝子変異(RASL11Aの活性化)が見付かった。 この論文は、「RASL11Aの活性化に関連するタスマニアデビルでの腫瘍の自然退縮(Spontaneous Tumor Regression in Tasmanian Devils Associated with RASL11A Activation.)」と題されている。
「この遺伝子は、ヒトの前立腺癌および結腸癌に関係している」とワシントン州立大学の生物科学教授であるAndrew Storfer博士は述べた。 「この調査結果は、世界の数少ないタスマニアデビルを救うのに役立つが、これらの結果はいつの日かヒトの健康につながる可能性もある。」Storfer博士とMark Margres博士が率いる研究チームは、現在ハーバード大学の博士研究員であり、自然に退行した、つまり、癌が自ら消え始めたdevil facial tumor disease(DFTD)症例のゲノムを調査した。
彼らは、腫瘍の退行に寄与する変異が遺伝子機能を変化させず、代わりに腫瘍の細胞増殖を遅らせる遺伝子をオンにしたことを発見して驚いた。 少なくとも、ラボではそのように動作する。 現在のヒトの癌治療は、多くの場合、毒性または衰弱により腫瘍のすべての痕跡を取り除くことに重点を置いていると、治療を通じて研究に貢献した癌生物学者でありフレッドハッチの教授であるDavid Hockenbery医師は述べている。「細胞毒性薬を
100年以上生きるムカシトカゲの遺伝子研究で国際研究チームとマオリ族が連携
 ニュージーランド固有の爬虫類であるムカシトカゲのゲノムを配列決定するために、国際研究チームがマオリ族と連携した。2020年8月5日にNatureでオンラインで公開された研究は、この古代種の進化を理解するための基礎を築き、それを保護するための保全活動に情報を与えることができる。 このオープンアクセスの論文は「ムカシトカゲのゲノムが羊膜類進化の古代の特徴を明らかにする(The Tuatara Genome Reveals Ancient Features of Amniote Evolution.)」と題されている。この研究には、オタゴ大学(ニュージーランド)とヨーロッパ分子生物学研究所のヨーロッパバイオインフォマティクス研究所(EMBL-EBI)の共同研究者が参加した。
その小さな鱗状の体、先のとがった尾、そして爪のある足で、ムカシトカゲはすべてのトカゲのように時を刻んできたように見えるが、しかしそうではない。 この古代の爬虫類は、生命の樹で独自の進化を遂げた枝の唯一の生存者、ムカシトカゲ目(Sphenodontia)だ。これまで生物学者は、鳥、ワニ、カメとより密接に関連しているか、トカゲやヘビと共通の祖先に由来しているかなど、ムカシトカゲの進化の歴史についてはコンセンサスに達していなかった。
EMBL-EBIのEnsembl Compare Genomicsの分析リーダーであるMatthieu Muffato博士は、「我々の調査では、ムカシトカゲが約2億5000万年前にトカゲやヘビの祖先から分岐していることが確認されている」と述べている。 「この独立した進化の長い期間が、ムカシトカゲのゲノムが他の脊椎動物のゲノムと非常に異なっている理由を説明している。」「ムカシトカゲのゲノムは、ヒトゲノムよりもかなり大きく、独自の構成を持っている。これは、種に固有で既知の機能を持
ニュージーランド固有の爬虫類であるムカシトカゲのゲノムを配列決定するために、国際研究チームがマオリ族と連携した。2020年8月5日にNatureでオンラインで公開された研究は、この古代種の進化を理解するための基礎を築き、それを保護するための保全活動に情報を与えることができる。 このオープンアクセスの論文は「ムカシトカゲのゲノムが羊膜類進化の古代の特徴を明らかにする(The Tuatara Genome Reveals Ancient Features of Amniote Evolution.)」と題されている。この研究には、オタゴ大学(ニュージーランド)とヨーロッパ分子生物学研究所のヨーロッパバイオインフォマティクス研究所(EMBL-EBI)の共同研究者が参加した。
その小さな鱗状の体、先のとがった尾、そして爪のある足で、ムカシトカゲはすべてのトカゲのように時を刻んできたように見えるが、しかしそうではない。 この古代の爬虫類は、生命の樹で独自の進化を遂げた枝の唯一の生存者、ムカシトカゲ目(Sphenodontia)だ。これまで生物学者は、鳥、ワニ、カメとより密接に関連しているか、トカゲやヘビと共通の祖先に由来しているかなど、ムカシトカゲの進化の歴史についてはコンセンサスに達していなかった。
EMBL-EBIのEnsembl Compare Genomicsの分析リーダーであるMatthieu Muffato博士は、「我々の調査では、ムカシトカゲが約2億5000万年前にトカゲやヘビの祖先から分岐していることが確認されている」と述べている。 「この独立した進化の長い期間が、ムカシトカゲのゲノムが他の脊椎動物のゲノムと非常に異なっている理由を説明している。」「ムカシトカゲのゲノムは、ヒトゲノムよりもかなり大きく、独自の構成を持っている。これは、種に固有で既知の機能を持
ISEV2020バーチャル年次総会の最後の特集アブストラクトに、細胞外小胞のカーゴリリースに焦点を当てた発表が選ばれた。
 ISEV 2020仮想年次総会(7月20〜22日)中に報告された特集アブストラクトでは、オランダのフローニンゲン大学生物医学工学部のBhagyashree Joshi氏(写真)が、「遺伝的にコード化されたプローブが細胞内の細胞外小胞カーゴの放出に関する洞察を提供する(Genetically Encoded Probes Provide Insight into Extracellular Vesicle Cargo Release in Cells.)」と題されたアブストラクト(FA03)を発表した。Joshi氏は、フローニンゲン大学生物医学工学部の准教授であり、フローニンゲン大学医療センターフローニンゲン大学医療センターのInge Zuhorn 博士の研究室で博士号を取得した。Joshi氏は、細胞外小胞(extracellular vesicles)が細胞間のタンパク質、核酸、脂質の移動を通じて組織の発達、再生、および疾患を調節することが知られていることを指摘した。 しかし現在、細胞外小胞カーゴの細胞質ゾル送達のメカニズムはほとんどわかっていない、と彼女は語った。 細胞外小胞は、機能的なカーゴ放出のために、レシピエント細胞の多小胞体(MVB:multi-vesicular bodies)で逆融合を受けると推測されている。
しかし、これについて証拠が欠けているとJoshi氏は述べた。 彼女は、細胞外小胞の細胞への取り込みを高解像度で追跡すること、および細胞外小胞カーゴの放出の直接的な証拠を取得することは、主に技術的な制限のために困難であると述べた。この問題に対処するために、Joshi氏らは、最新の分子ツールと相関光電子顕微鏡(CLEM)を組み合わせて細胞外小胞カーゴリリースの細胞内部位を特定する分析手法を開発した。
緑色蛍光タンパク質(GFP)は、細胞外小胞
ISEV 2020仮想年次総会(7月20〜22日)中に報告された特集アブストラクトでは、オランダのフローニンゲン大学生物医学工学部のBhagyashree Joshi氏(写真)が、「遺伝的にコード化されたプローブが細胞内の細胞外小胞カーゴの放出に関する洞察を提供する(Genetically Encoded Probes Provide Insight into Extracellular Vesicle Cargo Release in Cells.)」と題されたアブストラクト(FA03)を発表した。Joshi氏は、フローニンゲン大学生物医学工学部の准教授であり、フローニンゲン大学医療センターフローニンゲン大学医療センターのInge Zuhorn 博士の研究室で博士号を取得した。Joshi氏は、細胞外小胞(extracellular vesicles)が細胞間のタンパク質、核酸、脂質の移動を通じて組織の発達、再生、および疾患を調節することが知られていることを指摘した。 しかし現在、細胞外小胞カーゴの細胞質ゾル送達のメカニズムはほとんどわかっていない、と彼女は語った。 細胞外小胞は、機能的なカーゴ放出のために、レシピエント細胞の多小胞体(MVB:multi-vesicular bodies)で逆融合を受けると推測されている。
しかし、これについて証拠が欠けているとJoshi氏は述べた。 彼女は、細胞外小胞の細胞への取り込みを高解像度で追跡すること、および細胞外小胞カーゴの放出の直接的な証拠を取得することは、主に技術的な制限のために困難であると述べた。この問題に対処するために、Joshi氏らは、最新の分子ツールと相関光電子顕微鏡(CLEM)を組み合わせて細胞外小胞カーゴリリースの細胞内部位を特定する分析手法を開発した。
緑色蛍光タンパク質(GFP)は、細胞外小胞
ISEV2020バーチャル年次総会の注目の要旨に、Ral-GTPaseがどのようにエクソソームの生合成と臓器向性を制御し転移を促進するかに焦点を当てた発表が選ばれた。
 7月20〜22日に開催されたISEV2020仮想年次総会(International Society for Extracellular Vesicles)で、フランス・ストラスブール大学のJacky Goetz博士の腫瘍メカニクスラボに所属するShima Ghoroghi氏(写真)は、「Ral-GTPaseは、 エクソソーム の生合成と臓器向性を制御することにより転移を促進する(Ral-GTPases Promote Metastasis by Controlling Biogenesis and Organotropism of Exosomes.)」と題された要旨FA01を発表した。Ghoroghi氏は、2016年にGoetz博士のグループに博士課程の学生として加わり、エクソソームのスペシャリストであるVincent Hyenne博士の指導下で、転移中の腫瘍細胞によるエクソソームの分泌におけるRal-GTPaseの役割を研究した。 彼女の紹介の中で、エクソソームはエンドソーム起源の小さな小胞であり、RNA、脂質、タンパク質を含むさまざまな生体分子で構成されており、これらは遠くの細胞に取り込まれて機能的なメッセージを届けることができると述べた。
多くの研究は、エクソソームが腫瘍細胞とその微小環境との間のコミュニケーションを媒介することにより、腫瘍の進行において主要な役割を果たすことを示している。 Ghoroghi氏のプロジェクトの主な目標は、Ral-GTPaseによって影響を受けるエクソソーム分泌のメカニズムを分析し、転移におけるこれらのエクソソームの重要性を理解することだ。
彼女の博士課程の研究中に、Ral-GTPaseが、エクソソーム分泌のメカニズムを、転移前のニッチを広め、誘導する能力に結びつける中心的な分子であることを発見した。彼女は、エクソソーム分泌
7月20〜22日に開催されたISEV2020仮想年次総会(International Society for Extracellular Vesicles)で、フランス・ストラスブール大学のJacky Goetz博士の腫瘍メカニクスラボに所属するShima Ghoroghi氏(写真)は、「Ral-GTPaseは、 エクソソーム の生合成と臓器向性を制御することにより転移を促進する(Ral-GTPases Promote Metastasis by Controlling Biogenesis and Organotropism of Exosomes.)」と題された要旨FA01を発表した。Ghoroghi氏は、2016年にGoetz博士のグループに博士課程の学生として加わり、エクソソームのスペシャリストであるVincent Hyenne博士の指導下で、転移中の腫瘍細胞によるエクソソームの分泌におけるRal-GTPaseの役割を研究した。 彼女の紹介の中で、エクソソームはエンドソーム起源の小さな小胞であり、RNA、脂質、タンパク質を含むさまざまな生体分子で構成されており、これらは遠くの細胞に取り込まれて機能的なメッセージを届けることができると述べた。
多くの研究は、エクソソームが腫瘍細胞とその微小環境との間のコミュニケーションを媒介することにより、腫瘍の進行において主要な役割を果たすことを示している。 Ghoroghi氏のプロジェクトの主な目標は、Ral-GTPaseによって影響を受けるエクソソーム分泌のメカニズムを分析し、転移におけるこれらのエクソソームの重要性を理解することだ。
彼女の博士課程の研究中に、Ral-GTPaseが、エクソソーム分泌のメカニズムを、転移前のニッチを広め、誘導する能力に結びつける中心的な分子であることを発見した。彼女は、エクソソーム分泌
ACE2を提示した細胞外小胞が、侵入するSARS-CoV-2に高効率でデコイとして機能する可能性が報告された
 2020年7月8日にオンラインでプレプリントポータルbioRxivに掲載された査読されていないプレプリント論文で、フランスのパリのキュリー研究所の研究者らは、SARS-CoV-2ウイルスのSスパイクタンパク質が結合する表面受容体ACE2(アンギオテンシン変換酵素2)を持つ細胞外小胞( extracellular vesicles )が、侵入するウイルスにデコイとして機能する可能性があることを報告した。 この細胞外小胞は、in vitroでSARS-Co-V2 Sタンパク質偽型レンチウイルスによるACE2保有細胞の感染を効果的に防止した。
bioRxivポータルのオープンアクセス論文は、「ACE2を含む細胞外小胞がSARS-Cov-2スパイクタンパク質を含むウイルスによる感染を効率的に防ぐ(Extracellular Vesicles Containing ACE2 Efficiently Prevent Infection by SARS-Cov-2 Spike Protein-Containing Virus)」と題されている。
著者は、SARS-CoV-2の細胞への侵入がウイルスSタンパク質のホスト細胞表面受容体ACE2への結合と、それに続く膜融合とウイルス性を可能にするホスト細胞TMPRRS2(膜貫通プロテアーゼ、セリン2)によるプライミングによって COVID-19 で仲介されることに注目した。 彼らは、感染性の低下は細胞外小胞のACE2のレベルと正の相関があると述べている。この感染性の低下は、可溶性ACE2で達成されるよりも500倍から1500倍効率的であり、TMPRRS2を細胞外小胞表面に含めることでさらに強化されるという。彼らは、ACE2-細胞外小胞がSARS-CoV-2感染だけでなく、宿主細胞の侵入にACE2を使用する他のコロナウイルスによる感染もブロッ
2020年7月8日にオンラインでプレプリントポータルbioRxivに掲載された査読されていないプレプリント論文で、フランスのパリのキュリー研究所の研究者らは、SARS-CoV-2ウイルスのSスパイクタンパク質が結合する表面受容体ACE2(アンギオテンシン変換酵素2)を持つ細胞外小胞( extracellular vesicles )が、侵入するウイルスにデコイとして機能する可能性があることを報告した。 この細胞外小胞は、in vitroでSARS-Co-V2 Sタンパク質偽型レンチウイルスによるACE2保有細胞の感染を効果的に防止した。
bioRxivポータルのオープンアクセス論文は、「ACE2を含む細胞外小胞がSARS-Cov-2スパイクタンパク質を含むウイルスによる感染を効率的に防ぐ(Extracellular Vesicles Containing ACE2 Efficiently Prevent Infection by SARS-Cov-2 Spike Protein-Containing Virus)」と題されている。
著者は、SARS-CoV-2の細胞への侵入がウイルスSタンパク質のホスト細胞表面受容体ACE2への結合と、それに続く膜融合とウイルス性を可能にするホスト細胞TMPRRS2(膜貫通プロテアーゼ、セリン2)によるプライミングによって COVID-19 で仲介されることに注目した。 彼らは、感染性の低下は細胞外小胞のACE2のレベルと正の相関があると述べている。この感染性の低下は、可溶性ACE2で達成されるよりも500倍から1500倍効率的であり、TMPRRS2を細胞外小胞表面に含めることでさらに強化されるという。彼らは、ACE2-細胞外小胞がSARS-CoV-2感染だけでなく、宿主細胞の侵入にACE2を使用する他のコロナウイルスによる感染もブロッ
免疫と長寿のバランスにスプライシング因子が関与している可能性が報告された
 人は年をとるにつれて、免疫系は徐々に損なわれる。 この1つの側面:免疫と長寿のバランス法; スプライシング因子RNP-6の変異は線虫の免疫応答を阻害するが、感染を除けば寿命を延ばしている。 RNP-6ヒトオーソログスプライシング因子PUF60は、高齢者の慢性炎症である免疫と寿命の障害にも関与している可能性がある。慢性炎症は、関節炎およびアルツハイマー病を含む複数の加齢性疾患、および感染に対する免疫応答の障害に関連している。 老化研究における問題の1つは、慢性炎症が老化の原因なのか、それとも老化プロセス自体の結果なのかということだ。
ドイツのケルンにあるマックスプランク老化生物学研究所の責任者であるAdam Antebi 博士の研究室は、炎症の増加が老化プロセスを加速させ、免疫の維持には微妙なバランスがあることを示唆する証拠を発見した。 小さな回虫であるCaenorhabditis elegansでの研究から、進化的に保存された遺伝子[C. elegansのRNP-6(リボ核タンパク質6)遺伝子。ヒトオーソロガス遺伝子はPUF60(poly U binding splicing factor 60)と呼ばれている">は線虫を長命にしたが、同時に、免疫応答を弱めた。この新しい研究は2020年6月15日にeLifeで発表され、「スプライシング因子RNP-6 / PUF60による免疫の進化的に保存された制御(Evolutionarily Conserved Regulation of Immunity by the Splicing Factor RNP-6/PUF60.)」と題されている。
この変異を持つ線虫は、通常の線虫よりも約20%長く生存したが、特定の細菌に感染した場合、より早く感染に屈した。 これは、過剰な免疫システムにも代償があることを示唆しており、それは寿命
人は年をとるにつれて、免疫系は徐々に損なわれる。 この1つの側面:免疫と長寿のバランス法; スプライシング因子RNP-6の変異は線虫の免疫応答を阻害するが、感染を除けば寿命を延ばしている。 RNP-6ヒトオーソログスプライシング因子PUF60は、高齢者の慢性炎症である免疫と寿命の障害にも関与している可能性がある。慢性炎症は、関節炎およびアルツハイマー病を含む複数の加齢性疾患、および感染に対する免疫応答の障害に関連している。 老化研究における問題の1つは、慢性炎症が老化の原因なのか、それとも老化プロセス自体の結果なのかということだ。
ドイツのケルンにあるマックスプランク老化生物学研究所の責任者であるAdam Antebi 博士の研究室は、炎症の増加が老化プロセスを加速させ、免疫の維持には微妙なバランスがあることを示唆する証拠を発見した。 小さな回虫であるCaenorhabditis elegansでの研究から、進化的に保存された遺伝子[C. elegansのRNP-6(リボ核タンパク質6)遺伝子。ヒトオーソロガス遺伝子はPUF60(poly U binding splicing factor 60)と呼ばれている">は線虫を長命にしたが、同時に、免疫応答を弱めた。この新しい研究は2020年6月15日にeLifeで発表され、「スプライシング因子RNP-6 / PUF60による免疫の進化的に保存された制御(Evolutionarily Conserved Regulation of Immunity by the Splicing Factor RNP-6/PUF60.)」と題されている。
この変異を持つ線虫は、通常の線虫よりも約20%長く生存したが、特定の細菌に感染した場合、より早く感染に屈した。 これは、過剰な免疫システムにも代償があることを示唆しており、それは寿命
概日時計は遺伝性と非遺伝性の両方のコンポーネントで調節されている
 テキサス大学サウスウェスタン(UTSW)の研究者らによる2つの新研究では、概日時計の維持が個々の細胞の遺伝的およびランダムな手段の両方で行われていることについて説明している。これらの研究成果は、2020年5月1日にPNAS、2020年5月27日にeLifeでオンライン公開された。これは生物の概日時計がどのように柔軟性を維持し、老化と癌への洞察を提供するものだ。このオープンアクセスのPNASの論文は「概日周期におけるノイズ駆動型セルラー異質性( Noise-Driven Cellular Heterogeneity in Circadian Periodicity )」、オープンアクセスのeLifeの論文は「クローン細胞における概日周期のエピジェネティックな継承(Epigenetic Inheritance of Circadian Period in Clonal Cells.)」と題されている。
科学者は、生命スペクトル全体の生物が、睡眠、食事、免疫反応などの行動を支配する体内時計(1日ほどの周期を持つ)を持っていることを長い間知っていた。 ただし、個々の細胞はまた、生物から取り除かれたときに独自の時計を持ち、期間は大幅に変動する可能性があり、最大で数時間長くまたは短くなる。これらの細胞が遺伝的レベルで同じでなければならないことを考えると、細胞がこれらの異なる内部リズムの長さをどのように維持するかは不明だったとUTサウスウェスタンメディカルセンターの神経科学部門の教授であるJoseph Takahashi博士(写真)は説明した。
この問題を調査するために、Takahashi博士らは、Per2と呼ばれる有名な概日時計遺伝子がオンになるたびに光るよう遺伝子改変されたマウス細胞を操作した。 このツールを使用すると、研究者は、細胞の自然振動が、21.5時間という短い期間
テキサス大学サウスウェスタン(UTSW)の研究者らによる2つの新研究では、概日時計の維持が個々の細胞の遺伝的およびランダムな手段の両方で行われていることについて説明している。これらの研究成果は、2020年5月1日にPNAS、2020年5月27日にeLifeでオンライン公開された。これは生物の概日時計がどのように柔軟性を維持し、老化と癌への洞察を提供するものだ。このオープンアクセスのPNASの論文は「概日周期におけるノイズ駆動型セルラー異質性( Noise-Driven Cellular Heterogeneity in Circadian Periodicity )」、オープンアクセスのeLifeの論文は「クローン細胞における概日周期のエピジェネティックな継承(Epigenetic Inheritance of Circadian Period in Clonal Cells.)」と題されている。
科学者は、生命スペクトル全体の生物が、睡眠、食事、免疫反応などの行動を支配する体内時計(1日ほどの周期を持つ)を持っていることを長い間知っていた。 ただし、個々の細胞はまた、生物から取り除かれたときに独自の時計を持ち、期間は大幅に変動する可能性があり、最大で数時間長くまたは短くなる。これらの細胞が遺伝的レベルで同じでなければならないことを考えると、細胞がこれらの異なる内部リズムの長さをどのように維持するかは不明だったとUTサウスウェスタンメディカルセンターの神経科学部門の教授であるJoseph Takahashi博士(写真)は説明した。
この問題を調査するために、Takahashi博士らは、Per2と呼ばれる有名な概日時計遺伝子がオンになるたびに光るよう遺伝子改変されたマウス細胞を操作した。 このツールを使用すると、研究者は、細胞の自然振動が、21.5時間という短い期間
ニコチンアミドリボシド・サプリメントの臨床試験で、NAD+の増加と抗老化効果を実証
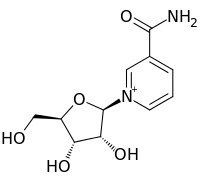 最近発見された新しい形のビタミンB3、ニコチンアミドリボシド (NR) (写真) の初の比較臨床試験で、この化合物が人体に使用しても安全であり、さらに細胞エネルギー産生やストレス、DNA損傷に対する保護作用に重要な細胞代謝物質のレベルを高めることが明らかになった。マウスを使った研究でも、NAD+と呼ばれる細胞代謝物質のレベルを高めることには、体重増加に対する抵抗力をつけ、血糖値やコレステロール値をよくコントロールし、神経損傷を減らし、寿命を延ばすなどいくつも健康に有益な働きがあることが突き止められている。
NAD+のレベルは加齢と共に下がり、この代謝物質の欠失が加齢による健康の衰えに関係しているのではないかと言われている。動物を対象としたこの研究結果から、NAD+強化を目的とする市販のNRサプリメントを服用する人が増えた。しかし、このような市販サプリメントは、人体への効果を調べる臨床試験を受けていない。2016年10月10日付のジャーナル、Nature Communicationsに掲載されたこの新研究は、University of Iowa Carver College of MedicineのProfessorで、Roy J. Carver Chair of Biochemistryを務めるCharles Brenner, Ph.D.が指導し、Queens University Belfast及び、試験に用いられたNRを提供したChromaDex Corp. (NASDAQ: CDXC) との協同作業で行われた。Dr. Brennerは、ChromaDexのコンサルタントを務めている。彼はまたTru NIAGEN(r) の商品名でNRサプリメントを販売するProHealthspanの共同設立者であり、今もChief Scientific Adviserを務めている。N
最近発見された新しい形のビタミンB3、ニコチンアミドリボシド (NR) (写真) の初の比較臨床試験で、この化合物が人体に使用しても安全であり、さらに細胞エネルギー産生やストレス、DNA損傷に対する保護作用に重要な細胞代謝物質のレベルを高めることが明らかになった。マウスを使った研究でも、NAD+と呼ばれる細胞代謝物質のレベルを高めることには、体重増加に対する抵抗力をつけ、血糖値やコレステロール値をよくコントロールし、神経損傷を減らし、寿命を延ばすなどいくつも健康に有益な働きがあることが突き止められている。
NAD+のレベルは加齢と共に下がり、この代謝物質の欠失が加齢による健康の衰えに関係しているのではないかと言われている。動物を対象としたこの研究結果から、NAD+強化を目的とする市販のNRサプリメントを服用する人が増えた。しかし、このような市販サプリメントは、人体への効果を調べる臨床試験を受けていない。2016年10月10日付のジャーナル、Nature Communicationsに掲載されたこの新研究は、University of Iowa Carver College of MedicineのProfessorで、Roy J. Carver Chair of Biochemistryを務めるCharles Brenner, Ph.D.が指導し、Queens University Belfast及び、試験に用いられたNRを提供したChromaDex Corp. (NASDAQ: CDXC) との協同作業で行われた。Dr. Brennerは、ChromaDexのコンサルタントを務めている。彼はまたTru NIAGEN(r) の商品名でNRサプリメントを販売するProHealthspanの共同設立者であり、今もChief Scientific Adviserを務めている。N
コウモリのウイルス耐性と長寿命が、新型コロナウイルスへのヒントを提供するとの展望が発表された
 コウモリは、ヒトに影響を与える多くの致命的なウイルス(エボラ出血熱、狂犬病、そして最近では COVID-19 を引き起こすコロナウイルスのSARS-CoV-2など)に対し、耐性があると考えられている。 ヒトはこれらの病原体で有害な症状を経験するが、コウモリはウイルスに著しく耐えることができ、さらに、同じサイズの陸上哺乳類よりもはるかに長く生きる。コウモリの寿命とウイルス耐性の秘密は何か? ニューヨークのロチェスター大学の研究者によると、コウモリの寿命とウイルスに耐える能力は、病気と老化の特徴である炎症を制御する能力に起因する可能性があるという。Cell Metabolismの2020年7月7日号で発表された論文で、ロチェスター大学の生物学教授であるVera Gorbunova博士とAndrei Seluanov博士を含む研究者らは、コウモリのユニークな能力の根底にあるメカニズムを概説している。これはヒトの病気の新しい治療法を開発する手がかりを握るかもしれない。
このオープンアクセスの論文は、「世界はコウモリになる:長く生き、ウイルスに耐える(The World Goes Bats: Living Longer and Tolerating Viruses.)」と題されている。この論文のアイデアは、COVID-19による旅行禁止が始まる前の2020年3月に、夫婦であるGorbunova博士とSeluanov博士がシンガポールにいたときに思いついた。 ウイルスが広がり始め、シンガポールが封鎖されたとき、彼らは両方とも同僚のBrian Kennedy 博士の自宅で隔離された。博士は、シンガポール国立大学の健康老化センターのディレクターであり、論文の共著者でもある。 哺乳類の寿命に関する専門家である3人の科学者らは、コウモリについて話した。 SARS-CoV-2は、ウイルス
コウモリは、ヒトに影響を与える多くの致命的なウイルス(エボラ出血熱、狂犬病、そして最近では COVID-19 を引き起こすコロナウイルスのSARS-CoV-2など)に対し、耐性があると考えられている。 ヒトはこれらの病原体で有害な症状を経験するが、コウモリはウイルスに著しく耐えることができ、さらに、同じサイズの陸上哺乳類よりもはるかに長く生きる。コウモリの寿命とウイルス耐性の秘密は何か? ニューヨークのロチェスター大学の研究者によると、コウモリの寿命とウイルスに耐える能力は、病気と老化の特徴である炎症を制御する能力に起因する可能性があるという。Cell Metabolismの2020年7月7日号で発表された論文で、ロチェスター大学の生物学教授であるVera Gorbunova博士とAndrei Seluanov博士を含む研究者らは、コウモリのユニークな能力の根底にあるメカニズムを概説している。これはヒトの病気の新しい治療法を開発する手がかりを握るかもしれない。
このオープンアクセスの論文は、「世界はコウモリになる:長く生き、ウイルスに耐える(The World Goes Bats: Living Longer and Tolerating Viruses.)」と題されている。この論文のアイデアは、COVID-19による旅行禁止が始まる前の2020年3月に、夫婦であるGorbunova博士とSeluanov博士がシンガポールにいたときに思いついた。 ウイルスが広がり始め、シンガポールが封鎖されたとき、彼らは両方とも同僚のBrian Kennedy 博士の自宅で隔離された。博士は、シンガポール国立大学の健康老化センターのディレクターであり、論文の共著者でもある。 哺乳類の寿命に関する専門家である3人の科学者らは、コウモリについて話した。 SARS-CoV-2は、ウイルス
癌由来の細胞外小胞のパルミトイル化タンパク質によるリキッドバイオプシーの可能性が示唆された
 腫瘍細胞によって血流に放出され、癌の転移を促進する、細胞外小胞(EV:extracellular vesicles)と呼ばれる粒子内のタンパク質に光を当てた新しい研究が報告された。 この調査結果は、これらの 細胞外小胞を含む血液検査が、将来の癌の診断にどのように使用され、侵襲的な外科的生検の必要性を回避できるかを示唆している。ロサンゼルスのシーダーズ・サイナイ病院で外科と生物医学および病理学と臨床検査医学の教授である Dolores Di Vizio博士(写真)によると、この研究は細胞外小胞内のパルミトイル化タンパク質として知られている物質の大規模分析であるという。Di Vizio博士は、2020年6月10日にJournal of Extracellular Vesiclesのオンラインで発表した共同研究者だ。
このオープンアクセスの論文は、「包括的なパルミトイル-プロテオミクス分析により、癌由来の大小の細胞外小胞の異なるタンパク質シグネチャが特定される。(Comprehensive Palmitoyl-Proteomic Analysis Identifies Distinct Protein Signatures for Large and Small Cancer-Derived Extracellular Vesicles.)」と題されている。細胞外小胞は、タンパク質やその他の生物学的に重要な分子を含む可能性があるため、この10年間で大きな注目を集めている。 細胞外小胞は体内の離れた部位に癌が転移するのを助けることが知られているが、これがどのように起こるかは正確には明らかではない。 このプロセスを詳細に知るために、Di Vizio 博士と研究チームは、酵素が脂質分子をタンパク質に転移させるパルミトイル化と呼ばれるプロセスを調査した。
パルミトイル化は、タン
腫瘍細胞によって血流に放出され、癌の転移を促進する、細胞外小胞(EV:extracellular vesicles)と呼ばれる粒子内のタンパク質に光を当てた新しい研究が報告された。 この調査結果は、これらの 細胞外小胞を含む血液検査が、将来の癌の診断にどのように使用され、侵襲的な外科的生検の必要性を回避できるかを示唆している。ロサンゼルスのシーダーズ・サイナイ病院で外科と生物医学および病理学と臨床検査医学の教授である Dolores Di Vizio博士(写真)によると、この研究は細胞外小胞内のパルミトイル化タンパク質として知られている物質の大規模分析であるという。Di Vizio博士は、2020年6月10日にJournal of Extracellular Vesiclesのオンラインで発表した共同研究者だ。
このオープンアクセスの論文は、「包括的なパルミトイル-プロテオミクス分析により、癌由来の大小の細胞外小胞の異なるタンパク質シグネチャが特定される。(Comprehensive Palmitoyl-Proteomic Analysis Identifies Distinct Protein Signatures for Large and Small Cancer-Derived Extracellular Vesicles.)」と題されている。細胞外小胞は、タンパク質やその他の生物学的に重要な分子を含む可能性があるため、この10年間で大きな注目を集めている。 細胞外小胞は体内の離れた部位に癌が転移するのを助けることが知られているが、これがどのように起こるかは正確には明らかではない。 このプロセスを詳細に知るために、Di Vizio 博士と研究チームは、酵素が脂質分子をタンパク質に転移させるパルミトイル化と呼ばれるプロセスを調査した。
パルミトイル化は、タン
動物のシックスセンスを利用した地震早期警報システムの研究が進展
 いつどこで地震が発生するか、まだ誰も確実に予測することはできない。 しかし、繰り返し、地震の前に動物が異常な行動をとることが目撃されている。国際協力プロジェクトで、ドイツのコンスタンツ/ラドルフツェルのマックスプランク動物行動研究所およびコンスタンツ大学の集団行動の高度な研究のためのクラスターオブエクセレンスセンターの研究者らは、牛、羊、犬が地震の初期兆候を実際に検出できるかどうかを調査した。 彼らはイタリア北部の地震多発地域の動物にセンサーを取り付け、数か月にわたる彼らの動きを記録した。この行動データは、地震の数時間前、動物が異常に落ち着かなかったことを示している。 動物は差し迫った地震の震源地に近づくほど、異常に早く行動し始めた。
つまり、さまざまな地域のさまざまな動物種の行動プロファイルは、差し迫った地震の場所と時間の手掛かりを提供する可能性がある。 コンスタンツ大学のオンラインマガジンcampus.knでは、この研究プロジェクトに関する動画を閲覧できる。この成果は、2020年7月3日にEthology のオンラインで発表された。 このオープンアクセスの論文は「農場-動物モニタリングによる潜在的な短期地震予報(Potential Short-Term Earthquake Forecasting by Farm-Animal Monitoring)」と題されている。地震を正確に予測できるかどうかについて専門家の意見は分かれている。にもかかわらず、動物は差し迫った危険時刻を事前に感じているようだ。 たとえば、野生の動物は強い地震の直前に巣から離れ、ペットは落ち着かなくなるという報告がある。 ただし、これらの事例の説明は、異常な行動の定義が不明確であることが多く、観察期間が短すぎるため、科学的な精査に耐えられないことがよくある。 他の要因でも動物の行動を説明することがで
いつどこで地震が発生するか、まだ誰も確実に予測することはできない。 しかし、繰り返し、地震の前に動物が異常な行動をとることが目撃されている。国際協力プロジェクトで、ドイツのコンスタンツ/ラドルフツェルのマックスプランク動物行動研究所およびコンスタンツ大学の集団行動の高度な研究のためのクラスターオブエクセレンスセンターの研究者らは、牛、羊、犬が地震の初期兆候を実際に検出できるかどうかを調査した。 彼らはイタリア北部の地震多発地域の動物にセンサーを取り付け、数か月にわたる彼らの動きを記録した。この行動データは、地震の数時間前、動物が異常に落ち着かなかったことを示している。 動物は差し迫った地震の震源地に近づくほど、異常に早く行動し始めた。
つまり、さまざまな地域のさまざまな動物種の行動プロファイルは、差し迫った地震の場所と時間の手掛かりを提供する可能性がある。 コンスタンツ大学のオンラインマガジンcampus.knでは、この研究プロジェクトに関する動画を閲覧できる。この成果は、2020年7月3日にEthology のオンラインで発表された。 このオープンアクセスの論文は「農場-動物モニタリングによる潜在的な短期地震予報(Potential Short-Term Earthquake Forecasting by Farm-Animal Monitoring)」と題されている。地震を正確に予測できるかどうかについて専門家の意見は分かれている。にもかかわらず、動物は差し迫った危険時刻を事前に感じているようだ。 たとえば、野生の動物は強い地震の直前に巣から離れ、ペットは落ち着かなくなるという報告がある。 ただし、これらの事例の説明は、異常な行動の定義が不明確であることが多く、観察期間が短すぎるため、科学的な精査に耐えられないことがよくある。 他の要因でも動物の行動を説明することがで
鉛シーケンシングで細菌細胞内の全RNA構造の同時解析を実現
 ドイツのボーフムとミュンスターの研究者らは、細菌細胞内のすべてのRNA分子の構造を一度に決定する新しい方法を開発した。 これまでは、解析を各RNA分子に対して個別に行う必要があった。 正確な組成に加えて、それらの構造はRNAの機能にとって重要だ。チームは、2020年5月28日にNucleic Acids Researchでオンラインで公開された論文で、鉛(Pb)シーケンスのLead-Seqと呼ばれる新しいハイスループット構造マッピング手法について説明している。 この論文は「Lead-Seq:鉛(II)イオンを使用したin vivoでのトランスクリプトーム全体の構造プロービング(Lead-Seq: Transcriptome-Wide Structure Probing in Vivo Using Lead (II) Ions.)」と題されている。
ルール大学ボーフム(RUB)の微生物生物学のChristian Twittenhoff氏、Vivian Brandenburg氏(写真右)、Francesco Righetti博士 およびFranz Narberhaus教授(写真左)は、RUBのAxel Mosig教授が率いるバイオインフォマティクスグループ およびミュンスター大学のPetra Dersch教授が率いるチームと協力した。すべての生きている細胞では、遺伝情報は二本鎖DNAに保存され、一本鎖RNAに転写され、タンパク質の青写真として機能する。 ただし、RNAは遺伝情報の線形コピーであるだけでなく、しばしば複雑な構造に折りたたまれる。 一本鎖領域と部分的に折りたたまれた二本鎖領域の組み合わせは、RNAの機能と安定性にとって非常に重要だ。「RNAについて何かを学びたいのであれば、それらの構造も理解する必要がある」とNarberhaus教授は語った。 Lead-Seqを使
ドイツのボーフムとミュンスターの研究者らは、細菌細胞内のすべてのRNA分子の構造を一度に決定する新しい方法を開発した。 これまでは、解析を各RNA分子に対して個別に行う必要があった。 正確な組成に加えて、それらの構造はRNAの機能にとって重要だ。チームは、2020年5月28日にNucleic Acids Researchでオンラインで公開された論文で、鉛(Pb)シーケンスのLead-Seqと呼ばれる新しいハイスループット構造マッピング手法について説明している。 この論文は「Lead-Seq:鉛(II)イオンを使用したin vivoでのトランスクリプトーム全体の構造プロービング(Lead-Seq: Transcriptome-Wide Structure Probing in Vivo Using Lead (II) Ions.)」と題されている。
ルール大学ボーフム(RUB)の微生物生物学のChristian Twittenhoff氏、Vivian Brandenburg氏(写真右)、Francesco Righetti博士 およびFranz Narberhaus教授(写真左)は、RUBのAxel Mosig教授が率いるバイオインフォマティクスグループ およびミュンスター大学のPetra Dersch教授が率いるチームと協力した。すべての生きている細胞では、遺伝情報は二本鎖DNAに保存され、一本鎖RNAに転写され、タンパク質の青写真として機能する。 ただし、RNAは遺伝情報の線形コピーであるだけでなく、しばしば複雑な構造に折りたたまれる。 一本鎖領域と部分的に折りたたまれた二本鎖領域の組み合わせは、RNAの機能と安定性にとって非常に重要だ。「RNAについて何かを学びたいのであれば、それらの構造も理解する必要がある」とNarberhaus教授は語った。 Lead-Seqを使
体内の正確な場所でガス状メッセンジャー分子を生成する新手法を開発
 一酸化窒素(NO2)は、体内の重要なシグナル伝達分子であり、学習と記憶に寄与する神経系接続の構築に関与している。 また、心血管系や免疫系のメッセンジャーとしても機能する。 しかし、これらの役割とその機能を正確に研究することはこれまで困難だった。 一酸化窒素は気体であるため、その影響を観察するために特定の個々の細胞に向けた実用的な方法はなかった。MITのPolina Anikeeva教授(写真)、Karthish Manthiram博士およびYoel Fink博士、 大学院生のJimin Park氏、ポスドクのKyoungsuk Jin博士らの科学者と、その他10名のエンジニア(MIT、台湾、日本、イスラエル)のチームは、体内の正確に標的化された場所でガスを生成する方法を発見した。この発見により、この必須分子の効果に関する新たな研究の道が開かれる可能性がある。 この調査結果は2020年6月29日にNature Nanotechnologyのオンラインで発表された。
この論文は「ニューロン調節のための一酸化窒素のIn Situ 電気化学生成(In Situ Electrochemical Generation of Nitric Oxide for Neuronal Modulation.)」と題されている。「それは非常に重要な化合物だ」とAnikeeva博士は述べた。 しかし、特定の細胞とシナプスへの一酸化窒素の送達と、その結果としての学習プロセスに対する高レベルの影響との関係を理解することは困難だった。これまでのところ、ほとんどの研究は、メッセンジャーとして必要な一酸化窒素を生成するために体が使用する酵素の生成に関与する遺伝子をノックアウトすることにより、全身効果を調べることに頼っていた。 しかし、そのアプローチは、本質的に生物全体から一酸化窒素をノックアウトし、他
一酸化窒素(NO2)は、体内の重要なシグナル伝達分子であり、学習と記憶に寄与する神経系接続の構築に関与している。 また、心血管系や免疫系のメッセンジャーとしても機能する。 しかし、これらの役割とその機能を正確に研究することはこれまで困難だった。 一酸化窒素は気体であるため、その影響を観察するために特定の個々の細胞に向けた実用的な方法はなかった。MITのPolina Anikeeva教授(写真)、Karthish Manthiram博士およびYoel Fink博士、 大学院生のJimin Park氏、ポスドクのKyoungsuk Jin博士らの科学者と、その他10名のエンジニア(MIT、台湾、日本、イスラエル)のチームは、体内の正確に標的化された場所でガスを生成する方法を発見した。この発見により、この必須分子の効果に関する新たな研究の道が開かれる可能性がある。 この調査結果は2020年6月29日にNature Nanotechnologyのオンラインで発表された。
この論文は「ニューロン調節のための一酸化窒素のIn Situ 電気化学生成(In Situ Electrochemical Generation of Nitric Oxide for Neuronal Modulation.)」と題されている。「それは非常に重要な化合物だ」とAnikeeva博士は述べた。 しかし、特定の細胞とシナプスへの一酸化窒素の送達と、その結果としての学習プロセスに対する高レベルの影響との関係を理解することは困難だった。これまでのところ、ほとんどの研究は、メッセンジャーとして必要な一酸化窒素を生成するために体が使用する酵素の生成に関与する遺伝子をノックアウトすることにより、全身効果を調べることに頼っていた。 しかし、そのアプローチは、本質的に生物全体から一酸化窒素をノックアウトし、他
新型コロナウイルスがin vitroで心臓細胞に感染することが最近の研究で判明
 米国のシーダーズ・サイナイ病院による新しい研究で、 COVID-19 を引き起こすSARS-CoV-2(新型コロナウイルス)が心臓細胞に感染する可能性があり、COVID-19患者の心臓細胞が直接感染する可能性があることが示された。 2020年6月25日にCell Reports Medicineのオンラインで公開されたこの発見は、iPS細胞技術によって生産された心筋細胞を使用して行われた。この論文は、「ヒトiPSC由来の心筋細胞はSARS-CoV-2感染の影響を受けやすい(Human iPSC-Derived Cardiomyocytes, Are Susceptible to SARS-CoV-2 Infection.)」と題されている。
多くのCOVID-19患者は心臓の問題を経験するが、その理由は完全に明らかになっていない。 感染に起因する既存の心臓病または炎症および酸素欠乏はすべて関係している。 しかし、これまで、SARS-CoV-2ウイルスが心臓の個々の筋細胞に直接感染するという証拠は限られていた。「これらの幹細胞由来の心臓細胞が新しいコロナウイルスによる感染に敏感であるだけでなく、ウイルスが心筋細胞内で急速に分裂する可能性があることを明らかにした」と、シーダーズ・サイナイ病院 再生医学研究所でこの研究の筆頭共同著者であるArun Sharma博士は述べた。 「さらに重要なのは、感染した心臓細胞は、72時間の感染後に拍動する能力の変化を示したことだ。」この研究では、SARS-CoV-2に感染したヒト幹細胞由来の心臓細胞が遺伝子発現プロファイルを変更し、ウイルスを一掃するのを助けるために、生来の細胞防御メカニズムを活性化することを実証した。
共同の著者であるシーダーズ・サイナイ病院 のClive Svendsen博士によると、これらの発見は人体で起こってい
米国のシーダーズ・サイナイ病院による新しい研究で、 COVID-19 を引き起こすSARS-CoV-2(新型コロナウイルス)が心臓細胞に感染する可能性があり、COVID-19患者の心臓細胞が直接感染する可能性があることが示された。 2020年6月25日にCell Reports Medicineのオンラインで公開されたこの発見は、iPS細胞技術によって生産された心筋細胞を使用して行われた。この論文は、「ヒトiPSC由来の心筋細胞はSARS-CoV-2感染の影響を受けやすい(Human iPSC-Derived Cardiomyocytes, Are Susceptible to SARS-CoV-2 Infection.)」と題されている。
多くのCOVID-19患者は心臓の問題を経験するが、その理由は完全に明らかになっていない。 感染に起因する既存の心臓病または炎症および酸素欠乏はすべて関係している。 しかし、これまで、SARS-CoV-2ウイルスが心臓の個々の筋細胞に直接感染するという証拠は限られていた。「これらの幹細胞由来の心臓細胞が新しいコロナウイルスによる感染に敏感であるだけでなく、ウイルスが心筋細胞内で急速に分裂する可能性があることを明らかにした」と、シーダーズ・サイナイ病院 再生医学研究所でこの研究の筆頭共同著者であるArun Sharma博士は述べた。 「さらに重要なのは、感染した心臓細胞は、72時間の感染後に拍動する能力の変化を示したことだ。」この研究では、SARS-CoV-2に感染したヒト幹細胞由来の心臓細胞が遺伝子発現プロファイルを変更し、ウイルスを一掃するのを助けるために、生来の細胞防御メカニズムを活性化することを実証した。
共同の著者であるシーダーズ・サイナイ病院 のClive Svendsen博士によると、これらの発見は人体で起こってい
血小板は血管壁を選択的に不透過性にし、腫瘍細胞の転移を減らすことが発見された
 スウェーデンのウプサラ大学の研究者は、癌における血小板のこれまで知られていない機能を発見した。 マウスモデルでは、これらの血小板が血管壁の保護に役立ち、血管壁を選択的に不透過性にすることで、腫瘍細胞の体の他の部分への広がりを抑えていることが発見された。この研究成果は、2020年6月25日にCancer Researchのオンラインで発表された。 この論文は「血小板特異的PDGFBアブレーションは腫瘍血管の完全性を損ない、転移を促進する(Platelet-Specific PDGFB Ablation Impairs Tumor Vessel Integrity and Promotes Metastasis.)」と題されている。
血小板は核のない小さな細胞片で、骨髄で形成され、血液中を循環している。怪我をして出血すると、血小板は凝集し、傷を塞ぎ、血液の凝固を助ける。 血小板が活性化されると(それは創傷だけでなく腫瘍でも発生する)、血小板に含まれる成長因子がその周囲に放出される。これらの成長因子の1つは血小板由来成長因子B(PDGFB)だ。 この研究者らは、癌患者の血小板のPDGFBが削除された場合に何が起こるかを調査し、血小板からのPDGFBは、支持細胞を腫瘍血管に引き付けるために不可欠であることが判明した。
一方、健康な組織では、血小板はこの機能を果たさなかった。 血小板のPDGFBが不足している場合、循環する腫瘍細胞の量は増加し、体の他の部位にはるかに広がって行った。以前の研究では、血管の内側を覆う内皮細胞である別の種類の細胞からのPDGFBが、形成時に支持細胞を血管に引き付けるために必要であることが示されている。 この新しい研究によると、腫瘍におけるこの機能には血小板からのPDGFBも必要であり、これにより腫瘍と健康な組織が区別される。 医学的見地から、例えば、血
スウェーデンのウプサラ大学の研究者は、癌における血小板のこれまで知られていない機能を発見した。 マウスモデルでは、これらの血小板が血管壁の保護に役立ち、血管壁を選択的に不透過性にすることで、腫瘍細胞の体の他の部分への広がりを抑えていることが発見された。この研究成果は、2020年6月25日にCancer Researchのオンラインで発表された。 この論文は「血小板特異的PDGFBアブレーションは腫瘍血管の完全性を損ない、転移を促進する(Platelet-Specific PDGFB Ablation Impairs Tumor Vessel Integrity and Promotes Metastasis.)」と題されている。
血小板は核のない小さな細胞片で、骨髄で形成され、血液中を循環している。怪我をして出血すると、血小板は凝集し、傷を塞ぎ、血液の凝固を助ける。 血小板が活性化されると(それは創傷だけでなく腫瘍でも発生する)、血小板に含まれる成長因子がその周囲に放出される。これらの成長因子の1つは血小板由来成長因子B(PDGFB)だ。 この研究者らは、癌患者の血小板のPDGFBが削除された場合に何が起こるかを調査し、血小板からのPDGFBは、支持細胞を腫瘍血管に引き付けるために不可欠であることが判明した。
一方、健康な組織では、血小板はこの機能を果たさなかった。 血小板のPDGFBが不足している場合、循環する腫瘍細胞の量は増加し、体の他の部位にはるかに広がって行った。以前の研究では、血管の内側を覆う内皮細胞である別の種類の細胞からのPDGFBが、形成時に支持細胞を血管に引き付けるために必要であることが示されている。 この新しい研究によると、腫瘍におけるこの機能には血小板からのPDGFBも必要であり、これにより腫瘍と健康な組織が区別される。 医学的見地から、例えば、血
老化T細胞を除去し、肥満による代謝障害を改善する新しいワクチンの開発
 老化は多面的なプロセスであり、多くの点で我々の体に影響を与える。 大阪大学大学院医学系研究科・健康発達医学グループの中神啓徳博士らの新しい研究では、研究者が高齢の免疫細胞を除去する新しいワクチンを開発し、肥満マウスにワクチン接種することにより糖尿病関連の代謝異常の改善を実証した。 老化した細胞は、炎症環境を作り出すことにより、周囲の若い細胞に害を及ぼすことが知られている。T細胞(画像)と呼ばれる特定の種類の免疫細胞は、老化した肥満の脂肪組織に蓄積し、慢性炎症、代謝障害、心臓病を引き起こす。 老化細胞の身体への悪影響を軽減するために、これらの不正な細胞を標的にして排除するための治療法が開発された。
ただし、このアプローチは老化細胞の種類を区別しないため、老化T細胞の特定の枯渇が臓器生理への悪影響を改善できるかどうかは不明のままだ。
2020年5月18日にNature Communicationsでオンラインで公開されたこのオープンアクセスの論文は「CD153ワクチンはマウスの老化T細胞の蓄積を防ぐための老化治療オプション(The CD153 Vaccine Is a Senotherapeutic Option for Preventing the Accumulation of Senescent T Cells in Mice)」と題されている。 「老化細胞を排除することで加齢に伴う臓器機能障害が改善されるという考えはかなり新しいものだ」と、中神博士は述べている。 「老化T細胞は糖尿病と同様に代謝異常を促進する可能性があるため、老化T細胞の数を減らしてグルコース代謝に及ぼす悪影響を逆転させる新しいアプローチを考え出したのだ。」目標を達成するために、研究者らは、脂肪組織に住む老化T細胞に存在する表面タンパク質CD153を標的とする新しいワクチンを開発し、それにより
老化は多面的なプロセスであり、多くの点で我々の体に影響を与える。 大阪大学大学院医学系研究科・健康発達医学グループの中神啓徳博士らの新しい研究では、研究者が高齢の免疫細胞を除去する新しいワクチンを開発し、肥満マウスにワクチン接種することにより糖尿病関連の代謝異常の改善を実証した。 老化した細胞は、炎症環境を作り出すことにより、周囲の若い細胞に害を及ぼすことが知られている。T細胞(画像)と呼ばれる特定の種類の免疫細胞は、老化した肥満の脂肪組織に蓄積し、慢性炎症、代謝障害、心臓病を引き起こす。 老化細胞の身体への悪影響を軽減するために、これらの不正な細胞を標的にして排除するための治療法が開発された。
ただし、このアプローチは老化細胞の種類を区別しないため、老化T細胞の特定の枯渇が臓器生理への悪影響を改善できるかどうかは不明のままだ。
2020年5月18日にNature Communicationsでオンラインで公開されたこのオープンアクセスの論文は「CD153ワクチンはマウスの老化T細胞の蓄積を防ぐための老化治療オプション(The CD153 Vaccine Is a Senotherapeutic Option for Preventing the Accumulation of Senescent T Cells in Mice)」と題されている。 「老化細胞を排除することで加齢に伴う臓器機能障害が改善されるという考えはかなり新しいものだ」と、中神博士は述べている。 「老化T細胞は糖尿病と同様に代謝異常を促進する可能性があるため、老化T細胞の数を減らしてグルコース代謝に及ぼす悪影響を逆転させる新しいアプローチを考え出したのだ。」目標を達成するために、研究者らは、脂肪組織に住む老化T細胞に存在する表面タンパク質CD153を標的とする新しいワクチンを開発し、それにより
赤色光は網膜ミトコンドリアを再活性化し加齢に伴う視力低下を改善するとUCLが報告
 人は真っ赤な光を1日3分間見つめると、視力の低下を大幅に改善できるとの初めての研究成果が、ロンドン大学ユニバーシティカレッジ(UCL)主導の研究により報告された。この研究者らは、2020年6月29日にThe Journals of Gerontology・シリーズAのオンラインに掲載されたこの発見が、手頃な価格の新しい家庭用眼科治療法の幕開けを告げるものであり、自然に衰退する世界の何百万もの人々を助けることができるものと信じている。この論文は「光学的に改善されたミトコンドリア機能は、老化した人間の視覚低下を取り戻す(Optically Improved Mitochondrial Function Redeems Aged Human Visual Decline.)」と題されている。
英国には、現在65歳以上の1,200万人がいる。50年間で、これは約2,000万人に増加し、網膜老化のためにすべてがある程度視覚的に衰退する。筆頭著者であるUCL Institute of OphthalmologyのGlen Jeffery博士は、次のように述べている。「特に40歳以上になると、視覚系が著しく低下する。網膜の感度と色覚は徐々に弱まり、高齢化に伴い、これはますます重要な問題となっている。 この衰退を食い止めるか逆転させるために、我々は網膜の老化細胞を長波光の短いバーストで再起動しようとした。」「約40歳の人間では、目の網膜の細胞が老化し始める。この老化は、一部には、エネルギー(ATPとして知られている)を生成し細胞機能を高める役割を持つ細胞のミトコンドリアの衰退が原因で発生する。ミトコンドリア密度は、高いエネルギー需要がある網膜の視細胞では最大だ。その結果、網膜は他の臓器よりも早く老化し、一生を通じてATPが70%減少し、これらの受容体は正常な役割を果たすためのエネル
人は真っ赤な光を1日3分間見つめると、視力の低下を大幅に改善できるとの初めての研究成果が、ロンドン大学ユニバーシティカレッジ(UCL)主導の研究により報告された。この研究者らは、2020年6月29日にThe Journals of Gerontology・シリーズAのオンラインに掲載されたこの発見が、手頃な価格の新しい家庭用眼科治療法の幕開けを告げるものであり、自然に衰退する世界の何百万もの人々を助けることができるものと信じている。この論文は「光学的に改善されたミトコンドリア機能は、老化した人間の視覚低下を取り戻す(Optically Improved Mitochondrial Function Redeems Aged Human Visual Decline.)」と題されている。
英国には、現在65歳以上の1,200万人がいる。50年間で、これは約2,000万人に増加し、網膜老化のためにすべてがある程度視覚的に衰退する。筆頭著者であるUCL Institute of OphthalmologyのGlen Jeffery博士は、次のように述べている。「特に40歳以上になると、視覚系が著しく低下する。網膜の感度と色覚は徐々に弱まり、高齢化に伴い、これはますます重要な問題となっている。 この衰退を食い止めるか逆転させるために、我々は網膜の老化細胞を長波光の短いバーストで再起動しようとした。」「約40歳の人間では、目の網膜の細胞が老化し始める。この老化は、一部には、エネルギー(ATPとして知られている)を生成し細胞機能を高める役割を持つ細胞のミトコンドリアの衰退が原因で発生する。ミトコンドリア密度は、高いエネルギー需要がある網膜の視細胞では最大だ。その結果、網膜は他の臓器よりも早く老化し、一生を通じてATPが70%減少し、これらの受容体は正常な役割を果たすためのエネル
舌の微生物は心不全の大規模スクリーニング、診断、および長期モニタリングに役立つ可能性が示唆された
 2020年6月23日に欧州心臓病学会(ESC)の科学的プラットフォームである心不全協会のHFA Discoveriesで発表された研究によれば、舌の微生物は心不全の診断に役立つ可能性があるという。このプレゼンテーションの要約は、「舌コーティングマイクロバイオームデータにより、慢性心不全の患者と健康な患者を区別する(Tongue Coating Microbiome Data Distinguish Patients with Chronic Heart Failure from Healthy.)」と題されている。
「慢性心不全の患者の舌は健康な人の舌とは完全に異なっているように見える」と広州中国医学大学第1病院の研究者で著者のTianhui Yuan博士は述べた。 心不全の患者は黄色のコーティングが施された赤い舌をしており、疾患が進行するにつれて外観が変化する。 我々の研究(舌コーティングマイクロバイオームデータは、慢性心不全の患者と健康な患者を区別する)は、舌コーティングの組成、量、および優勢な細菌が心不全の患者と健康な人々の間で異なることを発見した。以前の研究では、舌のコーティングに含まれる微生物が膵臓癌の患者と健康な人を区別できることが示されている。 その研究の著者は、これを膵臓癌を診断するための初期マーカーとして提案した。 また、特定の細菌は免疫と関連しているため、著者らは微生物の不均衡が炎症と疾患を刺激する可能性があることを示唆した。 炎症と免疫反応も心不全に関与している。現在の研究では、慢性心不全の有無に関係なく、参加者の舌のマイクロバイオームの組成を調査した。 この研究では、慢性心不全の入院患者42人と健常者28人が登録された。 参加者のいずれも、口腔、舌、または歯科疾患、または、過去1週間に上気道感染症の罹患、または、過去1週間に抗生物質と免疫抑制剤の使
2020年6月23日に欧州心臓病学会(ESC)の科学的プラットフォームである心不全協会のHFA Discoveriesで発表された研究によれば、舌の微生物は心不全の診断に役立つ可能性があるという。このプレゼンテーションの要約は、「舌コーティングマイクロバイオームデータにより、慢性心不全の患者と健康な患者を区別する(Tongue Coating Microbiome Data Distinguish Patients with Chronic Heart Failure from Healthy.)」と題されている。
「慢性心不全の患者の舌は健康な人の舌とは完全に異なっているように見える」と広州中国医学大学第1病院の研究者で著者のTianhui Yuan博士は述べた。 心不全の患者は黄色のコーティングが施された赤い舌をしており、疾患が進行するにつれて外観が変化する。 我々の研究(舌コーティングマイクロバイオームデータは、慢性心不全の患者と健康な患者を区別する)は、舌コーティングの組成、量、および優勢な細菌が心不全の患者と健康な人々の間で異なることを発見した。以前の研究では、舌のコーティングに含まれる微生物が膵臓癌の患者と健康な人を区別できることが示されている。 その研究の著者は、これを膵臓癌を診断するための初期マーカーとして提案した。 また、特定の細菌は免疫と関連しているため、著者らは微生物の不均衡が炎症と疾患を刺激する可能性があることを示唆した。 炎症と免疫反応も心不全に関与している。現在の研究では、慢性心不全の有無に関係なく、参加者の舌のマイクロバイオームの組成を調査した。 この研究では、慢性心不全の入院患者42人と健常者28人が登録された。 参加者のいずれも、口腔、舌、または歯科疾患、または、過去1週間に上気道感染症の罹患、または、過去1週間に抗生物質と免疫抑制剤の使
血液型とCOVID-19の重篤化リスクについての関連性がNEJMで発表
 2020年6月18日、NIHのディレクターであるFrancis Collins 医学博士は、血液型と重度の COVID-19 のリスクについてブログに投稿した。 本記事は、そのブログの内容に基づいている 。 Collins 博士のブログのタイトルは「遺伝子、血液型は深刻なCOVID-19のリスクに結びついている(Genes, Blood Type Tied to Risk of Severe COVID-19.)」 と題されている。COVID-19に罹患した多くの人々は、軽い病気であるか、まったく症状がないこともある。 しかし、その他の人々は、彼らが回復するのを助けるために酸素サポートまたはベンチレータさえも必要とする呼吸不全を発症する。 これは、女性より男性の方が多く、年配の人や慢性的な健康状態の人にも起こる。
しかし、なぜ若くて健康そうに見える人に呼吸不全が時々起こるのだろうか?
新しい研究は、この質問に対する答えの一部が、我々一人一人が持っている遺伝子に見つかるかもしれないことを示唆している。 責任ある正確な基礎となる遺伝子とメカニズムを特定するにはさらなる研究が必要だが、2020年6月17日にニューイングランドジャーナルオブメディシンのオンラインで、ヒトゲノムの2つの領域の遺伝子変異が重度のCOVID-19に関連し、それに応じてCOVID-19関連の死亡のリスクが高いことが発表された。重度のCOVID-19のリスクを内包しているとされる2種類のDNAは、血液型を決定する遺伝子や、免疫系でさまざまな役割を果たすその他の興味深い遺伝子を運ぶことが知られている。
実際、この調査結果は、血液型Aの人が新しいコロナウイルスに感染した場合、酸素サポートまたは人工呼吸器を必要とするリスクが50%高くなることを示唆している。 対照的に、血液型Oの人は、重度のCOVID-
2020年6月18日、NIHのディレクターであるFrancis Collins 医学博士は、血液型と重度の COVID-19 のリスクについてブログに投稿した。 本記事は、そのブログの内容に基づいている 。 Collins 博士のブログのタイトルは「遺伝子、血液型は深刻なCOVID-19のリスクに結びついている(Genes, Blood Type Tied to Risk of Severe COVID-19.)」 と題されている。COVID-19に罹患した多くの人々は、軽い病気であるか、まったく症状がないこともある。 しかし、その他の人々は、彼らが回復するのを助けるために酸素サポートまたはベンチレータさえも必要とする呼吸不全を発症する。 これは、女性より男性の方が多く、年配の人や慢性的な健康状態の人にも起こる。
しかし、なぜ若くて健康そうに見える人に呼吸不全が時々起こるのだろうか?
新しい研究は、この質問に対する答えの一部が、我々一人一人が持っている遺伝子に見つかるかもしれないことを示唆している。 責任ある正確な基礎となる遺伝子とメカニズムを特定するにはさらなる研究が必要だが、2020年6月17日にニューイングランドジャーナルオブメディシンのオンラインで、ヒトゲノムの2つの領域の遺伝子変異が重度のCOVID-19に関連し、それに応じてCOVID-19関連の死亡のリスクが高いことが発表された。重度のCOVID-19のリスクを内包しているとされる2種類のDNAは、血液型を決定する遺伝子や、免疫系でさまざまな役割を果たすその他の興味深い遺伝子を運ぶことが知られている。
実際、この調査結果は、血液型Aの人が新しいコロナウイルスに感染した場合、酸素サポートまたは人工呼吸器を必要とするリスクが50%高くなることを示唆している。 対照的に、血液型Oの人は、重度のCOVID-
MMRワクチンによる自然免疫システムの活性化はCOVID-19の最悪の後遺症への予防策になるとの提言
 MMRワクチン(はしか、おたふく風邪、風疹)の投与は、 COVID-19 感染に関連する敗血症性炎症を抑制する予防策として役立つ可能性があると、2020年6月19日にアメリカ微生物学会のmBioジャーナルで発表された。この論文は、「COVID-19感染に関連する敗血症性炎症を抑制する予防策として、無関係の生弱毒化ワクチンが役立つだろうか?(Could an Unrelated Live Attenuated Vaccine Serve As a Preventive Measure to Dampen Septic Inflammation Associated with COVID-19 Infection?)」 と題されている。ルイジアナ州立大学医療歯学部の口腔および頭蓋顔面生物学の部長で研究担当副学部長のPaul Fidel, Jr.博士、および彼の妻であるニューオーリンズのトゥレーン大学医学部 微生物学および免疫学の教授であるのMairi Noverr 博士 は、彼らの研究から得た見地に基づき、見通し論文を共同執筆した。
彼らは無関係の投与という概念を提唱する。 MMR(はしか、おたふく風邪、風疹)などの弱毒生ワクチンは、COVID-19の最悪の後遺症に対する予防策として役立つ。 免疫適格者におけるMMRによるワクチン接種には禁忌はなく、COVID-19に容易に曝露される可能性のある医療従事者にとって特に効果的である可能性があるとこの研究者らは述べている。「生きている弱毒化ワクチンは、標的病原体に対する免疫だけでなく、いくつかの非特異的な利点があるようだ。高リスク集団におけるMMRを用いた臨床試験は、COVID-19パンデミックにおける命を救う上で低リスク/高リターンの予防策を提供するかもしれない」とFidel 博士は述べた。「我々が臨床試験を行っている間、はしか
MMRワクチン(はしか、おたふく風邪、風疹)の投与は、 COVID-19 感染に関連する敗血症性炎症を抑制する予防策として役立つ可能性があると、2020年6月19日にアメリカ微生物学会のmBioジャーナルで発表された。この論文は、「COVID-19感染に関連する敗血症性炎症を抑制する予防策として、無関係の生弱毒化ワクチンが役立つだろうか?(Could an Unrelated Live Attenuated Vaccine Serve As a Preventive Measure to Dampen Septic Inflammation Associated with COVID-19 Infection?)」 と題されている。ルイジアナ州立大学医療歯学部の口腔および頭蓋顔面生物学の部長で研究担当副学部長のPaul Fidel, Jr.博士、および彼の妻であるニューオーリンズのトゥレーン大学医学部 微生物学および免疫学の教授であるのMairi Noverr 博士 は、彼らの研究から得た見地に基づき、見通し論文を共同執筆した。
彼らは無関係の投与という概念を提唱する。 MMR(はしか、おたふく風邪、風疹)などの弱毒生ワクチンは、COVID-19の最悪の後遺症に対する予防策として役立つ。 免疫適格者におけるMMRによるワクチン接種には禁忌はなく、COVID-19に容易に曝露される可能性のある医療従事者にとって特に効果的である可能性があるとこの研究者らは述べている。「生きている弱毒化ワクチンは、標的病原体に対する免疫だけでなく、いくつかの非特異的な利点があるようだ。高リスク集団におけるMMRを用いた臨床試験は、COVID-19パンデミックにおける命を救う上で低リスク/高リターンの予防策を提供するかもしれない」とFidel 博士は述べた。「我々が臨床試験を行っている間、はしか
攻撃的な大腸癌細胞でアポトーシスを元に戻す真菌化合物の全合成に成功
 癌細胞は、多くの場合、増殖するために特別なテクニックを使用する。 彼らは突然変異によって「プログラムされた死」を無効にし、生涯が終わったときに死ぬことを「忘れ」、代わりに成長し続ける。 東京理科大学の研究チームは、特定の癌細胞で自己破壊プログラムを再活性化できる真菌化合物を大量に人工的に生産し、潜在的な癌治療戦略を提供する方法を開発した。すべてのヒトの体細胞には一定の寿命があり、その間に体細胞は本質的な義務を果たす。 この寿命の終わりに、それらは老化に達し、もはやそれらの義務を果たすことができなくなり、死ぬ。 この自殺死は、アポトーシスと呼ばれるプロセスを通じて遺伝子にプログラムされ、新鮮で若くて健康な細胞がそれらを置き換える方法を作るために、自己破壊させる。
p53と呼ばれる特別な遺伝子の変異は、このアポトーシスのプロセスを妨げることがある。 老化、紫外線、および/またはさまざまな変異原性化合物によって引き起こされるこれらの変異は、アポトーシスを無効にし、死なずに増殖し続ける「ゾンビ」細胞をもたらし、無効にする変異を広げ、健康な作動細胞を不死の腫瘍の急速な成長に置き換える。 これが我々が癌と呼んでいる病気で、どの体細胞が突然変異を起こしているかによって様々な形をとる。以前に研究者は、アスコキタ(Ascochyta)と呼ばれる糸状菌の種でFE399と呼ばれる抗癌化合物を特定した。これは、穀物などの一般的な食用作物を苦しめることがある。 この化合物は二環式デプシペプチド (depsipeptide) であり、癌性のヒト細胞、特に結腸直腸癌の細胞にアポトーシスを誘導することが示されているが、それらはまだin vitroであり、抗癌剤としての可能性があることを示している。[編集者注:デプシペプチドは、そのアミド-C(O)NHR-基の1つ以上が対応するエステル-C(O)ORで置き
癌細胞は、多くの場合、増殖するために特別なテクニックを使用する。 彼らは突然変異によって「プログラムされた死」を無効にし、生涯が終わったときに死ぬことを「忘れ」、代わりに成長し続ける。 東京理科大学の研究チームは、特定の癌細胞で自己破壊プログラムを再活性化できる真菌化合物を大量に人工的に生産し、潜在的な癌治療戦略を提供する方法を開発した。すべてのヒトの体細胞には一定の寿命があり、その間に体細胞は本質的な義務を果たす。 この寿命の終わりに、それらは老化に達し、もはやそれらの義務を果たすことができなくなり、死ぬ。 この自殺死は、アポトーシスと呼ばれるプロセスを通じて遺伝子にプログラムされ、新鮮で若くて健康な細胞がそれらを置き換える方法を作るために、自己破壊させる。
p53と呼ばれる特別な遺伝子の変異は、このアポトーシスのプロセスを妨げることがある。 老化、紫外線、および/またはさまざまな変異原性化合物によって引き起こされるこれらの変異は、アポトーシスを無効にし、死なずに増殖し続ける「ゾンビ」細胞をもたらし、無効にする変異を広げ、健康な作動細胞を不死の腫瘍の急速な成長に置き換える。 これが我々が癌と呼んでいる病気で、どの体細胞が突然変異を起こしているかによって様々な形をとる。以前に研究者は、アスコキタ(Ascochyta)と呼ばれる糸状菌の種でFE399と呼ばれる抗癌化合物を特定した。これは、穀物などの一般的な食用作物を苦しめることがある。 この化合物は二環式デプシペプチド (depsipeptide) であり、癌性のヒト細胞、特に結腸直腸癌の細胞にアポトーシスを誘導することが示されているが、それらはまだin vitroであり、抗癌剤としての可能性があることを示している。[編集者注:デプシペプチドは、そのアミド-C(O)NHR-基の1つ以上が対応するエステル-C(O)ORで置き
ヨーロッパの医療用ヒルのゲノム配列が発表された
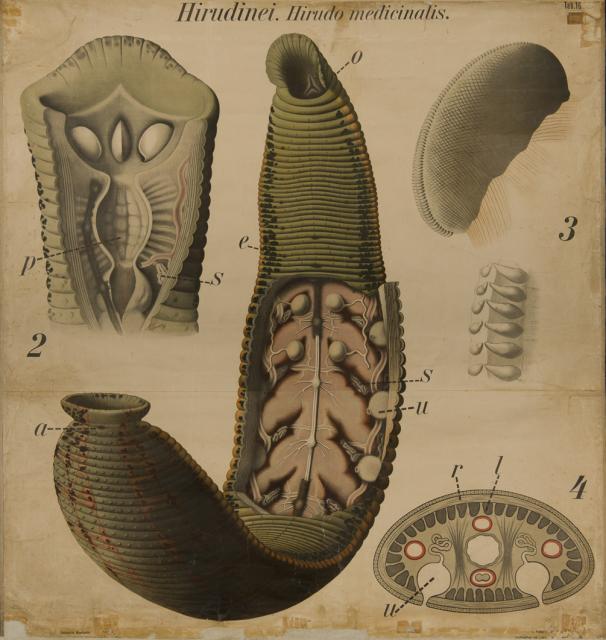 2020年6月18日にScientific Reportsでオンラインで公開された新しい研究成果は、薬用ヒルの使用に大きな影響を与える可能性のある洞察を明らかにしている。 このオープンアクセスの論文は、「抗凝固剤に重点を置いたヨーロッパの薬用ヒルHirudo medicinalis(Annelida, Clitellata, Hirudiniformes)のドラフトゲノム(Draft Genome of the European Medicinal Leech Hirudo medicinalis (Annelida, Clitellata, Hirudiniformes) with Emphasis On Anticoagulants.)」と題されている。
王立オンタリオ博物館(ROM)の科学者でトロント大学の生態学及び進化生物学の部門の教授であるセバスチャン・クヴィスト(Sebastian Kvist, PhD)が率いる国際的な研究チームは、ヨーロッパのヒルであり、最も有名に使用されている薬用種の1つであるHirudo medicinalisのゲノムシーケンスを発表した。チームは、ゲノム内に含まれる抗凝血剤または抗凝血剤の多様性に焦点を当て、病院内での吸血生物の使用方法に大きな影響を与える可能性のある結果を生み出した。 薬用ヒルは、さまざまな人間の状態を治療するために長い間使用されてきた。 しかし、前近代医学におけるそれらの使用は、初期の根拠のない治癒理論に基づいていた。主に、人体の機能は、4つの「体液」、つまり血液、痰、黒色胆汁、黄色胆汁のバランスに依存していたということだ。 しばしば生ヒルを適用することによって患者の血液を排出することは、そのバランスを回復すると考えられていた。
今日、Hirudo verbanaとHirudo medicinalis の2つのヒ
2020年6月18日にScientific Reportsでオンラインで公開された新しい研究成果は、薬用ヒルの使用に大きな影響を与える可能性のある洞察を明らかにしている。 このオープンアクセスの論文は、「抗凝固剤に重点を置いたヨーロッパの薬用ヒルHirudo medicinalis(Annelida, Clitellata, Hirudiniformes)のドラフトゲノム(Draft Genome of the European Medicinal Leech Hirudo medicinalis (Annelida, Clitellata, Hirudiniformes) with Emphasis On Anticoagulants.)」と題されている。
王立オンタリオ博物館(ROM)の科学者でトロント大学の生態学及び進化生物学の部門の教授であるセバスチャン・クヴィスト(Sebastian Kvist, PhD)が率いる国際的な研究チームは、ヨーロッパのヒルであり、最も有名に使用されている薬用種の1つであるHirudo medicinalisのゲノムシーケンスを発表した。チームは、ゲノム内に含まれる抗凝血剤または抗凝血剤の多様性に焦点を当て、病院内での吸血生物の使用方法に大きな影響を与える可能性のある結果を生み出した。 薬用ヒルは、さまざまな人間の状態を治療するために長い間使用されてきた。 しかし、前近代医学におけるそれらの使用は、初期の根拠のない治癒理論に基づいていた。主に、人体の機能は、4つの「体液」、つまり血液、痰、黒色胆汁、黄色胆汁のバランスに依存していたということだ。 しばしば生ヒルを適用することによって患者の血液を排出することは、そのバランスを回復すると考えられていた。
今日、Hirudo verbanaとHirudo medicinalis の2つのヒ
肥満は精子にエピジェネティックな変化を引き起こすことが判明
 人間を対象とした研究で、男性の肥満が精子のエピゲノムをダイナミックに変化させ、その変化が子供に遺伝し、次世代の代謝に深刻かつ長期的な影響を残す可能性が最近の研究で示唆されている。複数の小部分に分かれるこの研究では、特に痩せ型と肥満型の父親の場合では精子のsmall ncRNA (non-coding RNA)の発現に大きな違いがあることを初めて示した。
このsmall ncRNAは、RNAのサブタイプで、エピジェネティックな遺伝への関わりが強く示されている。もう少し具体的に言うと、piRNA (piwi-interacting RNA)と呼ばれるsmall ncRNAのあるサブタイプは、痩せ型と肥満型の男性では発現が異なることが突き止められたのである。piRNAは、主として生殖系で発現し、反復配列を抑制することでゲノムの安定性を維持したり、コード遺伝子の発現を調節したりなどの基本的な役割で知られている。エピジェネティックな遺伝におけるpiRNAの役割については過去にショウジョウバエの研究で示されている。今回の研究では、痩せ型と肥満型の男性で発現が異なるpiRNAのターゲット予測で、「Chromosome」や「Chromatin」などの用語や「Chemdependancy」のような遺伝子アノテーション用語に対してbest enrichment scoreを示す遺伝子を拾い出した。 特に、肥満に関わる摂食調節物質であるコカイン・アンフェタミン調節転写産物 (CART) が、肥満型男性では発現が異なっていた。研究のこの部分の結果から、同研究チームは、「このような変化を受けたpiRNAの発現が、それに合わせて、行動や摂食に関わる遺伝子の発現を修正し、子供の肥満的傾向を引き起こすのではないか」と推定している。
研究のもう一つの部分で、病的肥満型の男性が手術で減量した場合、精子DN
人間を対象とした研究で、男性の肥満が精子のエピゲノムをダイナミックに変化させ、その変化が子供に遺伝し、次世代の代謝に深刻かつ長期的な影響を残す可能性が最近の研究で示唆されている。複数の小部分に分かれるこの研究では、特に痩せ型と肥満型の父親の場合では精子のsmall ncRNA (non-coding RNA)の発現に大きな違いがあることを初めて示した。
このsmall ncRNAは、RNAのサブタイプで、エピジェネティックな遺伝への関わりが強く示されている。もう少し具体的に言うと、piRNA (piwi-interacting RNA)と呼ばれるsmall ncRNAのあるサブタイプは、痩せ型と肥満型の男性では発現が異なることが突き止められたのである。piRNAは、主として生殖系で発現し、反復配列を抑制することでゲノムの安定性を維持したり、コード遺伝子の発現を調節したりなどの基本的な役割で知られている。エピジェネティックな遺伝におけるpiRNAの役割については過去にショウジョウバエの研究で示されている。今回の研究では、痩せ型と肥満型の男性で発現が異なるpiRNAのターゲット予測で、「Chromosome」や「Chromatin」などの用語や「Chemdependancy」のような遺伝子アノテーション用語に対してbest enrichment scoreを示す遺伝子を拾い出した。 特に、肥満に関わる摂食調節物質であるコカイン・アンフェタミン調節転写産物 (CART) が、肥満型男性では発現が異なっていた。研究のこの部分の結果から、同研究チームは、「このような変化を受けたpiRNAの発現が、それに合わせて、行動や摂食に関わる遺伝子の発現を修正し、子供の肥満的傾向を引き起こすのではないか」と推定している。
研究のもう一つの部分で、病的肥満型の男性が手術で減量した場合、精子DN
減数分裂の時に、染色体はどうやって相方を見つけるのか?
 1世紀以上の研究を経ても、未だ減数分裂によって生物体が繁殖するメカニズムはミステリーのままであり、細胞分裂の過程においても、父系と母系独自の遺伝的多様性を司る特異的な位置を占めている。ミズーリー州カンサス市ストワーズ医学研究所の研究者たちは、減数分裂の初期に重要なメカニズムが動いている事に注目している。この研究はCurrent Biology誌2011年10月27日号のオンライン版に発表され、シナプトネマ構造(SC)に含まれるセントロメアと呼ばれる重要な染色体領域の役割が、明らかにされている。「今回の成果と、減数分裂に関する他のメカニズムを理解する事は大変重要です。
それは減数分裂が生物の正常な繁殖に大変重要な位置を占めており、もし減数分裂がうまく行かなければ、悲惨な結末を見る事になるのです。減数分裂が不首尾に終われば、自然流産の最たる要因となり、またダウン症のような出生異常を引き起こします。」とストワーズ医学研究所のプロジェクトを率いるスコット・ハーレイ博士は語る。
減数分裂とは、それぞれの染色体数の半分を正確に卵細胞と精細胞に振り分ける事によって、母方と父方それぞれの個体の細胞に由来する染色体数を半分に減らすことである。これによって適切な数の染色体が親から子へと受け継がれる。そして染色体は対になっておりヒトでは23対を成し、減数分裂する前に適切に揃っていなければならない。「父方の第1染色体は母方の第1染色体と対になれねばならず、第2染色体、そしてそれ以下も同じようにマッチングせねばなりません。本当に不思議な事ですが、一切のエラーは許されません。減数分裂においては最初のペアリングが極めて重要です。そこを間違うと、残りは全部間違ってしまうのです」とハーレイ博士は説明する。それは丁度ショッピングモールで知り合いを見つけるようなもので、着ている服やどの場所によく立ち寄
1世紀以上の研究を経ても、未だ減数分裂によって生物体が繁殖するメカニズムはミステリーのままであり、細胞分裂の過程においても、父系と母系独自の遺伝的多様性を司る特異的な位置を占めている。ミズーリー州カンサス市ストワーズ医学研究所の研究者たちは、減数分裂の初期に重要なメカニズムが動いている事に注目している。この研究はCurrent Biology誌2011年10月27日号のオンライン版に発表され、シナプトネマ構造(SC)に含まれるセントロメアと呼ばれる重要な染色体領域の役割が、明らかにされている。「今回の成果と、減数分裂に関する他のメカニズムを理解する事は大変重要です。
それは減数分裂が生物の正常な繁殖に大変重要な位置を占めており、もし減数分裂がうまく行かなければ、悲惨な結末を見る事になるのです。減数分裂が不首尾に終われば、自然流産の最たる要因となり、またダウン症のような出生異常を引き起こします。」とストワーズ医学研究所のプロジェクトを率いるスコット・ハーレイ博士は語る。
減数分裂とは、それぞれの染色体数の半分を正確に卵細胞と精細胞に振り分ける事によって、母方と父方それぞれの個体の細胞に由来する染色体数を半分に減らすことである。これによって適切な数の染色体が親から子へと受け継がれる。そして染色体は対になっておりヒトでは23対を成し、減数分裂する前に適切に揃っていなければならない。「父方の第1染色体は母方の第1染色体と対になれねばならず、第2染色体、そしてそれ以下も同じようにマッチングせねばなりません。本当に不思議な事ですが、一切のエラーは許されません。減数分裂においては最初のペアリングが極めて重要です。そこを間違うと、残りは全部間違ってしまうのです」とハーレイ博士は説明する。それは丁度ショッピングモールで知り合いを見つけるようなもので、着ている服やどの場所によく立ち寄
ミトコンドリアタンパク質Mitofusin 2の欠損が引き起こす疾患の治療にコエンザイムQサプリメントが役立つことが判明
 Mitofusin2の新しい役割の発見により、ミトコンドリアタンパク質の欠損が引き起こす疾病の治療法に繋がるかもしれない。この研究はThe Journal of Cell Biologyに掲載された。Mitofusin 2およびそれに密接に関係するMitofusin 1は、ミトコンドリアの外膜に位置している。
両タンパク質はオルガネラの近傍で接合し、内容物を交換する重要なメンテナンス機能であるミトコンドリア融合にとって重要である。Mitofusin 1をコードするMfn1遺伝子を欠損したマウスは全く健康であるが、Mfn2が欠損したマウスは、出生後すぐに死んでしまう。さらに、Mfn2遺伝子の突然変異が人間に末梢神経障害であるシャルコー・マリー・トゥース病Type 2Aを含む疾患を引き起こすことが知られている。よってMitofusin 2の欠損は、他の膜融合と比べてミトコンドリア融合に影響を及ぼすと思われるが、その原因は判っていなかった。
マックスプランク研究所のNils-Göran Larsson博士らは、Mfn2が欠損したマウスの心筋細胞を使い調査した。彼らはこの細胞のエネルギー代謝が、健康な細胞およびMfn1が欠損している細胞と比較して損なわれていることを発見した。彼らはATPの形で細胞エネルギーを発生させるミトコンドリア呼吸鎖の鍵となるコエンザイムQの減少で、動作停止に陥る過程を特定した。Mitofusin 2の欠損では、コエンザイムQの前駆体となるパスウエイにある多くの酵素や分子が減少することから、Mitofusin 2はコエンザイムQの生産に必要であることが示された。コエンザイムQをMfn2欠損細胞に補充することで、Larsson博士らは呼吸鎖機能を部分的に回復できることを見出した。これらより彼らはコエンザイムQサプリメントはMfn2変異による疾患の治療に
Mitofusin2の新しい役割の発見により、ミトコンドリアタンパク質の欠損が引き起こす疾病の治療法に繋がるかもしれない。この研究はThe Journal of Cell Biologyに掲載された。Mitofusin 2およびそれに密接に関係するMitofusin 1は、ミトコンドリアの外膜に位置している。
両タンパク質はオルガネラの近傍で接合し、内容物を交換する重要なメンテナンス機能であるミトコンドリア融合にとって重要である。Mitofusin 1をコードするMfn1遺伝子を欠損したマウスは全く健康であるが、Mfn2が欠損したマウスは、出生後すぐに死んでしまう。さらに、Mfn2遺伝子の突然変異が人間に末梢神経障害であるシャルコー・マリー・トゥース病Type 2Aを含む疾患を引き起こすことが知られている。よってMitofusin 2の欠損は、他の膜融合と比べてミトコンドリア融合に影響を及ぼすと思われるが、その原因は判っていなかった。
マックスプランク研究所のNils-Göran Larsson博士らは、Mfn2が欠損したマウスの心筋細胞を使い調査した。彼らはこの細胞のエネルギー代謝が、健康な細胞およびMfn1が欠損している細胞と比較して損なわれていることを発見した。彼らはATPの形で細胞エネルギーを発生させるミトコンドリア呼吸鎖の鍵となるコエンザイムQの減少で、動作停止に陥る過程を特定した。Mitofusin 2の欠損では、コエンザイムQの前駆体となるパスウエイにある多くの酵素や分子が減少することから、Mitofusin 2はコエンザイムQの生産に必要であることが示された。コエンザイムQをMfn2欠損細胞に補充することで、Larsson博士らは呼吸鎖機能を部分的に回復できることを見出した。これらより彼らはコエンザイムQサプリメントはMfn2変異による疾患の治療に
セストリンと呼ばれるタンパク質が、運動と同じ効果を発揮する可能性をミシガン大学の研究者が発見
 公園での早歩きだろうが、ジムでのトレーニングだろうが、運動は体に良い。 しかし、筋肉を動かさずにトレーニングの利点を活用できるとしたらどうだろう? ミシガン大学医学部の研究者らは、セストリン(Sestrin)と呼ばれる天然に存在するタンパク質を研究し、これらのタンパク質がハエやマウスで運動効果の多くを模倣できることを発見した。 この研究成果は、最終的に科学者が老化やその他の原因による筋肉の消耗と戦うのに役立つ可能性がある。
この研究成果は、2020年1月13日にNature Communicationsのオンライン版で公開された。 このオープンアクセスは「セストリンは運動的に有益な進化的に保存されたメディエーターである。(Sestrins Are Evolutionarily Conserved Mediators of Exercise Benefits.)」と題されている。「研究者は以前、運動後にセストリンが筋肉に蓄積することを観察していた」と ミシガン大学医学部の分子および統合生理学の研究助教授であるMyungjin Kim 博士は述べた。Jun Hee Lee 教授および共同研究者チームと協力して、Kim 博士は運動とタンパク質の明らかな関連性についてさらに学びたいと考えた。 彼らの最初のステップは、ハエのグループに運動を促すことだった。
デトロイトのウェイン州立大学の共同研究者であるRobert Wessells 博士と Alyson Sujkowski 氏は、ショウジョウバエの通常の本能を利用して試験管を乗り降りする“ルームランナー”を開発した。 それを使用して、チームはハエを3週間訓練し、通常のハエの走行能力と飛行能力を、セストリンを作る能力を欠くように飼育されたハエのものと比較した。 「ハエは通常、この時点で約4〜6時間走ることができ、その期間に通
公園での早歩きだろうが、ジムでのトレーニングだろうが、運動は体に良い。 しかし、筋肉を動かさずにトレーニングの利点を活用できるとしたらどうだろう? ミシガン大学医学部の研究者らは、セストリン(Sestrin)と呼ばれる天然に存在するタンパク質を研究し、これらのタンパク質がハエやマウスで運動効果の多くを模倣できることを発見した。 この研究成果は、最終的に科学者が老化やその他の原因による筋肉の消耗と戦うのに役立つ可能性がある。
この研究成果は、2020年1月13日にNature Communicationsのオンライン版で公開された。 このオープンアクセスは「セストリンは運動的に有益な進化的に保存されたメディエーターである。(Sestrins Are Evolutionarily Conserved Mediators of Exercise Benefits.)」と題されている。「研究者は以前、運動後にセストリンが筋肉に蓄積することを観察していた」と ミシガン大学医学部の分子および統合生理学の研究助教授であるMyungjin Kim 博士は述べた。Jun Hee Lee 教授および共同研究者チームと協力して、Kim 博士は運動とタンパク質の明らかな関連性についてさらに学びたいと考えた。 彼らの最初のステップは、ハエのグループに運動を促すことだった。
デトロイトのウェイン州立大学の共同研究者であるRobert Wessells 博士と Alyson Sujkowski 氏は、ショウジョウバエの通常の本能を利用して試験管を乗り降りする“ルームランナー”を開発した。 それを使用して、チームはハエを3週間訓練し、通常のハエの走行能力と飛行能力を、セストリンを作る能力を欠くように飼育されたハエのものと比較した。 「ハエは通常、この時点で約4〜6時間走ることができ、その期間に通
特定の接合性プラスミドがCRISPR-Casを回避するメカニズムをカナダの研究グループがNARで発表
 Nucleic Acids Research(NAR)で2020年6月18日に発表された「Breakthrough Article」で、カナダのシェルブルック大学のVincent Burrus博士が率いる研究者グループは、(細菌株と種間の抗生物質耐性遺伝子の動員と移動を促進する)特定の接合性プラスミドが、如何にCRISPR防御システムの分解メカニズムを回避するかを解説している。NARのBreakthrough Articlesは、その分野における長年の問題を解決する研究、または新しい研究の機会と方向性を明確に動機づけ、導く研究分野への例外的な新しい洞察と理解を提供する研究について説明している。 これらは、NARが出版のために受け取る上位の論文を表し、著者および/または査読者による推薦、ならびに査読者および編集委員のその後の推薦に基づいて編集者によって選択される。
このオープンアクセスのBreakthrough Articleは、「IncC接合プラスミドおよびSXT/R391エレメントが、接合中にCRISPR–Casによって引き起こされる二本鎖切断を修復する(IncC Conjugative Plasmids and SXT/R391 Elements Repair Double-Strand Breaks Caused by CRISPR–Cas During Conjugation.)」と題されている。抗生物質耐性遺伝子は、主に統合および接合要素(ICE)と接合プラスミドによって伝達されるが、バクテリオファージによっても伝達される。 細菌はそのような侵略者(CRISPR-Casおよび制限-修飾システムを含む)に対する防御メカニズムを進化させてきたが、移動する遺伝的要素もこれらの障壁を克服するための多様な戦略を進化させてきた。 この論文では、薬剤耐性関連の非互換性グ
Nucleic Acids Research(NAR)で2020年6月18日に発表された「Breakthrough Article」で、カナダのシェルブルック大学のVincent Burrus博士が率いる研究者グループは、(細菌株と種間の抗生物質耐性遺伝子の動員と移動を促進する)特定の接合性プラスミドが、如何にCRISPR防御システムの分解メカニズムを回避するかを解説している。NARのBreakthrough Articlesは、その分野における長年の問題を解決する研究、または新しい研究の機会と方向性を明確に動機づけ、導く研究分野への例外的な新しい洞察と理解を提供する研究について説明している。 これらは、NARが出版のために受け取る上位の論文を表し、著者および/または査読者による推薦、ならびに査読者および編集委員のその後の推薦に基づいて編集者によって選択される。
このオープンアクセスのBreakthrough Articleは、「IncC接合プラスミドおよびSXT/R391エレメントが、接合中にCRISPR–Casによって引き起こされる二本鎖切断を修復する(IncC Conjugative Plasmids and SXT/R391 Elements Repair Double-Strand Breaks Caused by CRISPR–Cas During Conjugation.)」と題されている。抗生物質耐性遺伝子は、主に統合および接合要素(ICE)と接合プラスミドによって伝達されるが、バクテリオファージによっても伝達される。 細菌はそのような侵略者(CRISPR-Casおよび制限-修飾システムを含む)に対する防御メカニズムを進化させてきたが、移動する遺伝的要素もこれらの障壁を克服するための多様な戦略を進化させてきた。 この論文では、薬剤耐性関連の非互換性グ
アッシャー症候群の新しい治療法
 アッシャー症候群は6000人に1人に起こる難聴と失明を伴う先天性疾患であり、臨床的にも遺伝学的にも異種性の劣性遺伝から起こる。重度のアッシャー症候群の場合、患者は出生時から難聴を煩い、思春期の辺りから網膜変性症が見られるようになり、最終的には全盲になる。これらの患者は日常生活に多大な問題を抱えることになる。
軽度から中等度の難聴の場合は補聴器で補えるものの、視覚障害についての効果的な治療法は今まで開発されていなかった。しかしこの度、ドイツのヨハネス・グーイテンバーグ大学マインツ (JGU)の研究者たちがアッシャー症候群の効果的な治療法を見つけた。マインツ大学動物学研究所の ウベ・ウルフラム教授率いる研究チームは以前行なった研究により、この衰弱性症候群の基本的な分子作用メカニズムとその原理に対する洞察を得る事が出来たのである。
この良好な研究結果をもとに、マインツの カースチン・ナーゲル・ウルフラム博士率いるアッシャー症候群治療チームは眼球治療を可能とする治療法についての評価を開始した。彼らは、重度のアッシャー症候群を発症する確率の高いドイツのある家系から同定された遺伝子変異に注目した。いわゆるナンセンス変異と呼ばれる変異がUSH1C遺伝子に発生し、DNA配列に終止シグナルが生じる事により不完全なタンパク質が合成される。マインツの研究チームはアッシャー症候群患者のナンセンス変異を治療する遺伝薬理学的治療戦略についての論文をHuman Gene Therapy誌の5月号に発表した。PTC124 (Ataluren®)という低分子が、変異したUSHIC遺伝子による終止シグナルを無視することによってタンパク質の合成が継続され、細胞や培養臓器に機能的な遺伝子産物が形成される事を研究チームは実証した。 終止シグナルを読み飛ばす機能に加え、PTC124はマウスとヒトの培養網膜と
アッシャー症候群は6000人に1人に起こる難聴と失明を伴う先天性疾患であり、臨床的にも遺伝学的にも異種性の劣性遺伝から起こる。重度のアッシャー症候群の場合、患者は出生時から難聴を煩い、思春期の辺りから網膜変性症が見られるようになり、最終的には全盲になる。これらの患者は日常生活に多大な問題を抱えることになる。
軽度から中等度の難聴の場合は補聴器で補えるものの、視覚障害についての効果的な治療法は今まで開発されていなかった。しかしこの度、ドイツのヨハネス・グーイテンバーグ大学マインツ (JGU)の研究者たちがアッシャー症候群の効果的な治療法を見つけた。マインツ大学動物学研究所の ウベ・ウルフラム教授率いる研究チームは以前行なった研究により、この衰弱性症候群の基本的な分子作用メカニズムとその原理に対する洞察を得る事が出来たのである。
この良好な研究結果をもとに、マインツの カースチン・ナーゲル・ウルフラム博士率いるアッシャー症候群治療チームは眼球治療を可能とする治療法についての評価を開始した。彼らは、重度のアッシャー症候群を発症する確率の高いドイツのある家系から同定された遺伝子変異に注目した。いわゆるナンセンス変異と呼ばれる変異がUSH1C遺伝子に発生し、DNA配列に終止シグナルが生じる事により不完全なタンパク質が合成される。マインツの研究チームはアッシャー症候群患者のナンセンス変異を治療する遺伝薬理学的治療戦略についての論文をHuman Gene Therapy誌の5月号に発表した。PTC124 (Ataluren®)という低分子が、変異したUSHIC遺伝子による終止シグナルを無視することによってタンパク質の合成が継続され、細胞や培養臓器に機能的な遺伝子産物が形成される事を研究チームは実証した。 終止シグナルを読み飛ばす機能に加え、PTC124はマウスとヒトの培養網膜と
COVID-19治療薬レロンリマブについてのQ&A、リファレンス
 2020年5月1日CytoDyn社WEBINARにおけるレロンリマブに関する質問(ログインするとQ&Aを表示):• この薬は COVID-19 の単剤治療に使用できますか?それとも最終的な分析に役立つ併用薬物療法を想定していますか?• FDAがレロンリマブを使用することで何人の命を救うことができるのかを理解するのが難しいのはなぜですか?• レロンリマブは、主に免疫系の回復または何らかの新しいメカニズムによる血漿ウイルス負荷を軽減する能力がありますか?• 血液検査の結果は、重度から重症のCOVID患者に報告されている凝固の問題をどのように説明するのに役立ちますか?• レロンリマブを投与された患者の入院期間の改善は何でですか? 後に患者はIgMまたはIgGのレベルが上昇しますか?• レロンリマブとレムデシビルを組み合わせるように求められた場合、CytoDynの立場はどうか?• COVID-19の結果が非常に悪いのに、なぜGilead社は注目を集めているのか?• MOAは健康な細胞のCCR5受容体を阻害することでしょうか?• 主な長期的な副作用は何か?• Gilead社のレムデシビルやGenentech社のアクテムラとは、どう違うのですか?• RANTESの過剰発現は、どのような直接的または間接的なメカニズムによって、SARS-CoV2によって引き起こされると考えているか?
講演者の経歴NADER Z. POURHASSAN、PhD; CYTODYNのディレクター、社長、CEOPourhassan 博士は、1985年にユタ州立大学で理学士号を、1990年にブリガムヤング大学で理学修士号を、1998年にユタ大学で機械工学の博士号を取得している。Pourhassan 博士は3冊の本を執筆している。彼の20年間のビジネス開発経験は、破産の危機に瀕している上場のバイオテクノロジー
2020年5月1日CytoDyn社WEBINARにおけるレロンリマブに関する質問(ログインするとQ&Aを表示):• この薬は COVID-19 の単剤治療に使用できますか?それとも最終的な分析に役立つ併用薬物療法を想定していますか?• FDAがレロンリマブを使用することで何人の命を救うことができるのかを理解するのが難しいのはなぜですか?• レロンリマブは、主に免疫系の回復または何らかの新しいメカニズムによる血漿ウイルス負荷を軽減する能力がありますか?• 血液検査の結果は、重度から重症のCOVID患者に報告されている凝固の問題をどのように説明するのに役立ちますか?• レロンリマブを投与された患者の入院期間の改善は何でですか? 後に患者はIgMまたはIgGのレベルが上昇しますか?• レロンリマブとレムデシビルを組み合わせるように求められた場合、CytoDynの立場はどうか?• COVID-19の結果が非常に悪いのに、なぜGilead社は注目を集めているのか?• MOAは健康な細胞のCCR5受容体を阻害することでしょうか?• 主な長期的な副作用は何か?• Gilead社のレムデシビルやGenentech社のアクテムラとは、どう違うのですか?• RANTESの過剰発現は、どのような直接的または間接的なメカニズムによって、SARS-CoV2によって引き起こされると考えているか?
講演者の経歴NADER Z. POURHASSAN、PhD; CYTODYNのディレクター、社長、CEOPourhassan 博士は、1985年にユタ州立大学で理学士号を、1990年にブリガムヤング大学で理学修士号を、1998年にユタ大学で機械工学の博士号を取得している。Pourhassan 博士は3冊の本を執筆している。彼の20年間のビジネス開発経験は、破産の危機に瀕している上場のバイオテクノロジー
MITの科学者がCOVID-19等におけるサイトカインストームの治療に有用な水溶性改変サイトカイン受容体を設計
 Covid-19 の決定的な特徴の1つは、重症例で発生する可能性のある過剰な免疫応答だ。 この免疫過剰反応のバーストは、サイトカインストームとも呼ばれ、肺に損傷を与え、致命的となる可能性がある。MITの研究チームは、これらの過剰なサイトカインを吸収するために、抗体と構造が類似した特殊なタンパク質を開発した。 「アイデアは、体内に注入され、サイトカインストームによって生成された過剰なサイトカインに結合し、過剰なサイトカインを取り除き、感染症から症状を緩和できるということだ」と、研究論文の著者の一人でMITの研究者であるRui Qing博士は述べた。研究者らは、最初の発見を Quarterly Review of Biophysics (QRB) Discovery で報告しており、現在、ヒト細胞およびサイトカイン放出とコロナウイルス感染の動物モデルでタンパク質のテストを開始したいと考えている。 この論文は「QTYコードで設計された水溶性Fc-Fusionサイトカイン受容体がそれぞれのリガンドに結合する(QTY Code-Designed Water-Soluble Fc-Fusion Cytokine Receptors Bind to Their Respective Ligands.)」と題されている。
MITメディアラボの分子アーキテクチャ研究所の主任研究科学者であるShuguang Zhang博士も、この論文の上級著者だ。 MITの客員科学者であるShilei Hao博士は、この研究の筆頭著者であり、Avalon GloboCareのCEO兼社長であるDavid Jin医学博士も著者である。サイトカインストームの遮断に関する研究者の研究は、Zhang 博士が10年前に膜に埋め込まれたタンパク質の修飾版を開発するために始めたプロジェクトから生まれた。 これらの
Covid-19 の決定的な特徴の1つは、重症例で発生する可能性のある過剰な免疫応答だ。 この免疫過剰反応のバーストは、サイトカインストームとも呼ばれ、肺に損傷を与え、致命的となる可能性がある。MITの研究チームは、これらの過剰なサイトカインを吸収するために、抗体と構造が類似した特殊なタンパク質を開発した。 「アイデアは、体内に注入され、サイトカインストームによって生成された過剰なサイトカインに結合し、過剰なサイトカインを取り除き、感染症から症状を緩和できるということだ」と、研究論文の著者の一人でMITの研究者であるRui Qing博士は述べた。研究者らは、最初の発見を Quarterly Review of Biophysics (QRB) Discovery で報告しており、現在、ヒト細胞およびサイトカイン放出とコロナウイルス感染の動物モデルでタンパク質のテストを開始したいと考えている。 この論文は「QTYコードで設計された水溶性Fc-Fusionサイトカイン受容体がそれぞれのリガンドに結合する(QTY Code-Designed Water-Soluble Fc-Fusion Cytokine Receptors Bind to Their Respective Ligands.)」と題されている。
MITメディアラボの分子アーキテクチャ研究所の主任研究科学者であるShuguang Zhang博士も、この論文の上級著者だ。 MITの客員科学者であるShilei Hao博士は、この研究の筆頭著者であり、Avalon GloboCareのCEO兼社長であるDavid Jin医学博士も著者である。サイトカインストームの遮断に関する研究者の研究は、Zhang 博士が10年前に膜に埋め込まれたタンパク質の修飾版を開発するために始めたプロジェクトから生まれた。 これらの
吸血鬼伝説は突然変異による血液疾患の実在の人物をもとにした話かも知れない
 ポルフィリン症は、8種の血液疾患の総称で、酸素運搬タンパク質のヘモグロビンを構成するヘムをつくる体の分子的メカニズムが不調を来す疾患である。ヘムが鉄と結合すると血液独特の赤色になる。ヘム産生に影響する遺伝的変異のタイプによって、現れるポルフィリン症の臨床症候群も異なっている。吸血鬼伝説が生まれた原因になったと考えられる症候群もその一つである。
子供に発生するもっとも一般的なポルフィリン症は骨髄性プロトポルフィリン症 (EPP) と呼ばれるもので、患者の皮膚が光に対して異常に敏感になるという特徴があり、長時間陽光にさらされると痛みを伴う醜い火ぶくれになることがある。Dana-Farber/Boston Children's Cancer and Blood Disorders CenterのBarry Paw MD, PhDは、「EPP患者は慢性的な貧血症のため、常に疲労感を抱えており、しかも光感受性が高まっていて日光に当たることができないため、非常に青白い外貌になる。曇りの日でも体の露出した部分、耳、鼻などに火ぶくれや皮膚の変形を起こすのに十分な紫外線が届いている。日中は屋内で過ごし、十分な量のヘムを含んだ輸血でこの疾患の症状を一部緩和することはできる。大昔なら動物の血を飲み、夜の間だけ出歩くことで同じ効果が得られただろうが、吸血鬼伝説を広げることにもなったはずである。2017年9月5日付PNASオンライン版に掲載された研究論文で、Dr. Pawと国際的な研究チームは、EPPを引き起こす遺伝変異を新しく発見したと述べている。その論文では、「吸血鬼伝説」の原因になったと思われる、これまで知られていなかった生物学的機序に光を当て、EPPの治療標的を突き止めている。
この論文は、「ヒトCLPXの突然変異はδ-アミノレブリン酸合成酵素レベルを上昇させ、赤血球生成プロトポルフィリ
ポルフィリン症は、8種の血液疾患の総称で、酸素運搬タンパク質のヘモグロビンを構成するヘムをつくる体の分子的メカニズムが不調を来す疾患である。ヘムが鉄と結合すると血液独特の赤色になる。ヘム産生に影響する遺伝的変異のタイプによって、現れるポルフィリン症の臨床症候群も異なっている。吸血鬼伝説が生まれた原因になったと考えられる症候群もその一つである。
子供に発生するもっとも一般的なポルフィリン症は骨髄性プロトポルフィリン症 (EPP) と呼ばれるもので、患者の皮膚が光に対して異常に敏感になるという特徴があり、長時間陽光にさらされると痛みを伴う醜い火ぶくれになることがある。Dana-Farber/Boston Children's Cancer and Blood Disorders CenterのBarry Paw MD, PhDは、「EPP患者は慢性的な貧血症のため、常に疲労感を抱えており、しかも光感受性が高まっていて日光に当たることができないため、非常に青白い外貌になる。曇りの日でも体の露出した部分、耳、鼻などに火ぶくれや皮膚の変形を起こすのに十分な紫外線が届いている。日中は屋内で過ごし、十分な量のヘムを含んだ輸血でこの疾患の症状を一部緩和することはできる。大昔なら動物の血を飲み、夜の間だけ出歩くことで同じ効果が得られただろうが、吸血鬼伝説を広げることにもなったはずである。2017年9月5日付PNASオンライン版に掲載された研究論文で、Dr. Pawと国際的な研究チームは、EPPを引き起こす遺伝変異を新しく発見したと述べている。その論文では、「吸血鬼伝説」の原因になったと思われる、これまで知られていなかった生物学的機序に光を当て、EPPの治療標的を突き止めている。
この論文は、「ヒトCLPXの突然変異はδ-アミノレブリン酸合成酵素レベルを上昇させ、赤血球生成プロトポルフィリ
シベリアで3万年前の古代巨大ウイルス発見
 Information Genomique et Structurale laboratory (CNRS/AMU)、Biologie a Grande Echelle laboratory (CEA/INSERM/Universite Joseph Fourier)、Genoscope (CEA/CNRS)、Russian Academy of Sciences合同の研究チームがシベリア最北東部で永久凍土の中から「ピソウイルス」と名付けられた巨大ウイルスの新種を発見した。
ヒトや動物には無害と判断されているこの巨大ウイルスは地中に埋もれたまま3万年以上も凍土の中で生き延びてきたもので、そのサイズや古代の陶製広口壷に似た形からパンドラウイルスを思わせるが、ゲノムや複製メカニズムの解析からピソウイルスはパンドラウイルスとは全く異なることが証明されている。
この研究の結果、巨大ウイルスの科が3つになった。この発見は2014年3月3日付PNASオンライン版に掲載されている。
これまで、メガウイルス科 (2003年に発見されたミミウイルスがその代表) とパンドラウイルス科の発見で、様々な巨大ウイルス (いずれも直径が0.5ミクロンを超えるため、光学顕微鏡でも識別できる数少ないウイルス) をすべて分類できたと考えられていた。この種のウイルスはアカントアメーバなどのアメーバに感染し、一般的なウイルス (遺伝子10個程度のインフルエンザやAIDSのウイルス) に比べるとかなり多数の遺伝子を持っている。そのゲノムは細菌のほとんどと比べても同じ規模かあるいはもっと大きいことがある。研究チームはシベリア北東端にあるチュクチ自治管区の永久凍土層で採取したサンプルを調べていて、3万年以前 (ネアンデルタール人が絶滅した時期) の巨大ウイルスの新種を発見、彼らはそのウイルスを「ピソウイル
Information Genomique et Structurale laboratory (CNRS/AMU)、Biologie a Grande Echelle laboratory (CEA/INSERM/Universite Joseph Fourier)、Genoscope (CEA/CNRS)、Russian Academy of Sciences合同の研究チームがシベリア最北東部で永久凍土の中から「ピソウイルス」と名付けられた巨大ウイルスの新種を発見した。
ヒトや動物には無害と判断されているこの巨大ウイルスは地中に埋もれたまま3万年以上も凍土の中で生き延びてきたもので、そのサイズや古代の陶製広口壷に似た形からパンドラウイルスを思わせるが、ゲノムや複製メカニズムの解析からピソウイルスはパンドラウイルスとは全く異なることが証明されている。
この研究の結果、巨大ウイルスの科が3つになった。この発見は2014年3月3日付PNASオンライン版に掲載されている。
これまで、メガウイルス科 (2003年に発見されたミミウイルスがその代表) とパンドラウイルス科の発見で、様々な巨大ウイルス (いずれも直径が0.5ミクロンを超えるため、光学顕微鏡でも識別できる数少ないウイルス) をすべて分類できたと考えられていた。この種のウイルスはアカントアメーバなどのアメーバに感染し、一般的なウイルス (遺伝子10個程度のインフルエンザやAIDSのウイルス) に比べるとかなり多数の遺伝子を持っている。そのゲノムは細菌のほとんどと比べても同じ規模かあるいはもっと大きいことがある。研究チームはシベリア北東端にあるチュクチ自治管区の永久凍土層で採取したサンプルを調べていて、3万年以前 (ネアンデルタール人が絶滅した時期) の巨大ウイルスの新種を発見、彼らはそのウイルスを「ピソウイル
南米先住民族ヤノマミ族のマイクロバイオーム、工業化社会の人間より40%も多様
 New York University (NYU) Langone Medical Centerの研究者が主導するアメリカとベネズエラの多施設間研究チームの調査で、ベネズエラ南部のアマゾンのジャングルで、他の人類から孤絶して暮らす南米先住民族のヤノマミ族の腸内細菌叢が、これまでに知られている人間の腸内細菌叢の中でもっとも多様性に富んでいることが突き止められた。それに比べると、研究チームの推定では、工業化社会の人間の腸内細菌叢の多様性は40%低い。研究チームは、この研究結果を2015年4月17日付Science Advancesのオープン・アクセス研究論文で発表している。
研究チームは、「この研究結果は、人間の体内に住み着き、人間の健康への重要な役割が認識され始めている何兆個という数の細菌の群、ヒト・マイクロバイオームの多様性の低下と現代社会の抗生物質の多用や加工食品の普及という変化の間に何らかの関係があることを示している」と述べている。この研究の対象になったヤノマミ族の村人は何百世代にもわたって狩猟採集生活を続けてきており、2009年に医学学術調査団が初めて接触するまで外界から孤絶して暮らしていた。
村人は、近代的な抗生物質にさらされたことのない希有な人口グループとして、ヒト・マイクロバイオームの貴重な手がかりになっている。この論文の首席著者で、NYU Langone Medical CenterのMedicine准教授を務めるMaria Dominguez-Bello, Ph.D.は、「ヤノマミ族の村人の糞便、皮膚、口腔唾液のサンプルから今まで見たことがないほど多様なマイクロバイオームを発見した」と述べている。さらに、「細菌の多様性低下、食事の加工食品化、現代の抗生物質などと肥満、喘息、アレルギー、糖尿病など免疫学的な疾患や代謝病との関連を示すデータが増えている
New York University (NYU) Langone Medical Centerの研究者が主導するアメリカとベネズエラの多施設間研究チームの調査で、ベネズエラ南部のアマゾンのジャングルで、他の人類から孤絶して暮らす南米先住民族のヤノマミ族の腸内細菌叢が、これまでに知られている人間の腸内細菌叢の中でもっとも多様性に富んでいることが突き止められた。それに比べると、研究チームの推定では、工業化社会の人間の腸内細菌叢の多様性は40%低い。研究チームは、この研究結果を2015年4月17日付Science Advancesのオープン・アクセス研究論文で発表している。
研究チームは、「この研究結果は、人間の体内に住み着き、人間の健康への重要な役割が認識され始めている何兆個という数の細菌の群、ヒト・マイクロバイオームの多様性の低下と現代社会の抗生物質の多用や加工食品の普及という変化の間に何らかの関係があることを示している」と述べている。この研究の対象になったヤノマミ族の村人は何百世代にもわたって狩猟採集生活を続けてきており、2009年に医学学術調査団が初めて接触するまで外界から孤絶して暮らしていた。
村人は、近代的な抗生物質にさらされたことのない希有な人口グループとして、ヒト・マイクロバイオームの貴重な手がかりになっている。この論文の首席著者で、NYU Langone Medical CenterのMedicine准教授を務めるMaria Dominguez-Bello, Ph.D.は、「ヤノマミ族の村人の糞便、皮膚、口腔唾液のサンプルから今まで見たことがないほど多様なマイクロバイオームを発見した」と述べている。さらに、「細菌の多様性低下、食事の加工食品化、現代の抗生物質などと肥満、喘息、アレルギー、糖尿病など免疫学的な疾患や代謝病との関連を示すデータが増えている
母親のミトコンドリア遺伝子が子供の老化に影響
 人間は年を取るにつれて器官の機能が衰えるだけでなく、細胞レベルでも損傷が徐々に増えていく。その理由の一つとして、DNAのエラーが累積され、欠陥のある細胞が作られるようになることが挙げられる。ドイツのケルン所在Max Planck Institute for Biology of AgeingのDr. Nils-Goran Larsson率いる研究チームが、老化は生活の間のDNA損傷の累積によって決まるだけでなく、母体から受け継いだ損傷によるところもあることを突き止めた。
同研究チームは、マウスを使った研究で母体から受け継ぐミトコンドリアDNAの突然変異が、生まれた瞬間から子供の老化過程に影響することを実証したのである。この研究論文は、2103年8月21日付「Nature」オンライン版に掲載されている。老化は複雑なプロセスであり、歳月を経るうちに身体の組織、細胞、分子の損傷が累積していき、最終的に器官の機能が衰え、死亡のリスクが高くなる。なぜ人によって老化の速さが異なるのかという疑問に対しては未だに解き明かされていない理由がいくつもある。それでも、細胞のエネルギー源であるミトコンドリアに起きる損傷は老化に対して特に重要と見られている。Dr. Larssonは、ケルンのMax Planck Institute for Biology of AgingでDirectorを務め、ストックホルムのKarolinska Institute所属の研究者でもある。そのDr. Larssonが、同じKarolinska InstituteのDr. Lars Olsonとともにこの研究を指導した。Dr. Larssonは、「ミトコンドリアは、ミトコンドリアDNAまたはmtDNAと呼ばれる独自のDNAを持っており、細胞核中のDNAよりも変化が速い。これが老化プロセスに大きく影響しており、
人間は年を取るにつれて器官の機能が衰えるだけでなく、細胞レベルでも損傷が徐々に増えていく。その理由の一つとして、DNAのエラーが累積され、欠陥のある細胞が作られるようになることが挙げられる。ドイツのケルン所在Max Planck Institute for Biology of AgeingのDr. Nils-Goran Larsson率いる研究チームが、老化は生活の間のDNA損傷の累積によって決まるだけでなく、母体から受け継いだ損傷によるところもあることを突き止めた。
同研究チームは、マウスを使った研究で母体から受け継ぐミトコンドリアDNAの突然変異が、生まれた瞬間から子供の老化過程に影響することを実証したのである。この研究論文は、2103年8月21日付「Nature」オンライン版に掲載されている。老化は複雑なプロセスであり、歳月を経るうちに身体の組織、細胞、分子の損傷が累積していき、最終的に器官の機能が衰え、死亡のリスクが高くなる。なぜ人によって老化の速さが異なるのかという疑問に対しては未だに解き明かされていない理由がいくつもある。それでも、細胞のエネルギー源であるミトコンドリアに起きる損傷は老化に対して特に重要と見られている。Dr. Larssonは、ケルンのMax Planck Institute for Biology of AgingでDirectorを務め、ストックホルムのKarolinska Institute所属の研究者でもある。そのDr. Larssonが、同じKarolinska InstituteのDr. Lars Olsonとともにこの研究を指導した。Dr. Larssonは、「ミトコンドリアは、ミトコンドリアDNAまたはmtDNAと呼ばれる独自のDNAを持っており、細胞核中のDNAよりも変化が速い。これが老化プロセスに大きく影響しており、
太平洋の植物、ミトコンドリアに6種の異種ゲノム呑み込む
 遠く離れた太平洋のたった一つの島にだけ茂る植物、Amborella trichopodaは一科一属一種の植物である。また、この植物は、2億年前に他の植物から分かれたもっとも古い顕花植物の一つでもある。Indiana University、U.S. Department of Energy Joint Genome Institute (DOE JGI)、Penn State University、ニュー・カレドニアのInstitute of Research for Developmentの合同研究チームは、この植物のエネルギー生成構造を支える異常なほどのゲノムの規模を突き止めた。
なんと、この植物は、細胞中のエネルギー生成小器官である ミトコンドリアが遺伝子の水平伝播と呼ばれる特異な現象で他種植物のDNAの6種に相当するゲノムを獲得していたのである。1種はコケ、3種の緑藻、2種の顕花植物のゲノムだった。細胞小器官が他種生物のゲノムをまるまま取り込んだことを確認されたのは初めてであり、陸上植物が緑藻の遺伝子を吸収していることを確認されたのも初めてだった。2013年12月20日付Science誌に掲載された研究論文の首席著者、Indiana UniversityのDr. Palmerは、「Amborella trichopodaのミトコンドリアは、他の植物や藻類のゲノムをまるまま呑み込み、そればかりか、そのゲノムを長い歳月にわたって保存してきた」と述べ、論文もAmborellaのゲノム大食癖の規模を明らかにしている。
このミトコンドリア・ゲノムに関する研究の報告には、Amborella Genome ProjectによるAmborella trichopoodaの核ゲノムに関する研究論文、他の研究グループによるAmborella trichopodaの質の高いゲノム
遠く離れた太平洋のたった一つの島にだけ茂る植物、Amborella trichopodaは一科一属一種の植物である。また、この植物は、2億年前に他の植物から分かれたもっとも古い顕花植物の一つでもある。Indiana University、U.S. Department of Energy Joint Genome Institute (DOE JGI)、Penn State University、ニュー・カレドニアのInstitute of Research for Developmentの合同研究チームは、この植物のエネルギー生成構造を支える異常なほどのゲノムの規模を突き止めた。
なんと、この植物は、細胞中のエネルギー生成小器官である ミトコンドリアが遺伝子の水平伝播と呼ばれる特異な現象で他種植物のDNAの6種に相当するゲノムを獲得していたのである。1種はコケ、3種の緑藻、2種の顕花植物のゲノムだった。細胞小器官が他種生物のゲノムをまるまま取り込んだことを確認されたのは初めてであり、陸上植物が緑藻の遺伝子を吸収していることを確認されたのも初めてだった。2013年12月20日付Science誌に掲載された研究論文の首席著者、Indiana UniversityのDr. Palmerは、「Amborella trichopodaのミトコンドリアは、他の植物や藻類のゲノムをまるまま呑み込み、そればかりか、そのゲノムを長い歳月にわたって保存してきた」と述べ、論文もAmborellaのゲノム大食癖の規模を明らかにしている。
このミトコンドリア・ゲノムに関する研究の報告には、Amborella Genome ProjectによるAmborella trichopoodaの核ゲノムに関する研究論文、他の研究グループによるAmborella trichopodaの質の高いゲノム
抗酸化物質には、アルコール誘発性肝疾患防止の可能性
 アラバマ大学バーミンガム校(UAB)と共同研究機関の新しい発表によると、過度の飲酒が原因とされる肝臓障害を、抗酸化物質で予防できる可能性がある。研究結果は、脂肪症の進行阻止もしくは、肝硬変や肝癌に至る可能性のある肝臓の脂肪沈着を治療可能な道筋を示すような知見が、「Journal Hepatology」(2011年5月号)に発表された。UAB 校のDr. Victor Darley-Usmar 病理学教授が率いる研究チームは、ヒトにとって過剰摂取に相当するアルコール量を、ラットのミトコンドリアに5〜6週間にわたって毎日注入した。
そして、このミトコンドリアに、ミトコンドリア標的ユビキノンもしくはMitoQと呼ばれる抗酸化物質を導入した。
毎日過度に飲酒する慢性アルコール依存症では、肝細胞に脂肪蓄積が起こる。肝臓でのアルコール代謝の際にフリーラジカル(遊離活性基)を発生し、これが肝細胞中のミトコンドリアに損傷を与え、エネルギー産生に必要な酸素量の取り込みを妨げる。「低酸素症」と呼ばれる低酸素状態は、ミトコンドリアの損傷を悪化させ、肝硬変へ進行する可能性のある脂肪沈着の形成を促進する。Dr. Victor Darley-Usmar教授や共同研究者は,次のように語る。「抗酸化物質MitoQは、フリーラジカルがミトコンドリアを損傷する前にフリーラジカルを迎え撃ち、中和することができる。そして最終的に脂肪症につながるという一連の反応のカスケードを防ぐ可能性がある。「過度の飲酒から生じる肝臓のアルコール沈着に伴う慢性的な損傷の予防や症状の好転にアプローチする有望な医薬品は今まで存在しなかった。」さらに彼は語る。「私達の研究結果から、MitoQは長期間の習慣的なアルコール摂取に起因する肝臓障害の治療に有効な製剤になるかもしれないことが示唆された。」「今までの研究で、MitoQはヒ
アラバマ大学バーミンガム校(UAB)と共同研究機関の新しい発表によると、過度の飲酒が原因とされる肝臓障害を、抗酸化物質で予防できる可能性がある。研究結果は、脂肪症の進行阻止もしくは、肝硬変や肝癌に至る可能性のある肝臓の脂肪沈着を治療可能な道筋を示すような知見が、「Journal Hepatology」(2011年5月号)に発表された。UAB 校のDr. Victor Darley-Usmar 病理学教授が率いる研究チームは、ヒトにとって過剰摂取に相当するアルコール量を、ラットのミトコンドリアに5〜6週間にわたって毎日注入した。
そして、このミトコンドリアに、ミトコンドリア標的ユビキノンもしくはMitoQと呼ばれる抗酸化物質を導入した。
毎日過度に飲酒する慢性アルコール依存症では、肝細胞に脂肪蓄積が起こる。肝臓でのアルコール代謝の際にフリーラジカル(遊離活性基)を発生し、これが肝細胞中のミトコンドリアに損傷を与え、エネルギー産生に必要な酸素量の取り込みを妨げる。「低酸素症」と呼ばれる低酸素状態は、ミトコンドリアの損傷を悪化させ、肝硬変へ進行する可能性のある脂肪沈着の形成を促進する。Dr. Victor Darley-Usmar教授や共同研究者は,次のように語る。「抗酸化物質MitoQは、フリーラジカルがミトコンドリアを損傷する前にフリーラジカルを迎え撃ち、中和することができる。そして最終的に脂肪症につながるという一連の反応のカスケードを防ぐ可能性がある。「過度の飲酒から生じる肝臓のアルコール沈着に伴う慢性的な損傷の予防や症状の好転にアプローチする有望な医薬品は今まで存在しなかった。」さらに彼は語る。「私達の研究結果から、MitoQは長期間の習慣的なアルコール摂取に起因する肝臓障害の治療に有効な製剤になるかもしれないことが示唆された。」「今までの研究で、MitoQはヒ
細胞核とミトコンドリアのDNAの異なる突然変異による相互作用
 植物、動物の細胞には2つのゲノムがある。一つは細胞核に、もう一つはミトコンドリアに含まれている。それぞれゲノムで突然変異が起きた場合、互いに異なる配列の変異を呈し、それが原因で病気になる場合がある。最近、ブラウン大学とインディアナ大学の科学者チームが、その病気をさらによく知るため、ショウジョウバエを対象として、個々のヌクレオチドの逸脱やショウジョウバエが発病する機序までを研究した。単一のゲノムの突然変異による発病だけでも十分に複雑だが、細胞核のDNAとミトコンドリアのDNAという2つのゲノム同士の相互作用の逸脱で引き起こされる病気もある。
科学者は、そのようなゲノム同士の変異の違いが原因で発病する過程を調べようと考えた。そこで、ブラウン大学とインディアナ大学の科学者チームは、ショウジョウバエのゲノムが異なる配列の突然変異を引き起こす過程を個々のヌクレオチドの突然変異の水準まで追求し、二つの遺伝子の同時的な突然変異でショウジョウバエが発病する機序を突き止めた。ブラウン大学の生物学教授で、この研究論文の筆頭著者でもあるDr. David Randは、「この機序は人間の病気にもあてはまるが、この2つのゲノムはすべての動物、植物に存在するため、すべての有機体にあてはまるというべきだ」と語っている。この研究論文は、「PLOS Genetics」の2013年1月31日付オンライン版に掲載された。博士はさらに、「ミトコンドリアを原因とする代謝病がたくさんあり、いずれも固有の遺伝的痕跡を示している。これは2つに分けて考えた方がいいかも知れない」 と述べている。
5年前、Dr. Randと、2人の博士研究員、1人はブラウン大学とインディアナ大学のDr. Colin Meiklejohn、もう1人は現在インディアナ大学で准教授を務めるDr. Kristi Montoothの3人が、研
植物、動物の細胞には2つのゲノムがある。一つは細胞核に、もう一つはミトコンドリアに含まれている。それぞれゲノムで突然変異が起きた場合、互いに異なる配列の変異を呈し、それが原因で病気になる場合がある。最近、ブラウン大学とインディアナ大学の科学者チームが、その病気をさらによく知るため、ショウジョウバエを対象として、個々のヌクレオチドの逸脱やショウジョウバエが発病する機序までを研究した。単一のゲノムの突然変異による発病だけでも十分に複雑だが、細胞核のDNAとミトコンドリアのDNAという2つのゲノム同士の相互作用の逸脱で引き起こされる病気もある。
科学者は、そのようなゲノム同士の変異の違いが原因で発病する過程を調べようと考えた。そこで、ブラウン大学とインディアナ大学の科学者チームは、ショウジョウバエのゲノムが異なる配列の突然変異を引き起こす過程を個々のヌクレオチドの突然変異の水準まで追求し、二つの遺伝子の同時的な突然変異でショウジョウバエが発病する機序を突き止めた。ブラウン大学の生物学教授で、この研究論文の筆頭著者でもあるDr. David Randは、「この機序は人間の病気にもあてはまるが、この2つのゲノムはすべての動物、植物に存在するため、すべての有機体にあてはまるというべきだ」と語っている。この研究論文は、「PLOS Genetics」の2013年1月31日付オンライン版に掲載された。博士はさらに、「ミトコンドリアを原因とする代謝病がたくさんあり、いずれも固有の遺伝的痕跡を示している。これは2つに分けて考えた方がいいかも知れない」 と述べている。
5年前、Dr. Randと、2人の博士研究員、1人はブラウン大学とインディアナ大学のDr. Colin Meiklejohn、もう1人は現在インディアナ大学で准教授を務めるDr. Kristi Montoothの3人が、研
がん細胞の成長を止める機序が明らかに、がん治療に道開くか
 University of Pittsburgh Cancer Institute (UPCI, ピッツバーグ大学がん研究所) の研究チームはがん細胞の成長を止める方法を発見した。この発見が新しい抗がん治療法に結びつく可能性がある。ある種のがん細胞は重要なタンパクを奪われると正しく分裂できなくなるという研究報告であり、Journal of Cell Scienceの2013年2月号の巻頭記事を飾っている。この報告論文は2012年9月26日付同誌初出。
UPCIの分子薬理学Richard M. Cyert記念教授を務め、研究報告論文筆頭著者のBennett Van Houten博士は、「細胞再生という重要な段階でこのタンパクを変化させることで、がん細胞の成長を止めることができるのか、私たちがその機序を初めて説明できた。現在、私たちが望むのは、今回の発見で新しいタイプのがん治療薬の開発が促進され、既存の医薬と相乗効果をもたらすようになることだ」と語っている。細胞はすべてミトコンドリアのネットワークを持っている。このミトコンドリアは細胞内にある微小な構造で細胞のエネルギー生産と新陳代謝に欠かすことができない。Dynamin-related protein 1 (Drp1) はミトコンドリアの分裂を助ける物質で、ミトコンドリアは分裂して2つの新しいミトコンドリアになる。ところが、乳がんや肺がんではDRP1の欠乏が頻繁に起こり、ひどく融け合ったミトコンドリアの巨大なネットワークが観察される。このようながん細胞は、G2/Mと呼ばれる細胞分裂の途中段階で分裂が停止したように思われる。新しく2つの細胞に分裂することができないためにがんの成長が止まったわけである。このような細胞は、分裂しようとして文字通り染色体を引き裂き、細胞のストレスをさらに高めることになる。
Journal o
University of Pittsburgh Cancer Institute (UPCI, ピッツバーグ大学がん研究所) の研究チームはがん細胞の成長を止める方法を発見した。この発見が新しい抗がん治療法に結びつく可能性がある。ある種のがん細胞は重要なタンパクを奪われると正しく分裂できなくなるという研究報告であり、Journal of Cell Scienceの2013年2月号の巻頭記事を飾っている。この報告論文は2012年9月26日付同誌初出。
UPCIの分子薬理学Richard M. Cyert記念教授を務め、研究報告論文筆頭著者のBennett Van Houten博士は、「細胞再生という重要な段階でこのタンパクを変化させることで、がん細胞の成長を止めることができるのか、私たちがその機序を初めて説明できた。現在、私たちが望むのは、今回の発見で新しいタイプのがん治療薬の開発が促進され、既存の医薬と相乗効果をもたらすようになることだ」と語っている。細胞はすべてミトコンドリアのネットワークを持っている。このミトコンドリアは細胞内にある微小な構造で細胞のエネルギー生産と新陳代謝に欠かすことができない。Dynamin-related protein 1 (Drp1) はミトコンドリアの分裂を助ける物質で、ミトコンドリアは分裂して2つの新しいミトコンドリアになる。ところが、乳がんや肺がんではDRP1の欠乏が頻繁に起こり、ひどく融け合ったミトコンドリアの巨大なネットワークが観察される。このようながん細胞は、G2/Mと呼ばれる細胞分裂の途中段階で分裂が停止したように思われる。新しく2つの細胞に分裂することができないためにがんの成長が止まったわけである。このような細胞は、分裂しようとして文字通り染色体を引き裂き、細胞のストレスをさらに高めることになる。
Journal o
キノコ毒素のアマニチンを工業規模で生産することが可能に
 タマゴテングタケ(テングタケ属)は猛毒である。 ただし、その毒素の一部は適切に使用すれば治癒に役立つこともある。たとえば、毒素のひとつであるアマニチンは抗体ベースの癌治療の必須要素だ。2019年12月17日にドイツの雑誌Angewandte Chemieにオンラインで公開された論文で、科学者たちは現在、α-アマニチンの新しい合成経路について説明している。このオープンアクセスの論文は、「デスキャップ毒素α‐アマニチンの収束的全合成(A Convergent Total Synthesis of the Death Cap Toxin α‐Amanitin.)」と題されている。
彼らの方法は大規模生産に適しているようであり、最終的にさらなる研究のための十分な毒素を利用可能にする。 アマニチンは酵素RNAポリメラーゼIIを高い選択性で阻害し、細胞死を引き起こす。 抗体によって腫瘍細胞に輸送されると、毒素は腫瘍と戦うことができる。 しかし、最近まで、アマニチンの唯一の供給源はキノコ(テングタケ)自体であり、実験の可能性を制限していた。少し前に、最も強力なアマニチンであるα-アマニチンの全合成が報告された。 ベルリン工科大学のRoderich D.Süssmuth博士と協力者は、完全に液相で発生する大規模の全合成の代替ルートを紹介した。
「我々は収束ルートを使用することにした。つまり、いくつかの成分が最初に独立して合成され、最後にまとめられて標的分子を形成することを意味する」とSüssmuth 博士は説明した。 ビルディングブロックは、5、1、および2つのアミノ酸で構成される3つのペプチドフラグメントだ。 研究者は、彼らの方法を[5+1+2"> 合成と呼んでいる。アマトキシンは、トリプタチオニンとして知られているアミノ酸トリプトファンとシステインの間に追加の内部交差環結合を
タマゴテングタケ(テングタケ属)は猛毒である。 ただし、その毒素の一部は適切に使用すれば治癒に役立つこともある。たとえば、毒素のひとつであるアマニチンは抗体ベースの癌治療の必須要素だ。2019年12月17日にドイツの雑誌Angewandte Chemieにオンラインで公開された論文で、科学者たちは現在、α-アマニチンの新しい合成経路について説明している。このオープンアクセスの論文は、「デスキャップ毒素α‐アマニチンの収束的全合成(A Convergent Total Synthesis of the Death Cap Toxin α‐Amanitin.)」と題されている。
彼らの方法は大規模生産に適しているようであり、最終的にさらなる研究のための十分な毒素を利用可能にする。 アマニチンは酵素RNAポリメラーゼIIを高い選択性で阻害し、細胞死を引き起こす。 抗体によって腫瘍細胞に輸送されると、毒素は腫瘍と戦うことができる。 しかし、最近まで、アマニチンの唯一の供給源はキノコ(テングタケ)自体であり、実験の可能性を制限していた。少し前に、最も強力なアマニチンであるα-アマニチンの全合成が報告された。 ベルリン工科大学のRoderich D.Süssmuth博士と協力者は、完全に液相で発生する大規模の全合成の代替ルートを紹介した。
「我々は収束ルートを使用することにした。つまり、いくつかの成分が最初に独立して合成され、最後にまとめられて標的分子を形成することを意味する」とSüssmuth 博士は説明した。 ビルディングブロックは、5、1、および2つのアミノ酸で構成される3つのペプチドフラグメントだ。 研究者は、彼らの方法を[5+1+2"> 合成と呼んでいる。アマトキシンは、トリプタチオニンとして知られているアミノ酸トリプトファンとシステインの間に追加の内部交差環結合を
天然物フィセチンが健康寿命を伸ばすことをマスサイトメトリー(CyTOF)を用い解明。
 今年初めNature Medicineに発表されたミネソタ大学医学部教授のPaul D. Robbins博士とLaura J. Niedernhofer博士、メイヨー・クリニックの研究者James L. Kirkland博士とTamara Tchkonia博士の研究成果は、老化細胞と呼ばれる損傷細胞の負担を軽減し、生涯末期に治療が開始されても寿命を延ばし、健康を改善することが可能であることを示した。彼らは現在、多くの果物や野菜に見られる天然産物のフィセチン(fisetin)による高齢マウスの治療も、健康と寿命に有意な正の効果を有することを示している。
人々は年をとるにつれて、損傷した細胞を蓄積する。 細胞が一定レベルの損傷を受けると、細胞老化と呼ばれる老化過程を経る。細胞はまた、免疫系にそれらの損傷した細胞を除去するように指示する炎症因子を放出する。若い人の免疫系は健康で、損傷した細胞を除去することができる。しかし、人が老化するにつれて、これらの損傷した細胞は効果的に消失しない。 したがって、それらは蓄積し始め、低レベルの炎症を引き起こし、組織を分解する酵素を放出する。Robbins博士らと仲間の研究者らは、フィセチンと呼ばれる天然産物が体内のこれらの損傷細胞のレベルを低下させることを発見した。 彼らは、この化合物でマウスを終末に向けて治療し、健康と寿命の改善を見出した。このオープンアクセスの論文「フィセチンは健康と寿命を延ばす細胞老化療法である(Fisetin Is a Senotherapeutic That Extends Health and Lifespan)」は、2018年9月29日にEBioMedicineに掲載された。
「これらの結果は、健康な期間を終わりに向かって延長することができることを示唆している。しかし、適切な投与量を含めて、まだ対処すべき
今年初めNature Medicineに発表されたミネソタ大学医学部教授のPaul D. Robbins博士とLaura J. Niedernhofer博士、メイヨー・クリニックの研究者James L. Kirkland博士とTamara Tchkonia博士の研究成果は、老化細胞と呼ばれる損傷細胞の負担を軽減し、生涯末期に治療が開始されても寿命を延ばし、健康を改善することが可能であることを示した。彼らは現在、多くの果物や野菜に見られる天然産物のフィセチン(fisetin)による高齢マウスの治療も、健康と寿命に有意な正の効果を有することを示している。
人々は年をとるにつれて、損傷した細胞を蓄積する。 細胞が一定レベルの損傷を受けると、細胞老化と呼ばれる老化過程を経る。細胞はまた、免疫系にそれらの損傷した細胞を除去するように指示する炎症因子を放出する。若い人の免疫系は健康で、損傷した細胞を除去することができる。しかし、人が老化するにつれて、これらの損傷した細胞は効果的に消失しない。 したがって、それらは蓄積し始め、低レベルの炎症を引き起こし、組織を分解する酵素を放出する。Robbins博士らと仲間の研究者らは、フィセチンと呼ばれる天然産物が体内のこれらの損傷細胞のレベルを低下させることを発見した。 彼らは、この化合物でマウスを終末に向けて治療し、健康と寿命の改善を見出した。このオープンアクセスの論文「フィセチンは健康と寿命を延ばす細胞老化療法である(Fisetin Is a Senotherapeutic That Extends Health and Lifespan)」は、2018年9月29日にEBioMedicineに掲載された。
「これらの結果は、健康な期間を終わりに向かって延長することができることを示唆している。しかし、適切な投与量を含めて、まだ対処すべき
CytoDyn社、COVID-19薬のレロンリマブについて更新。 初期の結果は、Gilead社のレムデシビルに対する明確な優位性を示唆。(プレゼン全容)
 レロンリマブ要約:- COVID-19 の三拍子揃った薬-レロンリマブはサイトカインストームを静め、免疫学的ホメオスタシスを回復し、ウイルス量を減らす-Gileadの抗ウイルス薬レムデシビルとGenetechの抗IL-6 アクテムラは、「非常に複雑な発病への断片的アプローチ」と呼ばれている-腎不全、肝不全、および凝固の問題を含む、関連するすべての併存疾患を含む、COVID-19感染のすべての側面に広く一般的に適用できる-レロンリマブの幅広いアプローチは、PDL-1および癌におけるチェックポイント阻害剤封鎖の幅広い非特異的アプローチと類似している-レロンリマブは、他のウイルスに対しても有効であり、また将来の新たな脅威となる可能性がある現在知られていないウイルスに対しても有効であると予測されている--RANTES(マスター免疫調節分子)がCOVID-19の病因を促進--RANTESレベルは、重症のCOVID-19患者で100倍正常--RANTESは、免疫細胞上のCCR5受容体に結合し、免疫細胞の動員(T細胞およびマクロファージ)の悪循環を開始し、サイトカインおよびより多くのRANTESの局所放出、より多くの免疫細胞の流入、より多くのサイトカインおよびより多くのRAANTESの放出などを行う-身体が炎症により大量の複数臓器システムの問題を引き起こす文字通り「炎上」は、レロンリマブによってブロックできる可能性がある-レロンリマブはケモカインのCCR5細胞表面受容体をブロックし、RANTES結合を防止する-レロンリマブは皮下注射により週2回投与される-ギリアドのレムデシビルは、1時間に4回のIV注射で毎日投与される--CytoDynの科学者は、レロンリマブは単独で非常に効果的であり、レムデシビルとの併用は不要であると主張している--CytoDynの科学者は、COVID-19ウイルスが
レロンリマブ要約:- COVID-19 の三拍子揃った薬-レロンリマブはサイトカインストームを静め、免疫学的ホメオスタシスを回復し、ウイルス量を減らす-Gileadの抗ウイルス薬レムデシビルとGenetechの抗IL-6 アクテムラは、「非常に複雑な発病への断片的アプローチ」と呼ばれている-腎不全、肝不全、および凝固の問題を含む、関連するすべての併存疾患を含む、COVID-19感染のすべての側面に広く一般的に適用できる-レロンリマブの幅広いアプローチは、PDL-1および癌におけるチェックポイント阻害剤封鎖の幅広い非特異的アプローチと類似している-レロンリマブは、他のウイルスに対しても有効であり、また将来の新たな脅威となる可能性がある現在知られていないウイルスに対しても有効であると予測されている--RANTES(マスター免疫調節分子)がCOVID-19の病因を促進--RANTESレベルは、重症のCOVID-19患者で100倍正常--RANTESは、免疫細胞上のCCR5受容体に結合し、免疫細胞の動員(T細胞およびマクロファージ)の悪循環を開始し、サイトカインおよびより多くのRANTESの局所放出、より多くの免疫細胞の流入、より多くのサイトカインおよびより多くのRAANTESの放出などを行う-身体が炎症により大量の複数臓器システムの問題を引き起こす文字通り「炎上」は、レロンリマブによってブロックできる可能性がある-レロンリマブはケモカインのCCR5細胞表面受容体をブロックし、RANTES結合を防止する-レロンリマブは皮下注射により週2回投与される-ギリアドのレムデシビルは、1時間に4回のIV注射で毎日投与される--CytoDynの科学者は、レロンリマブは単独で非常に効果的であり、レムデシビルとの併用は不要であると主張している--CytoDynの科学者は、COVID-19ウイルスが
ヒノキチオールが細胞膜を通り抜けて鉄を運搬。貧血の新治療法になるか
 貧血その他の鉄欠乏症の新しい治療法になる可能性を持った重要な化学物質が研究者によって突き止められた。Science誌掲載の新論文の共同首席著者で、Harvard Medical School、Dana Farber Cancer Institute、Brigham and Women’s Hospital、Boston Children’s Hospitalの准教授を務めるBarry Paw, MD, PhD.は、「鉄がなければ生命体も存在できない。
鉄分は血中の酸素運搬、主要代謝活動、DNA複製などに重要な役割を果たしており、その鉄分の運搬そのものも非常に重要である」と述べている。2017年5月12日付Science誌に掲載された研究論文は、University of Illinois、Dana-Farber/Boston Children's Cancer and Blood Disorders Center、Brigham and Women's Hospital、Northeastern Universityなど複数研究機関の合同研究チームによる研究成果であり、鉄欠乏性貧血から鉄過剰性肝臓障害まで様々な鉄障害に新しい治療法が開ける可能性がある。この研究チームは、ヒノキの葉に含まれるヒノキチオールという小さな天然の化学物質が動物の鉄障害を回避できることを突き止めた。このScience誌掲載論文の共同首席著者で、Dana-Farber/Boston Children'sの医師を務めるDr. Pawと彼の研究室の研究者は、ゼブラフィッシュを使った疾患モデルの鉄欠乏症と鉄過剰症の改善に成功した。この研究の成果からヒノキチオールは優れた薬効を有望視されている。この研究論文は、「Restored Iron Transport by a Small Molecule Pr
貧血その他の鉄欠乏症の新しい治療法になる可能性を持った重要な化学物質が研究者によって突き止められた。Science誌掲載の新論文の共同首席著者で、Harvard Medical School、Dana Farber Cancer Institute、Brigham and Women’s Hospital、Boston Children’s Hospitalの准教授を務めるBarry Paw, MD, PhD.は、「鉄がなければ生命体も存在できない。
鉄分は血中の酸素運搬、主要代謝活動、DNA複製などに重要な役割を果たしており、その鉄分の運搬そのものも非常に重要である」と述べている。2017年5月12日付Science誌に掲載された研究論文は、University of Illinois、Dana-Farber/Boston Children's Cancer and Blood Disorders Center、Brigham and Women's Hospital、Northeastern Universityなど複数研究機関の合同研究チームによる研究成果であり、鉄欠乏性貧血から鉄過剰性肝臓障害まで様々な鉄障害に新しい治療法が開ける可能性がある。この研究チームは、ヒノキの葉に含まれるヒノキチオールという小さな天然の化学物質が動物の鉄障害を回避できることを突き止めた。このScience誌掲載論文の共同首席著者で、Dana-Farber/Boston Children'sの医師を務めるDr. Pawと彼の研究室の研究者は、ゼブラフィッシュを使った疾患モデルの鉄欠乏症と鉄過剰症の改善に成功した。この研究の成果からヒノキチオールは優れた薬効を有望視されている。この研究論文は、「Restored Iron Transport by a Small Molecule Pr
NORADとPUMILIOタンパク質がゲノム安定性とミトコンドリア機能の維持に重要な役割を果たしていることが判明 - プロジェリアなど早期加齢疾患に関与の可能性
 テキサス大学(UT)サウスウエスタン校の研究者らは早期老化を防ぐ新しい遺伝子パスウェイを同定した。2019年2月8日にeLifeでオンライン公開されたこの研究は、ロングノンコーディングRNAをコードする遺伝子NORADの活性を調べた。この論文は「PUMILIOの多動性がノルアド欠乏マウスの早期老化を促進する(PUMILIO Hyperactivity Drives Premature Aging of Norad-Deficient Mice.)」と題されている。
「DNA損傷により活性化されるノンコーディングRNA(noncoding RNA activated by DNA damage)」を表すNORADは、多くの哺乳動物に存在し、細胞分裂時に適切な数の染色体を維持するのに役立つ。細胞内の多くのRNAは、タンパク質を構築するための指示書またはコードとして機能するが、ノンコーディングRNAはタンパク質をコードしない。「哺乳類の生理機能と開発におけるノンコーディングRNAの重要性に関して、科学界には多くの疑問がある。我々の細胞はこれらのRNAを何千も生産しているが、動物の重要な機能に関係しているのはごくわずかなものだけだ。」とUTサウスウエスタンの分子生物学教授であり、この研究の著者であるJoshua T. Mendell博士は述べた。2015年に彼らはNORADの発見を報告し、ヒト細胞の染色体の正しい数を維持する上でこのノンコーディングRNAの重要性を実証した。研究室で成長した細胞に限った彼らの以前の研究で、研究者は次に哺乳動物生理学における遺伝子の機能をよりよく理解するために生きた動物におけるNORADの役割を調べた。これを達成するために、Mendell研究室のポスドク研究者でeLife研究の筆頭著者であるFlorian Kopp博士は、マウスゲノムからNORADを
テキサス大学(UT)サウスウエスタン校の研究者らは早期老化を防ぐ新しい遺伝子パスウェイを同定した。2019年2月8日にeLifeでオンライン公開されたこの研究は、ロングノンコーディングRNAをコードする遺伝子NORADの活性を調べた。この論文は「PUMILIOの多動性がノルアド欠乏マウスの早期老化を促進する(PUMILIO Hyperactivity Drives Premature Aging of Norad-Deficient Mice.)」と題されている。
「DNA損傷により活性化されるノンコーディングRNA(noncoding RNA activated by DNA damage)」を表すNORADは、多くの哺乳動物に存在し、細胞分裂時に適切な数の染色体を維持するのに役立つ。細胞内の多くのRNAは、タンパク質を構築するための指示書またはコードとして機能するが、ノンコーディングRNAはタンパク質をコードしない。「哺乳類の生理機能と開発におけるノンコーディングRNAの重要性に関して、科学界には多くの疑問がある。我々の細胞はこれらのRNAを何千も生産しているが、動物の重要な機能に関係しているのはごくわずかなものだけだ。」とUTサウスウエスタンの分子生物学教授であり、この研究の著者であるJoshua T. Mendell博士は述べた。2015年に彼らはNORADの発見を報告し、ヒト細胞の染色体の正しい数を維持する上でこのノンコーディングRNAの重要性を実証した。研究室で成長した細胞に限った彼らの以前の研究で、研究者は次に哺乳動物生理学における遺伝子の機能をよりよく理解するために生きた動物におけるNORADの役割を調べた。これを達成するために、Mendell研究室のポスドク研究者でeLife研究の筆頭著者であるFlorian Kopp博士は、マウスゲノムからNORADを
超長テロメアを持つマウスは、代謝老化が少なく寿命が長い。100%の細胞が超長テロメアであるマウスが誕生し前例のない結果に。
 10年前の偶然の発見により、スペイン国立癌研究センター(CNIO)の研究者は、その種で通常よりもはるかに長いテロメアをもつ最初のマウスを作製した。テロメアと老化(テロメアは生涯を通じて短くなるため、古い生物はテロメアが短くなる)の関係を考えて、100%の細胞が非常に長いテロメアを持つマウスを生み出す研究を開始した。この研究成果は、2019年10月17日にNature Communicationsでオンラインで公開され、より良い健康状態で癌や肥満から解放されたとの肯定的な結果のみが示されている。
著者にとって最も関連性の高い結果は、遺伝子組み換えなしで初めて寿命が大幅に延長されたことだ。 「この発見は、寿命を決定する際に、遺伝子だけが考慮されるべきではないという考えを裏付けている」と CNIOテロメアおよびテロメラーゼグループ長、スペイン国立がん研究センター所長のMaria Blasco 博士は述べている。このオープンアクセスの論文は「ハイパーロングテロメアをもつマウスは代謝の老化が少なく寿命が長い(Mice with Hyper-Long Telomeres Show Less Metabolic Aging and Longer Lifespans.)」と題されている。
テロメアは、体内の各細胞の核で染色体の末端を形成する。 それらの機能は、DNAの遺伝情報の完全性を保護することだ。 細胞が分裂するたびに、テロメアは少し短くなる。そのため、老化の主な特徴の1つは、細胞内の短いテロメアの蓄積だ。「テロメアの短縮は、短いテロメアが生物の老化を引き起こし、寿命を縮めることを考えると、老化の主な原因の1つと考えられている」とNature Communicationsで発表された論文で説明されている。CNIOテロメアおよびテロメラーゼグループは、テロメア伸長酵素であるテロ
10年前の偶然の発見により、スペイン国立癌研究センター(CNIO)の研究者は、その種で通常よりもはるかに長いテロメアをもつ最初のマウスを作製した。テロメアと老化(テロメアは生涯を通じて短くなるため、古い生物はテロメアが短くなる)の関係を考えて、100%の細胞が非常に長いテロメアを持つマウスを生み出す研究を開始した。この研究成果は、2019年10月17日にNature Communicationsでオンラインで公開され、より良い健康状態で癌や肥満から解放されたとの肯定的な結果のみが示されている。
著者にとって最も関連性の高い結果は、遺伝子組み換えなしで初めて寿命が大幅に延長されたことだ。 「この発見は、寿命を決定する際に、遺伝子だけが考慮されるべきではないという考えを裏付けている」と CNIOテロメアおよびテロメラーゼグループ長、スペイン国立がん研究センター所長のMaria Blasco 博士は述べている。このオープンアクセスの論文は「ハイパーロングテロメアをもつマウスは代謝の老化が少なく寿命が長い(Mice with Hyper-Long Telomeres Show Less Metabolic Aging and Longer Lifespans.)」と題されている。
テロメアは、体内の各細胞の核で染色体の末端を形成する。 それらの機能は、DNAの遺伝情報の完全性を保護することだ。 細胞が分裂するたびに、テロメアは少し短くなる。そのため、老化の主な特徴の1つは、細胞内の短いテロメアの蓄積だ。「テロメアの短縮は、短いテロメアが生物の老化を引き起こし、寿命を縮めることを考えると、老化の主な原因の1つと考えられている」とNature Communicationsで発表された論文で説明されている。CNIOテロメアおよびテロメラーゼグループは、テロメア伸長酵素であるテロ
自己免疫疾患発症を招く食塩の過剰摂取
食塩摂取量が増えると、自己免疫疾患の原因になる侵襲性の強い免疫細胞グループを誘発する可能性があるという研究結果が発表された。この研究を手がけたのは、Yale University、Broad Institute、MIT、 Harvard University、Vanderbilt University、ベルリンのMax-Delbruck Center for Molecular Medicine、University of Erlangen-Nurembergなどを含む数多くの研究機関から参加した国際的な科学者グループで、2013年3月6日付の「Nature」誌オンライン版に掲載された論文の著者には、Dr. Markus Kleinewietfeld、Professor David Hafler、Dr. Ralf Linker、Professor Jens Titze、Professor Dominik N. Mullerらが名を連ねている。 同日付で「Nature」誌オンライン版に掲載された第二論文では、食塩を感知する酵素が自己免疫疾患の誘発に関わっている可能性が記述されている。これも同日付で「Nature」誌オンライン版に掲載された第三論文では、ヘルパーT細胞に関わる分子経路が自己免疫疾患につながる可能性が記述されている。この3本の「Nature」の論文をあわせて、自己免疫疾患の起源についてさらに理解が深まることが考えられるが、ここでは食塩の過剰摂取の影響を述べた第一論文を中心にして紹介したい。 過去何十年かの間、研究者は欧米で自己免疫疾患発症例が着実に増えてきていることに気づいている。しかし、その着実な増加が遺伝子要因だけでは説明がつかないため、仮説として、この疾患を環境要因に結びつけて考えている。もっとも疑われている原因として、高度に加工された食品やファースト・腸内細菌と血球成長との間に感染を防ぐ免疫力ひそむ
 ヒトと微生物との関係は複雑である。どこのスーパーマーケットに行っても、抗菌性セッケンと体に良い細菌の増殖を助けるヨーグルトという相反するような商品が並んでいる。細菌には病気の原因になるものもたくさんあるが、Caltechの生物学と生体工学の教授、Dr. Sarkis Mazmanianと彼の研究チームは、人体内に棲み着いて、われわれを健康に保つ働きのある何千という種類の細菌に注目している。
Dr. Sarkis Mazmanianの過去のマウスを使った研究でも、善玉菌を増やすことで、炎症性腸疾患、多発性硬化症や自閉症でさえ症状を緩和できることが示されている。博士の研究チームは、血中の免疫細胞が悪玉菌感染と戦うために、善玉菌が役立っていることを突き止めた。
2014年3月12日付「Cell Host & Microbe」に掲載された最近の研究で、侵入者の病原菌に対して防衛前線の役目を果たす先天免疫細胞という特殊化した白血球の成長にとって善玉菌が必要不可欠であることを突き止めている。免疫細胞は血中を循環するだけでなく、脾臓や骨髄にも備蓄されている。
研究チームが、腸内細菌を持たずに生まれた無菌マウスと、正常な腸内細菌数を持っている健康なマウスのこれらの器官での免疫細胞数を調べたところ、無菌マウスでは免疫細胞独特のマクロファージ、単球、好中球などの数が健康なマウスに比べてかなり少ないことが突き止められた。また、無菌マウスは、いくつかの成熟免疫細胞に分化することのできる幹細胞に似た顆粒球や単球の前駆細胞もかなり少なかった。さらに、脾臓に備蓄されている先天免疫細胞には欠陥があり、様々な腸内細菌を持った健康なマウスに比べるとかなり数が少なかった。Dr. Mazmanian研究室の大学院生、Arya Khosraviは、「このような微生物が自分たちの棲んでいる腸内に留
ヒトと微生物との関係は複雑である。どこのスーパーマーケットに行っても、抗菌性セッケンと体に良い細菌の増殖を助けるヨーグルトという相反するような商品が並んでいる。細菌には病気の原因になるものもたくさんあるが、Caltechの生物学と生体工学の教授、Dr. Sarkis Mazmanianと彼の研究チームは、人体内に棲み着いて、われわれを健康に保つ働きのある何千という種類の細菌に注目している。
Dr. Sarkis Mazmanianの過去のマウスを使った研究でも、善玉菌を増やすことで、炎症性腸疾患、多発性硬化症や自閉症でさえ症状を緩和できることが示されている。博士の研究チームは、血中の免疫細胞が悪玉菌感染と戦うために、善玉菌が役立っていることを突き止めた。
2014年3月12日付「Cell Host & Microbe」に掲載された最近の研究で、侵入者の病原菌に対して防衛前線の役目を果たす先天免疫細胞という特殊化した白血球の成長にとって善玉菌が必要不可欠であることを突き止めている。免疫細胞は血中を循環するだけでなく、脾臓や骨髄にも備蓄されている。
研究チームが、腸内細菌を持たずに生まれた無菌マウスと、正常な腸内細菌数を持っている健康なマウスのこれらの器官での免疫細胞数を調べたところ、無菌マウスでは免疫細胞独特のマクロファージ、単球、好中球などの数が健康なマウスに比べてかなり少ないことが突き止められた。また、無菌マウスは、いくつかの成熟免疫細胞に分化することのできる幹細胞に似た顆粒球や単球の前駆細胞もかなり少なかった。さらに、脾臓に備蓄されている先天免疫細胞には欠陥があり、様々な腸内細菌を持った健康なマウスに比べるとかなり数が少なかった。Dr. Mazmanian研究室の大学院生、Arya Khosraviは、「このような微生物が自分たちの棲んでいる腸内に留
膵臓がんが肝臓に転移するメカニズムを解明
 Weill Cornell Medical Collegeの研究グループを中心とする国際的な研究チームは、膵臓がんが肝臓に転移する分子レベルの正確な過程を明らかにした。この過程こそ発生率の高い膵臓がんの死亡率を押し上げている要因である。研究チームは、「私達の研究成果によってこの過程の理解を通し、転移を遅らせることを中心とする治療法を確立し、新しいバイオマーカーを提示することで膵臓がんの早期発見に役立てることができるだろう」と述べている。
2015年5月18日付Nature Cell Biologyオンライン版に掲載されたこの研究論文は、がん細胞から放出される小さな球形のエキソソーム (画像) と呼ばれる梱包の役割に焦点を当てている。エキソソームはがん由来のタンパク質を含んでおり、肝臓の微小環境を膵臓がん転移に適した条件に変えることができるのである。American Cancer Societyの推定によると、アメリカ合衆国では年間49,000人近い人が膵臓がんと診断され、そのうち40,000人以上がこの病気で亡くなっている。膵臓がんはがんの中でももっとも死亡率の高い病気で、がん宣告から5年生存率はわずか6%、メディアンの生存率はわずか6か月にとどまる。
Nature Cell Biology掲載の論文は、「Pancreatic Cancer Exosomes Initiate Pre-Metastatic Niche Formation in the Liver」と題されており、論文の首席著者で、Weill Cornell Medical College, Department of PediatricsのStavros S. Niarchos Professor in Pediatric CardiologyとProfessor of Pediatricsを務め
Weill Cornell Medical Collegeの研究グループを中心とする国際的な研究チームは、膵臓がんが肝臓に転移する分子レベルの正確な過程を明らかにした。この過程こそ発生率の高い膵臓がんの死亡率を押し上げている要因である。研究チームは、「私達の研究成果によってこの過程の理解を通し、転移を遅らせることを中心とする治療法を確立し、新しいバイオマーカーを提示することで膵臓がんの早期発見に役立てることができるだろう」と述べている。
2015年5月18日付Nature Cell Biologyオンライン版に掲載されたこの研究論文は、がん細胞から放出される小さな球形のエキソソーム (画像) と呼ばれる梱包の役割に焦点を当てている。エキソソームはがん由来のタンパク質を含んでおり、肝臓の微小環境を膵臓がん転移に適した条件に変えることができるのである。American Cancer Societyの推定によると、アメリカ合衆国では年間49,000人近い人が膵臓がんと診断され、そのうち40,000人以上がこの病気で亡くなっている。膵臓がんはがんの中でももっとも死亡率の高い病気で、がん宣告から5年生存率はわずか6%、メディアンの生存率はわずか6か月にとどまる。
Nature Cell Biology掲載の論文は、「Pancreatic Cancer Exosomes Initiate Pre-Metastatic Niche Formation in the Liver」と題されており、論文の首席著者で、Weill Cornell Medical College, Department of PediatricsのStavros S. Niarchos Professor in Pediatric CardiologyとProfessor of Pediatricsを務め
第5回国際細胞外小胞学会 (ISEV 2016) 年次総会レポート3
 ロッテルダムで開かれていた第5回国際細胞外小胞学会 (ISEV 2016) 年次総会金曜日全体会議では、著名な免疫学者で細胞生物学者のFrancisco Sanchez-Madrid, PhDが、「Immune Cell-Cell Communication: Mechanisms of MicroRNA and Protein Sorting into Exosomes (免疫細胞間情報伝達: microRNAやタンパク質がエキソソームに入り込むメカニズム)」のタイトルで講演した。
Dr. Sanchez-Madridは、Universidad Autonoma de Madridの教授であり、マドリッドのLa Princesa Hospital, Immunology Departmentの長も務めている。ひな段会議室をぎっしりうめた800余人の参加者を前に、博士の講演は2つの主題を中心にして行われた。一つは、免疫シナプスを通してエキソソームによって行われる遺伝子とミトコンドリアの構成物質の輸送(免疫シナプスとは、抗原提示細胞または標的細胞と、エフェクターT細胞またはナチュラル・キラー細胞などのリンパ球との接点のインターフェース。また、免疫シナプスは、免疫細胞間の情報伝達のために、その接触面に一時的に構成される膜とも定義される)。もう一つは、miRNAやタンパク質がエキソソームに収まるメカニズムについてだった。
博士は、まず免疫シナプスにおいて、miRNAを含んだエキソソームが活性T細胞から一方通行で放出されることについて語り、ついで、このエキソソームにはmtDNA結合タンパク質も含まれている証拠を提示した。事実、次世代シーケンシングにより、エキソソームの中にはミトコンドリア・ゲノム全体を含んでいるものもあることが示されている。さらに博士は、mtDNAが受容細胞のシ
ロッテルダムで開かれていた第5回国際細胞外小胞学会 (ISEV 2016) 年次総会金曜日全体会議では、著名な免疫学者で細胞生物学者のFrancisco Sanchez-Madrid, PhDが、「Immune Cell-Cell Communication: Mechanisms of MicroRNA and Protein Sorting into Exosomes (免疫細胞間情報伝達: microRNAやタンパク質がエキソソームに入り込むメカニズム)」のタイトルで講演した。
Dr. Sanchez-Madridは、Universidad Autonoma de Madridの教授であり、マドリッドのLa Princesa Hospital, Immunology Departmentの長も務めている。ひな段会議室をぎっしりうめた800余人の参加者を前に、博士の講演は2つの主題を中心にして行われた。一つは、免疫シナプスを通してエキソソームによって行われる遺伝子とミトコンドリアの構成物質の輸送(免疫シナプスとは、抗原提示細胞または標的細胞と、エフェクターT細胞またはナチュラル・キラー細胞などのリンパ球との接点のインターフェース。また、免疫シナプスは、免疫細胞間の情報伝達のために、その接触面に一時的に構成される膜とも定義される)。もう一つは、miRNAやタンパク質がエキソソームに収まるメカニズムについてだった。
博士は、まず免疫シナプスにおいて、miRNAを含んだエキソソームが活性T細胞から一方通行で放出されることについて語り、ついで、このエキソソームにはmtDNA結合タンパク質も含まれている証拠を提示した。事実、次世代シーケンシングにより、エキソソームの中にはミトコンドリア・ゲノム全体を含んでいるものもあることが示されている。さらに博士は、mtDNAが受容細胞のシ
第5回国際細胞外小胞学会 (ISEV 2016) 年次総会レポート4
 オランダのロッテルダムで2016年5月4日から7日までの4日間開催された国際細胞外小胞学会総会 (ISEV 2016) の最終日土曜日は半日の閉会会議で、興味深い新しい研究や4日間の会期中に発表されたいくつかの優れた研究の授賞式などが行われた。
総会はJan Lotvall前会長が、オーストラリアのLa Trobe University, Department of Biochemistry & Geneticsの学部長を務めるAndy Hill氏 (写真) に会長職を引き渡す挨拶を行い、ISEV 2017年次総会は、カナダのトロントで開かれることを発表して閉幕した。この2つの発表に先立ち、アメリカのMedical School of Brown UniversityのOncology & Medicine教授を務めるPeter Quesenberry, MDと、同じくアメリカのVanderbilt University Medical CenterでCancer BiologyとCell and Developmental Biology教授を務めるAlise Weaver, MD, PhDが、臨床と科学研究の2つの面の総括講演を行った。この総会を成功させた、ハンガリーのEdit BuzasをリーダーとするISEV国際地域組織委員会の素晴らしい努力も絶賛された。また、口頭とポスターによる優れたプレゼンテーションにも賞が与えられた。また、ISEVが、5月中にEV(Extracellular Vesicles)に関するオンライン・コースを立ち上げるとの発表もあった。総会の最終日午前中は、「Experts Meet」小部会が、血液、母乳、尿という3種の生体液をテーマに3箇所に分かれて同時に開かれた。その後、最新の研究の口頭プレゼンテーションが3部会で同時に行われた。この3部会
オランダのロッテルダムで2016年5月4日から7日までの4日間開催された国際細胞外小胞学会総会 (ISEV 2016) の最終日土曜日は半日の閉会会議で、興味深い新しい研究や4日間の会期中に発表されたいくつかの優れた研究の授賞式などが行われた。
総会はJan Lotvall前会長が、オーストラリアのLa Trobe University, Department of Biochemistry & Geneticsの学部長を務めるAndy Hill氏 (写真) に会長職を引き渡す挨拶を行い、ISEV 2017年次総会は、カナダのトロントで開かれることを発表して閉幕した。この2つの発表に先立ち、アメリカのMedical School of Brown UniversityのOncology & Medicine教授を務めるPeter Quesenberry, MDと、同じくアメリカのVanderbilt University Medical CenterでCancer BiologyとCell and Developmental Biology教授を務めるAlise Weaver, MD, PhDが、臨床と科学研究の2つの面の総括講演を行った。この総会を成功させた、ハンガリーのEdit BuzasをリーダーとするISEV国際地域組織委員会の素晴らしい努力も絶賛された。また、口頭とポスターによる優れたプレゼンテーションにも賞が与えられた。また、ISEVが、5月中にEV(Extracellular Vesicles)に関するオンライン・コースを立ち上げるとの発表もあった。総会の最終日午前中は、「Experts Meet」小部会が、血液、母乳、尿という3種の生体液をテーマに3箇所に分かれて同時に開かれた。その後、最新の研究の口頭プレゼンテーションが3部会で同時に行われた。この3部会
胚における脳の発達は、細菌性病原体を感知し免疫細胞にシグナルを送る自然免疫の重要な調節因子であることが発見された
 ボストンのタフツ大学の生物学者が率いる研究チームは、発生中の胚にある脳が、感染を防ぐのに役立つシグナルを発生期の免疫系に提供し、細菌の挑戦を生き抜く胚の能力を大幅に改善することを発見した。 研究者たちは、脳を取り除いた状態で発達し続けるカエルの胚を使用して、脳のない胚は免疫細胞の力を傷害または感染部位に集結させることができず、胚をより迅速に感染に陥れることを発見した。対照的に、脳の存在は、細菌の脅威を克服するために損傷部位に免疫細胞を誘導するのに非常に役立つ。
この研究は、2020年2月4日に NPJ Regenerative Medicine でオンラインで公開された。 このオープンアクセスの論文は「In Vivoの脳と細菌のインターフェース:自然免疫の重要な調節因子としての発達脳(An In Vivo Brain-Bacteria Interface:The Development Brain as a Key Regulator of Innate Immunity)」と題されている。
発生中の胚では、脳と免疫系の両方が完全には形成されていない。 免疫系は、その一部として、感染にすぐに反応し、トレーニングを必要とせず、抗体を産生することのない、細胞の「生得的な」システムで主に構成されている。 それにもかかわらず、これらの細胞は、感染部位に向かって動き、反応を引き起こすように促す信号を必要とする。研究チームは、脳が発生期の免疫システムを導く信号に寄与するように見えることを発見した。 脳のないカエルの胚が大腸菌に感染したとき、胚の約16%だけが生き残ったが、脳の存在は感染から50%以上を保護した。 免疫細胞のマーカーを追跡することで、免疫細胞の組成は脳の有無にかかわらず変わらないため、効果は脳が免疫系の発達を何らかの形で妨げることによるものではないことを確認し
ボストンのタフツ大学の生物学者が率いる研究チームは、発生中の胚にある脳が、感染を防ぐのに役立つシグナルを発生期の免疫系に提供し、細菌の挑戦を生き抜く胚の能力を大幅に改善することを発見した。 研究者たちは、脳を取り除いた状態で発達し続けるカエルの胚を使用して、脳のない胚は免疫細胞の力を傷害または感染部位に集結させることができず、胚をより迅速に感染に陥れることを発見した。対照的に、脳の存在は、細菌の脅威を克服するために損傷部位に免疫細胞を誘導するのに非常に役立つ。
この研究は、2020年2月4日に NPJ Regenerative Medicine でオンラインで公開された。 このオープンアクセスの論文は「In Vivoの脳と細菌のインターフェース:自然免疫の重要な調節因子としての発達脳(An In Vivo Brain-Bacteria Interface:The Development Brain as a Key Regulator of Innate Immunity)」と題されている。
発生中の胚では、脳と免疫系の両方が完全には形成されていない。 免疫系は、その一部として、感染にすぐに反応し、トレーニングを必要とせず、抗体を産生することのない、細胞の「生得的な」システムで主に構成されている。 それにもかかわらず、これらの細胞は、感染部位に向かって動き、反応を引き起こすように促す信号を必要とする。研究チームは、脳が発生期の免疫システムを導く信号に寄与するように見えることを発見した。 脳のないカエルの胚が大腸菌に感染したとき、胚の約16%だけが生き残ったが、脳の存在は感染から50%以上を保護した。 免疫細胞のマーカーを追跡することで、免疫細胞の組成は脳の有無にかかわらず変わらないため、効果は脳が免疫系の発達を何らかの形で妨げることによるものではないことを確認し
免疫応答を抑制し疾患をコントロールするための新しいパスウェイ(lncRNA HOTAIR)が発見された。
 テキサス大学アーリントン校(UTA)の研究者らは、免疫応答を調節し、髄膜炎や敗血症などの中枢神経系の炎症性疾患を潜在的に制御する新しいパスウェイを発見した。「このプロセスを調整するためには、細菌感染に対する炎症反応がどのような調節を引き起こすかを知る必要がある。そうすることができれば、敗血症や髄膜炎、癌や筋ジストロフィーなどの今まで治療が困難だった中枢神経系の炎症性疾患をコントロールすることができる。」とUTA准教授のSubhrangsu Mandal博士は語る。
Mandal博士のチームの研究成果は、2018年10月23日にScientific Reportsにオンラインで掲載された。 このオープンアクセスの論文は、「LncRNA HOTAIRは、リポ多糖によって誘導されるサイトカインの発現およびマクロファージにおける炎症反応を調節する(LncRNA HOTAIR Regulates Lipopolysaccharide-Induced Cytokine Expression and Inflammatory Response in Macrophages.)」と題されている。研究者らは、白血球に存在するロングノンコードRNA(lncRNA)分子HOTAIRが、細菌の存在下で細胞に免疫応答を活性化するようシグナルを送る能力を有することを見出した。RNAは全ての生細胞に存在する。 その主な役割は、DNAからの指示を運ぶことだ。 「HOTAIRがシグナル伝達経路に関与していることを知ることは、それを細菌感染のバイオマーカーとして利用できることを意味している。」とMandal博士は付け加えた。 「シンプルな血液検査は、感染症をはるかに迅速に発見し、今まで治療が難しかった敗血症性ショックや髄膜炎などの急速に容態が変化する患者の治療を改善する可能性がある。」
研究者らは、UTA
テキサス大学アーリントン校(UTA)の研究者らは、免疫応答を調節し、髄膜炎や敗血症などの中枢神経系の炎症性疾患を潜在的に制御する新しいパスウェイを発見した。「このプロセスを調整するためには、細菌感染に対する炎症反応がどのような調節を引き起こすかを知る必要がある。そうすることができれば、敗血症や髄膜炎、癌や筋ジストロフィーなどの今まで治療が困難だった中枢神経系の炎症性疾患をコントロールすることができる。」とUTA准教授のSubhrangsu Mandal博士は語る。
Mandal博士のチームの研究成果は、2018年10月23日にScientific Reportsにオンラインで掲載された。 このオープンアクセスの論文は、「LncRNA HOTAIRは、リポ多糖によって誘導されるサイトカインの発現およびマクロファージにおける炎症反応を調節する(LncRNA HOTAIR Regulates Lipopolysaccharide-Induced Cytokine Expression and Inflammatory Response in Macrophages.)」と題されている。研究者らは、白血球に存在するロングノンコードRNA(lncRNA)分子HOTAIRが、細菌の存在下で細胞に免疫応答を活性化するようシグナルを送る能力を有することを見出した。RNAは全ての生細胞に存在する。 その主な役割は、DNAからの指示を運ぶことだ。 「HOTAIRがシグナル伝達経路に関与していることを知ることは、それを細菌感染のバイオマーカーとして利用できることを意味している。」とMandal博士は付け加えた。 「シンプルな血液検査は、感染症をはるかに迅速に発見し、今まで治療が難しかった敗血症性ショックや髄膜炎などの急速に容態が変化する患者の治療を改善する可能性がある。」
研究者らは、UTA
エキソソームによる膵臓がんの早期検出血液検査の見通しをPanCANの研究者が報告
 カリフォルニア大学サンディエゴ校(UCSD)の研究者チームは、膵臓がんの存在を示す手がかりを探すための血液サンプルを分析する新戦略を評価した研究を発表した。ACS Nanoに掲載されたこの論文は、「交流電気動力学チップ上のエキソソームタンパク質バイオマーカーの統合解析が患者血液中の膵臓がんの迅速な検出を可能にする(Integrated Analysis of Exosomal Protein Biomarkers on Alternating Current Electrokinetic Chips Enables Rapid Detection of Pancreatic Cancer in Patient Blood)」と題されている。
早期に膵がんと診断された患者は、長期生存の可能性が高く、手術を含む治療オプションへのアクセスが増加する。 しかし、現在のところ、膵臓がんのための標準スクリーニングプログラムまたは効果的早期検出戦略は存在しない。PanCAN(膵臓がんアクションネットワーク)のような研究者や組織では、早期に疾患を効果的に診断し、改善する方法の特定に取り組んでいる。
UCSDチームの新研究では、膵臓がんと診断された人々の血液サンプルを分析し、健常人の血液と比較した。 具体的には、血液サンプルからエキソソームと呼ばれる小さな粒子を分離した。以前、MDアンダーソンがんセンターで行われた研究プロジェクトでは、エキソソームをバイオマーカーまたは人体で何が起こっているかを示す測定可能物質としてフォーカスした。そして今年の初め、Johns Hopkinsでは血液中のタンパク質とDNAレベルを調べ、参加者のがんの存在と位置を調べる大規模な研究を発表した。UCSDの研究では、参加者の血液サンプル中に存在するエキソソームを単離し評価するため、技術的に進歩したマイクロチップ
カリフォルニア大学サンディエゴ校(UCSD)の研究者チームは、膵臓がんの存在を示す手がかりを探すための血液サンプルを分析する新戦略を評価した研究を発表した。ACS Nanoに掲載されたこの論文は、「交流電気動力学チップ上のエキソソームタンパク質バイオマーカーの統合解析が患者血液中の膵臓がんの迅速な検出を可能にする(Integrated Analysis of Exosomal Protein Biomarkers on Alternating Current Electrokinetic Chips Enables Rapid Detection of Pancreatic Cancer in Patient Blood)」と題されている。
早期に膵がんと診断された患者は、長期生存の可能性が高く、手術を含む治療オプションへのアクセスが増加する。 しかし、現在のところ、膵臓がんのための標準スクリーニングプログラムまたは効果的早期検出戦略は存在しない。PanCAN(膵臓がんアクションネットワーク)のような研究者や組織では、早期に疾患を効果的に診断し、改善する方法の特定に取り組んでいる。
UCSDチームの新研究では、膵臓がんと診断された人々の血液サンプルを分析し、健常人の血液と比較した。 具体的には、血液サンプルからエキソソームと呼ばれる小さな粒子を分離した。以前、MDアンダーソンがんセンターで行われた研究プロジェクトでは、エキソソームをバイオマーカーまたは人体で何が起こっているかを示す測定可能物質としてフォーカスした。そして今年の初め、Johns Hopkinsでは血液中のタンパク質とDNAレベルを調べ、参加者のがんの存在と位置を調べる大規模な研究を発表した。UCSDの研究では、参加者の血液サンプル中に存在するエキソソームを単離し評価するため、技術的に進歩したマイクロチップ
シンプルで安価な血液検査で発症前のアルツハイマー病を検出
 現在、アルツハイマー病の治療法は無く、効果的な介入には遅すぎる段階でしか診断することができないという現実が薬物研究を妨げているとしばしば論じられている。アルツハイマー病は、患者が記憶喪失のような典型的な症状を示すよりもずっと前から始まると考えられている。 アルツハイマー病の患者に最初の症状が現れるずっと前に病気の早期指標を検出できる血液検査が開発された。
この血液検査は危険にさらされている患者を特定する機会を提供し、それによって創薬における新たな道への扉を開くかもしれない。この研究は、2018年4月6日にEMBO分子医学でオンラインで公開された。 オープンアクセスの記事は、「アミロイド血液バイオマーカーがアルツハイマー病を検出する(Amyloid Blood Biomarker Detects Alzheimer's Disease.)」と題されている。 アルツハイマー病の特徴の1つは、患者の脳内のアミロイドβプラークの蓄積である。 ドイツのRuhr University BochumのDr. Klaus Gerwert博士と彼のチームが開発した血液検査は、血液中の病的状態と健康な形態のアミロイドβの相対量を測定することによって判定するものである。病理学的形態は、この分子のミスホールドのバージョンであり、脳内に有毒なプラークの形成を開始することが知られている。 毒性アミロイドβ分子は、疾患発症の15〜20年前に患者の体内に蓄積し始める。 現在の研究でGerwert博士らは、病気の初期段階で血液検査が病理学的アミロイドβの適応症を見つけることができるかどうかを検討した。研究者らは、Oskar Hanson博士が実施したスウェーデンのBioFINDERコホートから、病気の早期、いわゆる「前駆」段階にある患者に最初に焦点を合わせた。 彼らは、軽度の認知障害を有する参加者の
現在、アルツハイマー病の治療法は無く、効果的な介入には遅すぎる段階でしか診断することができないという現実が薬物研究を妨げているとしばしば論じられている。アルツハイマー病は、患者が記憶喪失のような典型的な症状を示すよりもずっと前から始まると考えられている。 アルツハイマー病の患者に最初の症状が現れるずっと前に病気の早期指標を検出できる血液検査が開発された。
この血液検査は危険にさらされている患者を特定する機会を提供し、それによって創薬における新たな道への扉を開くかもしれない。この研究は、2018年4月6日にEMBO分子医学でオンラインで公開された。 オープンアクセスの記事は、「アミロイド血液バイオマーカーがアルツハイマー病を検出する(Amyloid Blood Biomarker Detects Alzheimer's Disease.)」と題されている。 アルツハイマー病の特徴の1つは、患者の脳内のアミロイドβプラークの蓄積である。 ドイツのRuhr University BochumのDr. Klaus Gerwert博士と彼のチームが開発した血液検査は、血液中の病的状態と健康な形態のアミロイドβの相対量を測定することによって判定するものである。病理学的形態は、この分子のミスホールドのバージョンであり、脳内に有毒なプラークの形成を開始することが知られている。 毒性アミロイドβ分子は、疾患発症の15〜20年前に患者の体内に蓄積し始める。 現在の研究でGerwert博士らは、病気の初期段階で血液検査が病理学的アミロイドβの適応症を見つけることができるかどうかを検討した。研究者らは、Oskar Hanson博士が実施したスウェーデンのBioFINDERコホートから、病気の早期、いわゆる「前駆」段階にある患者に最初に焦点を合わせた。 彼らは、軽度の認知障害を有する参加者の
エキソソームに似たより微小で機能の異なるナノ粒子「Exomeres」の同定が最先端技術で可能に
 Weill Cornell Medicineの科学者が発見した新しい細胞メッセンジャーは、がん細胞が体内の細胞間送達をどのように行うのかを明らかにするのに役立つかもしれない。 2018年2月19日にNature Cell Biologyに掲載された論文では、非対称フローフィールドフロー分画(asymmetric flow field-flow fractionation : AF4)という最先端の技術が、がん細胞が分泌するDNA、RNA、脂肪、およびタンパク質を含むエキソソームを効率よく分画できることを示している。
この技術により、研究者は2つの別個のエキソソームサブタイプを分離し、「エクソメア(Exomeres)」と名付けた新しいナノ粒子を発見することができた。この論文は「非対称フローフィールドフロー分画による細胞外小胞のサブセットと識別のためのナノパーティクルの同定(Identification of Distinct Nanoparticles and Subsets of Extracellular Vesicles by Asymmetric Flow Field-Flow Fractionation.)」と題されている。また、2018年2月19日にはナノ粒子を識別するためのプロトコルをオンラインで公開した。「エクソメアが癌細胞によって分泌される最も優勢な粒子であることを発見した。」とシニア著者のDavid Lyden博士、Stavros S. Niarchos小児心臓学教授、Sandra and Edward Meyer Cancer Centerの科学者は語った。 「それらはより小さく、構造的にも機能的にもエキソソームとは異なる。 エクソメアは主に、骨髄や肝臓の細胞と融合し、薬物の免疫機能や代謝を変えることができる。後者の発見は、多くのがん患者が少量の
Weill Cornell Medicineの科学者が発見した新しい細胞メッセンジャーは、がん細胞が体内の細胞間送達をどのように行うのかを明らかにするのに役立つかもしれない。 2018年2月19日にNature Cell Biologyに掲載された論文では、非対称フローフィールドフロー分画(asymmetric flow field-flow fractionation : AF4)という最先端の技術が、がん細胞が分泌するDNA、RNA、脂肪、およびタンパク質を含むエキソソームを効率よく分画できることを示している。
この技術により、研究者は2つの別個のエキソソームサブタイプを分離し、「エクソメア(Exomeres)」と名付けた新しいナノ粒子を発見することができた。この論文は「非対称フローフィールドフロー分画による細胞外小胞のサブセットと識別のためのナノパーティクルの同定(Identification of Distinct Nanoparticles and Subsets of Extracellular Vesicles by Asymmetric Flow Field-Flow Fractionation.)」と題されている。また、2018年2月19日にはナノ粒子を識別するためのプロトコルをオンラインで公開した。「エクソメアが癌細胞によって分泌される最も優勢な粒子であることを発見した。」とシニア著者のDavid Lyden博士、Stavros S. Niarchos小児心臓学教授、Sandra and Edward Meyer Cancer Centerの科学者は語った。 「それらはより小さく、構造的にも機能的にもエキソソームとは異なる。 エクソメアは主に、骨髄や肝臓の細胞と融合し、薬物の免疫機能や代謝を変えることができる。後者の発見は、多くのがん患者が少量の
リキッドバイオプシーと機械学習を用いた新血液検査法で膵がんなど8種類のがんを患部を含めて検出識別
 Johns Hopkins Kimmel Cancer Centerの研究チームが、ただ1回の血液検査で8種の一般的ながん種を検出し、がんの部位も判定できる方法を開発した。このCancerSEEKと呼ばれる検査法はユニークな非観血性の多検体検査法であり、8種のがんタンパク質のレベルを同時に測定し、血中循環DNAのがん遺伝子変異を検出することができる。この検査法は、アメリカでがん死の60%以上を占めるもっとも一般的ながん8種を検出することを目的としている。
この8種のうち、5種はこれまでスクリーニング検査法がなかったものである。この論文の首席著者で、腫瘍学と病理学の教授を務めるNickolas Papadopoulos, PhDは、「がんの早期発見に特定のバイオマーカーの組み合わせを用いる方法はがんスクリーニング検査法を大きく変える可能性があり、もともとはがんの治療に複数の薬剤の組み合わせを用いるのと同じ原理だ」と述べている。この論文は、2018年1月18日付Scienceオンライン版に掲載された。論文は、「Detection and Localization of Surgically Resectable Cancers with a Multi-Analyte Blood Test (多検体血液検査による外科的切除可能ながんの発見と部位判定)」と題されている。
この論文の第一著者で、Johns Hopkins University School of MedicineのMD, PhD課程に所属するJoshua Cohenは、「この固有の特異性を利用するため、大量のがん中の突然変異を少なくとも一つは検出できる小さくしかも強力なパネルの開発を考えた。事実、擬陽性判定を防ぎ、スクリーニング検査を安価にするためには突然変異パネルを小さくすることが求められる」と述べてい
Johns Hopkins Kimmel Cancer Centerの研究チームが、ただ1回の血液検査で8種の一般的ながん種を検出し、がんの部位も判定できる方法を開発した。このCancerSEEKと呼ばれる検査法はユニークな非観血性の多検体検査法であり、8種のがんタンパク質のレベルを同時に測定し、血中循環DNAのがん遺伝子変異を検出することができる。この検査法は、アメリカでがん死の60%以上を占めるもっとも一般的ながん8種を検出することを目的としている。
この8種のうち、5種はこれまでスクリーニング検査法がなかったものである。この論文の首席著者で、腫瘍学と病理学の教授を務めるNickolas Papadopoulos, PhDは、「がんの早期発見に特定のバイオマーカーの組み合わせを用いる方法はがんスクリーニング検査法を大きく変える可能性があり、もともとはがんの治療に複数の薬剤の組み合わせを用いるのと同じ原理だ」と述べている。この論文は、2018年1月18日付Scienceオンライン版に掲載された。論文は、「Detection and Localization of Surgically Resectable Cancers with a Multi-Analyte Blood Test (多検体血液検査による外科的切除可能ながんの発見と部位判定)」と題されている。
この論文の第一著者で、Johns Hopkins University School of MedicineのMD, PhD課程に所属するJoshua Cohenは、「この固有の特異性を利用するため、大量のがん中の突然変異を少なくとも一つは検出できる小さくしかも強力なパネルの開発を考えた。事実、擬陽性判定を防ぎ、スクリーニング検査を安価にするためには突然変異パネルを小さくすることが求められる」と述べてい
パーキンソン病の匂いを嗅ぎ分ける女性が質量分析を用いた揮発性バイオマーカーの研究に協力
 パーキンソン病(Parkinson's disease)は、進行性の脳細胞死および運動機能の広範な喪失をもたらす神経変性疾患である。 この疾患に関して多くの研究が行われているにもかかわらず、現在利用可能な決定的診断試験法は無い。マンチェスター大学(英国)の研究者らは、パーキンソン病を匂いで感じ取ることができる女性の助けを借り、この疾患の特徴的な臭いを構成する化合物の同定について報告した。
2019年3月20日に、American Chemical Societyから出版されたACS Central Scienceでこの発見は報告された。 このオープンアクセスの論文は「皮脂からパーキンソン病の揮発性バイオマーカーの発見(Discovery of Volatile Biomarkers of Parkinson’s Disease from Sebum.)」と題されている。ヒポクラテス、ガレヌス、そしてアビチェンナなど古代の医師らは、診断ツールとして匂いを使った。嗅覚検査は現代医学では一般的ではないが、糖尿病のような病気はしばしば特定の匂いに関連している。 しかし、匂いと神経変性疾患とを結び付ける証拠はほとんど無かった。超人的な嗅覚を持つ女性、Joy Milneさん(写真)は、1986年に亡き夫のLesがパーキンソン病と診断された。彼女は非常に敏感な嗅覚を持っており、普通の嗅覚能力では検出されない匂いを検出して、区別することが可能だ。Milneさんは臨床症状が現れるよりずっと前にパーキンソン病の独特の皮脂の臭いを区別することができる。そこで、マンチェスター大学のマンチェスターバイオテクノロジー大学院マススペクトロメトリー教授のPerdita Barran博士は、Milneさん協力の元、どの化学物質がパーキンソン病患者の皮脂の匂いを構成しているのかを判断したいと考えた。
皮脂
パーキンソン病(Parkinson's disease)は、進行性の脳細胞死および運動機能の広範な喪失をもたらす神経変性疾患である。 この疾患に関して多くの研究が行われているにもかかわらず、現在利用可能な決定的診断試験法は無い。マンチェスター大学(英国)の研究者らは、パーキンソン病を匂いで感じ取ることができる女性の助けを借り、この疾患の特徴的な臭いを構成する化合物の同定について報告した。
2019年3月20日に、American Chemical Societyから出版されたACS Central Scienceでこの発見は報告された。 このオープンアクセスの論文は「皮脂からパーキンソン病の揮発性バイオマーカーの発見(Discovery of Volatile Biomarkers of Parkinson’s Disease from Sebum.)」と題されている。ヒポクラテス、ガレヌス、そしてアビチェンナなど古代の医師らは、診断ツールとして匂いを使った。嗅覚検査は現代医学では一般的ではないが、糖尿病のような病気はしばしば特定の匂いに関連している。 しかし、匂いと神経変性疾患とを結び付ける証拠はほとんど無かった。超人的な嗅覚を持つ女性、Joy Milneさん(写真)は、1986年に亡き夫のLesがパーキンソン病と診断された。彼女は非常に敏感な嗅覚を持っており、普通の嗅覚能力では検出されない匂いを検出して、区別することが可能だ。Milneさんは臨床症状が現れるよりずっと前にパーキンソン病の独特の皮脂の臭いを区別することができる。そこで、マンチェスター大学のマンチェスターバイオテクノロジー大学院マススペクトロメトリー教授のPerdita Barran博士は、Milneさん協力の元、どの化学物質がパーキンソン病患者の皮脂の匂いを構成しているのかを判断したいと考えた。
皮脂
運動が脳力を高めることを、認知神経科学の新研究が示唆
 マラソンの練習をしている人なら誰でも、個々のランニングトレーニングが時間の経過とともに体力の大幅な向上をもたらすことを知っているのでトレーニングが認知機能に効果があると聞いても驚くことはないだろう。しかし、これまでのところ、その根底にある神経生物学を説明し支持するための研究はほとんどなされていなかった。
2019年3月23日から26日にサンフランシスコで開催されCognitive Neuroscience Society(CNS)で、運動が脳に及ぼす影響について、1回のトレーニングの後に起こる脳の変化は、長期にわたる継続的な身体トレーニングで起こることを予測できることが報告された。CNSでこのトピックに関するシンポジウムを主催したニューヨーク大学(NYU)の神経科学教授であるWendy Suzuki博士 は、「身体活動とあなたの脳がどのように機能するかには強い直接的な関係がある。」と語った。この論文は「ヒトにおける運動の即時的および長期的な影響のイメージング」と題されている。1500人以上の科学者がCNS年次総会に参加し、このシンポジウムでは、Michelle Voss博士とMichelle Carlson博士、そしてMichael Yassa博士とEmrah Duzel博士が講演を行った。「人々はまだ身体的健康を脳や認知的健康に結びつけていない。彼らは痩せることに関心が向いている。」しかし、さまざまなタイプ、量、強度の身体活動が脳機能をどのように改善するかを明らかにする新研究が出てくるにつれて、認知神経科学者は、社会経済的に恵まれない地域社会において、身体活動のプラスの影響についての一般世論に大きな変化をもたらすことを期待している。2回目のシンポジウムで話題になった新研究では、「通常、短期的および長期的の影響は異なる研究で検討されているため、エクササイズミラーによる即時
マラソンの練習をしている人なら誰でも、個々のランニングトレーニングが時間の経過とともに体力の大幅な向上をもたらすことを知っているのでトレーニングが認知機能に効果があると聞いても驚くことはないだろう。しかし、これまでのところ、その根底にある神経生物学を説明し支持するための研究はほとんどなされていなかった。
2019年3月23日から26日にサンフランシスコで開催されCognitive Neuroscience Society(CNS)で、運動が脳に及ぼす影響について、1回のトレーニングの後に起こる脳の変化は、長期にわたる継続的な身体トレーニングで起こることを予測できることが報告された。CNSでこのトピックに関するシンポジウムを主催したニューヨーク大学(NYU)の神経科学教授であるWendy Suzuki博士 は、「身体活動とあなたの脳がどのように機能するかには強い直接的な関係がある。」と語った。この論文は「ヒトにおける運動の即時的および長期的な影響のイメージング」と題されている。1500人以上の科学者がCNS年次総会に参加し、このシンポジウムでは、Michelle Voss博士とMichelle Carlson博士、そしてMichael Yassa博士とEmrah Duzel博士が講演を行った。「人々はまだ身体的健康を脳や認知的健康に結びつけていない。彼らは痩せることに関心が向いている。」しかし、さまざまなタイプ、量、強度の身体活動が脳機能をどのように改善するかを明らかにする新研究が出てくるにつれて、認知神経科学者は、社会経済的に恵まれない地域社会において、身体活動のプラスの影響についての一般世論に大きな変化をもたらすことを期待している。2回目のシンポジウムで話題になった新研究では、「通常、短期的および長期的の影響は異なる研究で検討されているため、エクササイズミラーによる即時
移植幹細胞由来エクソソームは心臓発作からの回復を助ける。移植細胞からの循環エキソソーム解析(液体生検)は医師が回復の程度を把握することを可能にする。
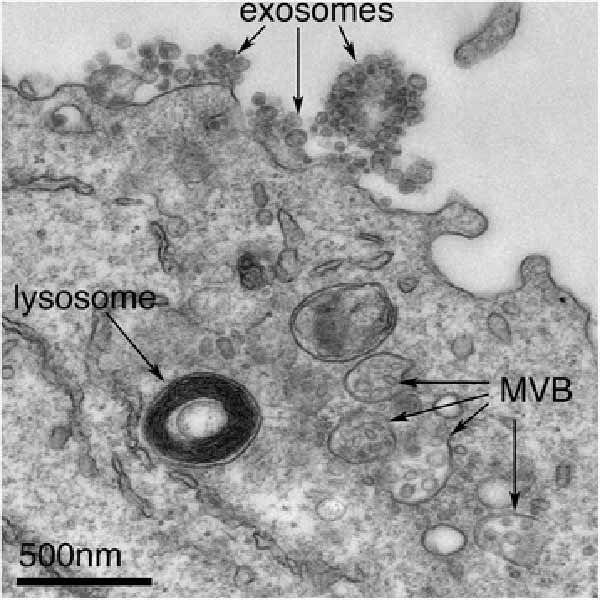 心筋の強化や他の疾患を治療する幹細胞療法は、ヒト臨床試験で有望視され始めている。 しかし、臨床成果の観察以外に、標的臓器内の移植細胞の有効性を評価するうえで再現性の欠如や使用期限、非侵襲的なツールの欠如は、幹細胞分野の進歩を遅らせてきた。
メリーランド大学医学部(UMSOM)、ペンシルバニア大学、およびエモリー大学の研究者らは、移植された幹細胞の有効性を追跡するのに血液検査が使用できると理論づけた。 彼らは、移植幹細胞からレシピエントの血液に分泌される エクソソーム と呼ばれる微小な細胞成分を分析した。 研究者らは、2種類のヒト心臓幹細胞を移植し、循環するエクソソームをモニターした後、げっ歯類の心臓発作モデルまたは心筋梗塞モデルで自らの理論を検証した。この研究者らは、循環するエクソソームが細胞成分を標的の心筋細胞に送達し、心臓の修復をもたらすことを発見した。 彼らの研究成果は、2019年5月22日にScience Translational Medicineにオンラインで発表された。 この論文は「移植された前駆細胞由来の循環エクソソームが虚血性心筋の機能回復を助ける(Circulating Exosomes Derived from Transplanted Progenitor Cells Aid the Functional Recovery of Ischemic Myocardium.)」と題されている。
「エクソソームには由来する細胞のシグナルを含んでいる - タンパク質、核酸やマイクロリボ核酸(miRNA) - 受容体細胞に影響を及ぼし、我々が標的としている臓器を改変または再生する。」と共著者であるUMSOMの外科教授およびメリーランド大学小児病院の小児心臓外科のディレクターであるSunjay Kaushal博士は述べた。「我々は現在、心臓だけでなく、他の臓
心筋の強化や他の疾患を治療する幹細胞療法は、ヒト臨床試験で有望視され始めている。 しかし、臨床成果の観察以外に、標的臓器内の移植細胞の有効性を評価するうえで再現性の欠如や使用期限、非侵襲的なツールの欠如は、幹細胞分野の進歩を遅らせてきた。
メリーランド大学医学部(UMSOM)、ペンシルバニア大学、およびエモリー大学の研究者らは、移植された幹細胞の有効性を追跡するのに血液検査が使用できると理論づけた。 彼らは、移植幹細胞からレシピエントの血液に分泌される エクソソーム と呼ばれる微小な細胞成分を分析した。 研究者らは、2種類のヒト心臓幹細胞を移植し、循環するエクソソームをモニターした後、げっ歯類の心臓発作モデルまたは心筋梗塞モデルで自らの理論を検証した。この研究者らは、循環するエクソソームが細胞成分を標的の心筋細胞に送達し、心臓の修復をもたらすことを発見した。 彼らの研究成果は、2019年5月22日にScience Translational Medicineにオンラインで発表された。 この論文は「移植された前駆細胞由来の循環エクソソームが虚血性心筋の機能回復を助ける(Circulating Exosomes Derived from Transplanted Progenitor Cells Aid the Functional Recovery of Ischemic Myocardium.)」と題されている。
「エクソソームには由来する細胞のシグナルを含んでいる - タンパク質、核酸やマイクロリボ核酸(miRNA) - 受容体細胞に影響を及ぼし、我々が標的としている臓器を改変または再生する。」と共著者であるUMSOMの外科教授およびメリーランド大学小児病院の小児心臓外科のディレクターであるSunjay Kaushal博士は述べた。「我々は現在、心臓だけでなく、他の臓
ビーグル犬が97%の精度で患者血清から肺癌を嗅ぎ分けた
 レイク・エリー大学オステオパシー医学部の研究者らは、3匹のビーグル犬が肺癌を匂いで識別できることを明らかにした。これは、この病気特有のバイオマーカーを識別するための最初のステップだ。研究者らは、犬の能力が集団癌検診のための効果的で安全で安価な手段の開発につながるかもしれないと言う。
8週間の訓練の後、その優れた嗅覚受容体遺伝子で選択されたビーグル犬は、悪性肺癌患者から採取した血清サンプルと健常対照者を97%の精度で識別することができた。 この二重盲検法は2019年6月17日にThe Journal of the American Osteopathic Associationに掲載された。 このオープンアクセスの論文は、「犬の嗅覚による血中の非小細胞肺癌の検出精度(Accuracy of Canine Scent Detection of Non–Small Cell Lung Cancer in Blood Serum.)」と題されている。「我々は犬を使い、紛れもないバイオマーカーを特定するまで匂いの層を分類している」とレイク・エリー大学オステオパシー医学部の教授であり、この研究の主著者であるThomas Quinn博士は述べています。 「まだまだたくさんの仕事があるが、我々は良い進歩を遂げている。」犬を鼻の位置で血清サンプルを入れた部屋に導いた。 いくつかのサンプルは非小細胞肺癌の患者由来だ。 他のものは健常者のコントロールから採取した。 サンプルを徹底的に嗅いだ後、犬は癌の陽性所見を示すために座り、また何も検出されなかった場合は移動した。
Quinn博士と彼のチームは、この研究の2回目の再現に近づいている。 今回の犬は、患者がフェイスマスクで呼吸することによって収集された患者の呼吸のサンプルを使用し、肺癌、乳癌、および結腸直腸癌を識別するために働いた。調査結
レイク・エリー大学オステオパシー医学部の研究者らは、3匹のビーグル犬が肺癌を匂いで識別できることを明らかにした。これは、この病気特有のバイオマーカーを識別するための最初のステップだ。研究者らは、犬の能力が集団癌検診のための効果的で安全で安価な手段の開発につながるかもしれないと言う。
8週間の訓練の後、その優れた嗅覚受容体遺伝子で選択されたビーグル犬は、悪性肺癌患者から採取した血清サンプルと健常対照者を97%の精度で識別することができた。 この二重盲検法は2019年6月17日にThe Journal of the American Osteopathic Associationに掲載された。 このオープンアクセスの論文は、「犬の嗅覚による血中の非小細胞肺癌の検出精度(Accuracy of Canine Scent Detection of Non–Small Cell Lung Cancer in Blood Serum.)」と題されている。「我々は犬を使い、紛れもないバイオマーカーを特定するまで匂いの層を分類している」とレイク・エリー大学オステオパシー医学部の教授であり、この研究の主著者であるThomas Quinn博士は述べています。 「まだまだたくさんの仕事があるが、我々は良い進歩を遂げている。」犬を鼻の位置で血清サンプルを入れた部屋に導いた。 いくつかのサンプルは非小細胞肺癌の患者由来だ。 他のものは健常者のコントロールから採取した。 サンプルを徹底的に嗅いだ後、犬は癌の陽性所見を示すために座り、また何も検出されなかった場合は移動した。
Quinn博士と彼のチームは、この研究の2回目の再現に近づいている。 今回の犬は、患者がフェイスマスクで呼吸することによって収集された患者の呼吸のサンプルを使用し、肺癌、乳癌、および結腸直腸癌を識別するために働いた。調査結
バイオマーカー血液検査で高リスクの心臓病患者を識別できる可能性が報告された
 時折エンジンルームの中を覗かないと、車の修理が必要かどうかを予測することは困難だ。 同様に、予防心臓専門医は、現在治療を受けていない人の初期段階の心臓病を検出する方法を探している。 テキサス大学(UT)サウスウェスタンメディカルセンターの予防心臓病研究者は、タンパク質バイオマーカーの新しい血液検査でこれらの個人を特定できると考えている。 2019年11月11日にCirculationでオンラインで公開された彼らの新しい研究では、多民族の合計13,000人近くを含む3つの主要な患者集団からなる患者データを蓄積した。
研究チームは、2つのバイオマーカー(血中タンパク質)のレベルを測定することで、治療が必要な人を特定できるかどうかを調べた。 研究者は、現在治療に推奨されていない軽度の高血圧の成人の約3分の1が、これら2つのバイオマーカーのいずれかが僅かに上昇していることを発見した。 これらの個人は、今後10年間で心臓発作、脳卒中、またはうっ血性心不全を発症する可能性が高くなった。 言い換えれば、これらの患者は「レーダーの下を飛んで」おり、心血管イベントのリスクが高いことを知らない。このCirculationの論文は、「2017 ACC / AHA高血圧ガイドラインによるプールされたコホート分析による降圧薬の配分のためのリスク評価へのバイオマーカーの組み込み(Incorporation of Biomarkers Into Risk Assessment for Allocation of Antihypertensive Medication According to the 2017 ACC/AHA High Blood Pressure Guideline: A Pooled Cohort Analysis.)」と題されている。Ambarish Pandey博士(写真左)と
時折エンジンルームの中を覗かないと、車の修理が必要かどうかを予測することは困難だ。 同様に、予防心臓専門医は、現在治療を受けていない人の初期段階の心臓病を検出する方法を探している。 テキサス大学(UT)サウスウェスタンメディカルセンターの予防心臓病研究者は、タンパク質バイオマーカーの新しい血液検査でこれらの個人を特定できると考えている。 2019年11月11日にCirculationでオンラインで公開された彼らの新しい研究では、多民族の合計13,000人近くを含む3つの主要な患者集団からなる患者データを蓄積した。
研究チームは、2つのバイオマーカー(血中タンパク質)のレベルを測定することで、治療が必要な人を特定できるかどうかを調べた。 研究者は、現在治療に推奨されていない軽度の高血圧の成人の約3分の1が、これら2つのバイオマーカーのいずれかが僅かに上昇していることを発見した。 これらの個人は、今後10年間で心臓発作、脳卒中、またはうっ血性心不全を発症する可能性が高くなった。 言い換えれば、これらの患者は「レーダーの下を飛んで」おり、心血管イベントのリスクが高いことを知らない。このCirculationの論文は、「2017 ACC / AHA高血圧ガイドラインによるプールされたコホート分析による降圧薬の配分のためのリスク評価へのバイオマーカーの組み込み(Incorporation of Biomarkers Into Risk Assessment for Allocation of Antihypertensive Medication According to the 2017 ACC/AHA High Blood Pressure Guideline: A Pooled Cohort Analysis.)」と題されている。Ambarish Pandey博士(写真左)と
敗血症診断を5つのバイオマーカーで層別化する新しい高速血液アッセイの開発に成功
 敗血症の発見と治療は数十年に渡りほとんど進歩していないが、やっと前進するかもしれない。敗血症は身体全体に病原体感染の急増をもたらす致命的な医学的合併症だ。 シンシナティ小児病院医療センターの研究者は、5つのバイオマーカーを測定し、どの患者が敗血症(血液中毒とも呼ばれる)による死亡における低・中または高リスクであるかを正確に予測する新しい高速血液アッセイを開発し、テストが成功したことを報告している。
この研究の上級調査員でシンシナティ・チルドレンズのクリティカルケア医学部長である Hector Wong 博士(写真)によると、このPERSEVEREと呼ばれるこの新しい検査法により、医師は敗血症を早期に発見して層別化することができるという。どの5つのタンパク質/遺伝子がアッセイの血液パネルの5つのバイオマーカーを構成するかを知ることにより、医師ははるかに早く、より正確に医療介入を開始できる様になる。患者を低リスク、中リスク、高リスクのグループに階層化できるだけでなく、バイオマーカー検査により、医師は特定の患者に対して適切な介入を選択できる。Science Translational Medicine誌の2019年11月13日号に掲載されたこの論文は「小児敗血症バイオマーカーリスクモデルの前向き臨床試験と実験的検証(Prospective Clinical Testing and Experimental Validation of the Pediatric Sepsis Biomarker Risk Model.)」と題されている。
「PERSEVEREプラットフォームは、診断ではなく、層別化と予後診断に焦点を当てている」とWong博士は述べている。 「予後の改善は精密医療の基本ツールだ。個人の病気の経過と進行を予測し、異なるグループの患者や個人に合わせて治療を調整するこ
敗血症の発見と治療は数十年に渡りほとんど進歩していないが、やっと前進するかもしれない。敗血症は身体全体に病原体感染の急増をもたらす致命的な医学的合併症だ。 シンシナティ小児病院医療センターの研究者は、5つのバイオマーカーを測定し、どの患者が敗血症(血液中毒とも呼ばれる)による死亡における低・中または高リスクであるかを正確に予測する新しい高速血液アッセイを開発し、テストが成功したことを報告している。
この研究の上級調査員でシンシナティ・チルドレンズのクリティカルケア医学部長である Hector Wong 博士(写真)によると、このPERSEVEREと呼ばれるこの新しい検査法により、医師は敗血症を早期に発見して層別化することができるという。どの5つのタンパク質/遺伝子がアッセイの血液パネルの5つのバイオマーカーを構成するかを知ることにより、医師ははるかに早く、より正確に医療介入を開始できる様になる。患者を低リスク、中リスク、高リスクのグループに階層化できるだけでなく、バイオマーカー検査により、医師は特定の患者に対して適切な介入を選択できる。Science Translational Medicine誌の2019年11月13日号に掲載されたこの論文は「小児敗血症バイオマーカーリスクモデルの前向き臨床試験と実験的検証(Prospective Clinical Testing and Experimental Validation of the Pediatric Sepsis Biomarker Risk Model.)」と題されている。
「PERSEVEREプラットフォームは、診断ではなく、層別化と予後診断に焦点を当てている」とWong博士は述べている。 「予後の改善は精密医療の基本ツールだ。個人の病気の経過と進行を予測し、異なるグループの患者や個人に合わせて治療を調整するこ
COVID-19の重症度を予測し、適切な治療コースを指示する可能性のある27のタンパク質バイオマーカーを患者血液の質量分析で特定。
 英国のフランシスクリック研究所とシャリテー – ベルリン医科大学の研究者、および他機関の同僚は、 COVID-19 の患者が重症になる可能性が高いかどうかの予測に使用できる27のタンパク質バイオマーカーを特定した。COVID-19を引き起こすRNAウイルスであるSARS-CoV-2に感染した人々は、異なる反応を示す。 この病気は症状が出ない人もいれば、入院が必要な致命的な人もいる。この研究では、2020年6月1日にCell Systems誌でオンラインで公開され、COVID-19患者のさまざまな症状の重症度に応じた、27のバイオマーカー候補を発見したことが発表された。このバイオマーカーは、医師が患者の病気を予測し、科学者に医薬品開発の新しいターゲットを提供するのに役立つ。 このオープンアクセスCell Systemsの論文は「超ハイスループットの臨床プロテオミクスがCOVID-19感染の分類子を明らかにする(Ultra-High-Throughput Clinical Proteomics Reveals Classifiers of COVID-19 Infection.)」と題されている。
研究者らは、血漿中のさまざまなタンパク質の存在と量を迅速にテストするために、質量分析(MS)法を改良した。 このMSプラットフォームはフランシスクリック研究所で開発され、シャリテー – ベルリン医科大学で31人のCOVID-19患者の血清分析に適用された。 この結果は、同じ病院でCOVID-19の追加の17人の患者と15人の健康な人々でさらに検証された。 研究者らは、彼らの発見がCOVID-19患者のこれらのタンパク質の1つまたはいくつかのレベルをチェックするための簡単なルーチンテストの開発につながることを期待している。 このような検査の結果は、医師がどのような治療を行うかを
英国のフランシスクリック研究所とシャリテー – ベルリン医科大学の研究者、および他機関の同僚は、 COVID-19 の患者が重症になる可能性が高いかどうかの予測に使用できる27のタンパク質バイオマーカーを特定した。COVID-19を引き起こすRNAウイルスであるSARS-CoV-2に感染した人々は、異なる反応を示す。 この病気は症状が出ない人もいれば、入院が必要な致命的な人もいる。この研究では、2020年6月1日にCell Systems誌でオンラインで公開され、COVID-19患者のさまざまな症状の重症度に応じた、27のバイオマーカー候補を発見したことが発表された。このバイオマーカーは、医師が患者の病気を予測し、科学者に医薬品開発の新しいターゲットを提供するのに役立つ。 このオープンアクセスCell Systemsの論文は「超ハイスループットの臨床プロテオミクスがCOVID-19感染の分類子を明らかにする(Ultra-High-Throughput Clinical Proteomics Reveals Classifiers of COVID-19 Infection.)」と題されている。
研究者らは、血漿中のさまざまなタンパク質の存在と量を迅速にテストするために、質量分析(MS)法を改良した。 このMSプラットフォームはフランシスクリック研究所で開発され、シャリテー – ベルリン医科大学で31人のCOVID-19患者の血清分析に適用された。 この結果は、同じ病院でCOVID-19の追加の17人の患者と15人の健康な人々でさらに検証された。 研究者らは、彼らの発見がCOVID-19患者のこれらのタンパク質の1つまたはいくつかのレベルをチェックするための簡単なルーチンテストの開発につながることを期待している。 このような検査の結果は、医師がどのような治療を行うかを
香港の科学者が新型コロナウイルスのワクチン開発に光を当てる
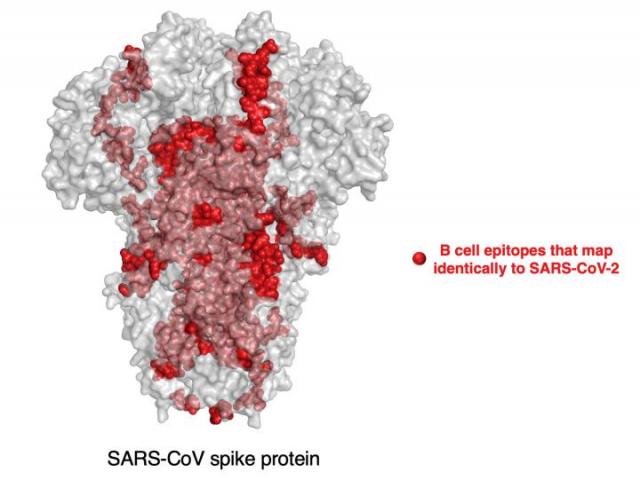 香港科学技術大学(HKUST)の科学者チームは最近、SARS-CoV-2コロナウイルスの潜在的なワクチンターゲットのセットを特定する重要な発見を行い、ウイルスによって引き起こされた新規肺炎(COVID-19)に対するワクチン開発に向けた実験的取り組みを導く重要なガイダンスを提供した。2003年にSARS(重症急性呼吸器症候群)の大流行を引き起こしたSARS-CoVと同様に、SARS-CoV-2は同じベータコロナウイルス属に属している。SARS-CoV-2とSARS-CoVの遺伝的類似性を検討することにより、チームは実験的に決定された免疫学的データを活用して、SARS-CoV-2に完全に一致するSARS-CoV由来B細胞およびT細胞エピトープのセットを特定した。 エピトープは、ウイルスに対するアクションをトリガーするために免疫系によって認識されるバイオマーカーだ。 利用可能なSARS-CoV-2遺伝子配列の中で同定されたエピトープに変異は観察されていないため、これらのエピトープの免疫ターゲティングは、新規肺炎COVID-19に対する防御に役立つ可能性がある。
データ科学者のMatthew McKay 教授とAhmed Abdul Quadeer 博士が率いるチームは、彼らの研究がSARS-CoV-2に対する効果的なワクチンの開発に向けた実験的研究を導く助けになると期待した。 McKay 教授は、HKUSTの電子コンピューター工学および化学および生物工学の学部の教授である。 Quadeer博士は、同じくHKUSTの電子コンピューター工学科のポスドク研究員だ。彼らの調査結果は、2020年2月25日にオープンアクセスジャーナルVirusesにオンラインで公開された。 この論文は、「SARS-CoV免疫学的研究に基づいたCOVID-19コロナウイルス(SARS-CoV-2)の潜在的
香港科学技術大学(HKUST)の科学者チームは最近、SARS-CoV-2コロナウイルスの潜在的なワクチンターゲットのセットを特定する重要な発見を行い、ウイルスによって引き起こされた新規肺炎(COVID-19)に対するワクチン開発に向けた実験的取り組みを導く重要なガイダンスを提供した。2003年にSARS(重症急性呼吸器症候群)の大流行を引き起こしたSARS-CoVと同様に、SARS-CoV-2は同じベータコロナウイルス属に属している。SARS-CoV-2とSARS-CoVの遺伝的類似性を検討することにより、チームは実験的に決定された免疫学的データを活用して、SARS-CoV-2に完全に一致するSARS-CoV由来B細胞およびT細胞エピトープのセットを特定した。 エピトープは、ウイルスに対するアクションをトリガーするために免疫系によって認識されるバイオマーカーだ。 利用可能なSARS-CoV-2遺伝子配列の中で同定されたエピトープに変異は観察されていないため、これらのエピトープの免疫ターゲティングは、新規肺炎COVID-19に対する防御に役立つ可能性がある。
データ科学者のMatthew McKay 教授とAhmed Abdul Quadeer 博士が率いるチームは、彼らの研究がSARS-CoV-2に対する効果的なワクチンの開発に向けた実験的研究を導く助けになると期待した。 McKay 教授は、HKUSTの電子コンピューター工学および化学および生物工学の学部の教授である。 Quadeer博士は、同じくHKUSTの電子コンピューター工学科のポスドク研究員だ。彼らの調査結果は、2020年2月25日にオープンアクセスジャーナルVirusesにオンラインで公開された。 この論文は、「SARS-CoV免疫学的研究に基づいたCOVID-19コロナウイルス(SARS-CoV-2)の潜在的
ミステリアスな房細胞の膵炎における役割が判明
 膵臓の持続性炎症(慢性膵炎)は、米国で3番目に致命的な癌である膵臓癌を発症する既知の危険因子だ。 房細胞(通常、腸や気道で見られる化学的変化に敏感な細胞)は以前に膵臓で発見されていたが、その機能はほとんど謎のままだった。現在、ソーク研究所のGeoffrey Wahl 博士、およびスタッフの科学者であるKathleen DelGiorno 博士が率いる研究チームは、膵炎のマウスモデルを用いて、膵炎における房細胞の形成と免疫における房細胞の驚くべき役割を明らかにした。2020年2月14日に Frontiers in Physiology のオンラインで公開された研究結果は、膵炎および膵臓癌をテストするための新しいバイオマーカーの開発につながる可能性がある。このオープンアクセス論文は、「タフト細胞の形成は膵臓損傷における上皮可塑性を反映する:ヒト膵炎のモデル化への影響(Tuft Cell Formation Reflects Epithelial Plasticity in Pancreatic Injury: Implications for Modeling Human Pancreatitis.)」と題されている。
「膵臓疾患のこれらの初期段階を理解することにより、我々の研究が膵炎と膵臓癌を早期に診断および治療するための新しい戦略の開発につながることを願っている」 とソークの遺伝子発現研究所の共著者であるWahl 博士は述べた。膵臓は、消化と血糖調節に役割を果たす腹部の臓器だ。 それでも、科学者は膵臓が膵炎などの損傷からどのように回復するか、または膵臓癌を撃退する方法についてほとんど知らない。 膵臓のほとんどは、消化酵素を生成および分泌する腺房細胞で構成されている。腺房細胞は、房細胞と呼ばれる別の種類の細胞に形質転換する能力も持っている。 科学者は房細胞のすべての機
膵臓の持続性炎症(慢性膵炎)は、米国で3番目に致命的な癌である膵臓癌を発症する既知の危険因子だ。 房細胞(通常、腸や気道で見られる化学的変化に敏感な細胞)は以前に膵臓で発見されていたが、その機能はほとんど謎のままだった。現在、ソーク研究所のGeoffrey Wahl 博士、およびスタッフの科学者であるKathleen DelGiorno 博士が率いる研究チームは、膵炎のマウスモデルを用いて、膵炎における房細胞の形成と免疫における房細胞の驚くべき役割を明らかにした。2020年2月14日に Frontiers in Physiology のオンラインで公開された研究結果は、膵炎および膵臓癌をテストするための新しいバイオマーカーの開発につながる可能性がある。このオープンアクセス論文は、「タフト細胞の形成は膵臓損傷における上皮可塑性を反映する:ヒト膵炎のモデル化への影響(Tuft Cell Formation Reflects Epithelial Plasticity in Pancreatic Injury: Implications for Modeling Human Pancreatitis.)」と題されている。
「膵臓疾患のこれらの初期段階を理解することにより、我々の研究が膵炎と膵臓癌を早期に診断および治療するための新しい戦略の開発につながることを願っている」 とソークの遺伝子発現研究所の共著者であるWahl 博士は述べた。膵臓は、消化と血糖調節に役割を果たす腹部の臓器だ。 それでも、科学者は膵臓が膵炎などの損傷からどのように回復するか、または膵臓癌を撃退する方法についてほとんど知らない。 膵臓のほとんどは、消化酵素を生成および分泌する腺房細胞で構成されている。腺房細胞は、房細胞と呼ばれる別の種類の細胞に形質転換する能力も持っている。 科学者は房細胞のすべての機
小児期の『歯』にALSのバイオマーカーがあることが発見された
 マウントサイナイ医科大学の研究者は、筋萎縮性側索硬化症(ALS)やルーゲーリック病と呼ばれる、退行性でしばしば致命的な神経疾患について、小児期に見られるバイオマーカーを同定したと2020年5月21日に米国科学誌「Annals of Clinical and Translational Neurology」のオンラインで発表した。このオープンアクセスの論文は、「筋萎縮性側索硬化症における早期生命金属異常調節(Early Life Metal Dysregulation in Amyotrophic Lateral Sclerosis.)」と題されている。
研究者らは、成人になってALSを発症した患者の「歯」にバイオマーカーを発見した。 彼らはレーザーを使用して毎日歯に形成される年輪をマッピングし、ALSの患者がそうでない患者と比べ、出生時および生後10年以内に異なる方法で金属を代謝したことを示す年輪の形成をエビデンスとして発見した。ALSは通常、50代または60代で発症することが多い。
原因は不明であり、発症を予測する検査もない。 遺伝子研究はまだ多くを明らかにしておらず、専門家が環境要因が病気の発症に重要な役割を果たすと信じていたが、どれがそうなのか明確な兆候もなかった。「これは、出生時および人生の最初の10年以内に、疾患の臨床的兆候または症状のかなり前に明確な兆候を示した最初の研究だ」と、筆頭著者であるマウントサイナイ医科大学のManish Arora博士は述べた。 「大規模な研究でこの作業を検証した後、長期的には、これが予防戦略につながることを願っている。 この研究のエキサイティングなところは、医薬品開発によって変更できるバイオロジカルパスウエイに目を向けていることだ。」この研究では、31人の対照群と比較して36人のALS患者において、亜鉛や銅、鉛やスズなどの毒素を
マウントサイナイ医科大学の研究者は、筋萎縮性側索硬化症(ALS)やルーゲーリック病と呼ばれる、退行性でしばしば致命的な神経疾患について、小児期に見られるバイオマーカーを同定したと2020年5月21日に米国科学誌「Annals of Clinical and Translational Neurology」のオンラインで発表した。このオープンアクセスの論文は、「筋萎縮性側索硬化症における早期生命金属異常調節(Early Life Metal Dysregulation in Amyotrophic Lateral Sclerosis.)」と題されている。
研究者らは、成人になってALSを発症した患者の「歯」にバイオマーカーを発見した。 彼らはレーザーを使用して毎日歯に形成される年輪をマッピングし、ALSの患者がそうでない患者と比べ、出生時および生後10年以内に異なる方法で金属を代謝したことを示す年輪の形成をエビデンスとして発見した。ALSは通常、50代または60代で発症することが多い。
原因は不明であり、発症を予測する検査もない。 遺伝子研究はまだ多くを明らかにしておらず、専門家が環境要因が病気の発症に重要な役割を果たすと信じていたが、どれがそうなのか明確な兆候もなかった。「これは、出生時および人生の最初の10年以内に、疾患の臨床的兆候または症状のかなり前に明確な兆候を示した最初の研究だ」と、筆頭著者であるマウントサイナイ医科大学のManish Arora博士は述べた。 「大規模な研究でこの作業を検証した後、長期的には、これが予防戦略につながることを願っている。 この研究のエキサイティングなところは、医薬品開発によって変更できるバイオロジカルパスウエイに目を向けていることだ。」この研究では、31人の対照群と比較して36人のALS患者において、亜鉛や銅、鉛やスズなどの毒素を
新研究で分娩にエクソソームが重要な役割を果たすことが示めされた
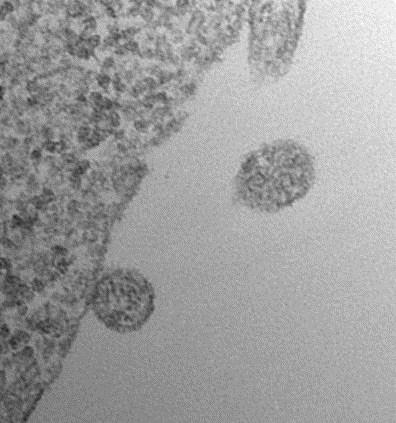 テキサス大学メディカルブランチ(UTMB)のRamkumar Menon博士が率いる研究者グループは、まだ確実ではないが分娩のタイミングにおけるキープレイヤーについて新たな洞察を見出した。この新しい情報によって、科学者たちは早産を防ぐことができるようになるかもしれない。
この研究は2019年1月24日にScientific Reportsにオンラインで発表された。 このオープンアクセスの論文は「 エクソソーム はマウスで早産を引き起こす:妊娠中の傍分泌シグナル伝達の証拠(Exosomes Cause Preterm Birth in Mice: Evidence for Paracrine Signaling in Pregnancy.)」と題されている。世界保健機関(WHO)によると、推定1500万人の乳児が毎年早すぎる時期に生まれている。早産による合併症は、5歳未満の子供の主な死亡原因であり、世界中で毎年約100万人が死亡している。米国では、2017年に乳児10人に約1人が早産している。女性が妊娠の終わりになると、胎児が出産のために十分成熟したことを知らせる化学物質が放出される。この化学物質の放出は母親のホルモンレベルをシフトさせ、それが子宮内の炎症を増やし、分娩と出産が始まる。
UTMBの准教授であり婦人科のMenon博士は、次のように述べている。「妊娠中にこのタイプのシグナル伝達が何をするのかについてはほとんど分かっていないので、分娩と出産のタイミングにおけるエクソソームによって運ばれる傍分泌(パラクリン)の役割を調べた。」研究者らは妊娠中のマウスから血漿サンプルを集め、エクソソームを単離した。 妊娠初期または妊娠後期のいずれかに収集されたエクソソームを、ヒトの妊娠第三期に相当する時期に、別の群の妊娠マウスに注射した。「我々は、高濃度の妊娠後期エクソソーム
テキサス大学メディカルブランチ(UTMB)のRamkumar Menon博士が率いる研究者グループは、まだ確実ではないが分娩のタイミングにおけるキープレイヤーについて新たな洞察を見出した。この新しい情報によって、科学者たちは早産を防ぐことができるようになるかもしれない。
この研究は2019年1月24日にScientific Reportsにオンラインで発表された。 このオープンアクセスの論文は「 エクソソーム はマウスで早産を引き起こす:妊娠中の傍分泌シグナル伝達の証拠(Exosomes Cause Preterm Birth in Mice: Evidence for Paracrine Signaling in Pregnancy.)」と題されている。世界保健機関(WHO)によると、推定1500万人の乳児が毎年早すぎる時期に生まれている。早産による合併症は、5歳未満の子供の主な死亡原因であり、世界中で毎年約100万人が死亡している。米国では、2017年に乳児10人に約1人が早産している。女性が妊娠の終わりになると、胎児が出産のために十分成熟したことを知らせる化学物質が放出される。この化学物質の放出は母親のホルモンレベルをシフトさせ、それが子宮内の炎症を増やし、分娩と出産が始まる。
UTMBの准教授であり婦人科のMenon博士は、次のように述べている。「妊娠中にこのタイプのシグナル伝達が何をするのかについてはほとんど分かっていないので、分娩と出産のタイミングにおけるエクソソームによって運ばれる傍分泌(パラクリン)の役割を調べた。」研究者らは妊娠中のマウスから血漿サンプルを集め、エクソソームを単離した。 妊娠初期または妊娠後期のいずれかに収集されたエクソソームを、ヒトの妊娠第三期に相当する時期に、別の群の妊娠マウスに注射した。「我々は、高濃度の妊娠後期エクソソーム
ASEMV2017でHarvard 大学の1年生が自身のエキソソーム研究を発表し注目の的に
 2017年10月9日、ASEMV(American Society for Exosomes and Microvesicles) 年次大会の2日目、Harvard Univesityの1年生、Indrani Dasさん (18) が自身のエキソソーム研究を発表し、200名の名声のある研究者達を釘付けにした。この研究にはRegeneron 2017 United States Science Talent Search Grand Prizeと賞金$250,000が贈られている。
この賞自体、高校上級生を対象とする科学数学のコンペティションとしてアメリカでもっとも歴史が古く、またもっとも栄誉とされる賞であり、過去にはWestinghouse社やIntel社もスポンサーを務めたことがある。写真は受賞当日のIndraniさん。 アシロマーでのIndraniさんのプレゼンテーションに対して研究者達は「素晴らしい」、「パワフル」、「信じられない」など最高級の賛辞を口にしている。彼女の受賞研究は、「Exosomal MicroRNA-124s: Novel Translational Reactive Astrocyte Repair in Vitro (エキソソーム由来のMicroRNA-124: 反応性アストロサイトの新しいトランスレーショナルなin vitro修復法)」と題されている。
当初、Indraniは神経変性疾患や脳外傷の治療に関心を持っていたが、その際にエキソソームと呼ばれる小胞が血液脳関門を通り抜けることとこの小胞で脳外傷の部位にまで医薬を運べる可能性を知り、高校で4年間にわたりエキソソームを研究するきっかけになった。また、脳卒中、脳外傷、アルツハイマー病、パーキンソン病などがいずれもグリア細胞の動きを極端に変化させること、特に反応性アストログリオーシスと
2017年10月9日、ASEMV(American Society for Exosomes and Microvesicles) 年次大会の2日目、Harvard Univesityの1年生、Indrani Dasさん (18) が自身のエキソソーム研究を発表し、200名の名声のある研究者達を釘付けにした。この研究にはRegeneron 2017 United States Science Talent Search Grand Prizeと賞金$250,000が贈られている。
この賞自体、高校上級生を対象とする科学数学のコンペティションとしてアメリカでもっとも歴史が古く、またもっとも栄誉とされる賞であり、過去にはWestinghouse社やIntel社もスポンサーを務めたことがある。写真は受賞当日のIndraniさん。 アシロマーでのIndraniさんのプレゼンテーションに対して研究者達は「素晴らしい」、「パワフル」、「信じられない」など最高級の賛辞を口にしている。彼女の受賞研究は、「Exosomal MicroRNA-124s: Novel Translational Reactive Astrocyte Repair in Vitro (エキソソーム由来のMicroRNA-124: 反応性アストロサイトの新しいトランスレーショナルなin vitro修復法)」と題されている。
当初、Indraniは神経変性疾患や脳外傷の治療に関心を持っていたが、その際にエキソソームと呼ばれる小胞が血液脳関門を通り抜けることとこの小胞で脳外傷の部位にまで医薬を運べる可能性を知り、高校で4年間にわたりエキソソームを研究するきっかけになった。また、脳卒中、脳外傷、アルツハイマー病、パーキンソン病などがいずれもグリア細胞の動きを極端に変化させること、特に反応性アストログリオーシスと
エキソソーム由来MicroRNAが多発性硬化症のパワフルなバイオマーカーになり得るとの新研究
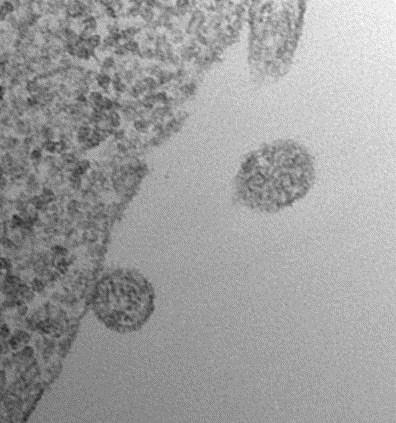 University of SydneyのBrain and Mind CentreとRoyal Prince Alfred Hospitalが中心となって行った画期的な研究で、多発性硬化症 (MS) の患者の血液中に疾患特有の物質が含まれていることを発見、若年成人の神経障害としてはもっとも一般的なこの疾患を確実に診断するバイオマーカーになるという結果を得た。2017年10月30日付Scientific Reportsオンライン版に掲載された研究論文は、簡単な血液検査だけで、「調節異常」のmicro-RNAの微小分子を発見し、それによってMSを正確に診断し、また患者の疾患の段階の違いも判定できたと記述している。
オープンアクセス論文として掲載されたこの論文は、「Exosomal MicroRNA Signatures in Multiple Sclerosis Reflect Disease Status (多発性硬化症固有のエキソソーム由来MicroRNAが疾患状態の指標に)」と題されている。現在のところ、MSを確実に発見する検査法はなく、疾患の診断と観察は、臨床診察、MRI、脳脊髄液検査、電気生理検査などに頼っている。MSは慢性疾患であり、しかも現行の診断、観察検査は金がかかる上に疾患の異なる段階を判定するにもその能力には限界がある。同研究チームは、健康人とMS患者を識別するバイオマーカーを発見しただけでなく、再発寛解型多発性硬化症 (RRMS) と進行型多発性硬化症という2種のMS亜型を判別する9種の固有なmicro-RNA分子を見つけている。MS患者の70%ほどが再発寛解型多発性硬化症 (RRMS) であり、これはしばしば二次進行型MSに発達することがある。MS患者の10%から15%は、発症当初から進行型と診断される一次性進行型MSである。研究チームはさらに研究の
University of SydneyのBrain and Mind CentreとRoyal Prince Alfred Hospitalが中心となって行った画期的な研究で、多発性硬化症 (MS) の患者の血液中に疾患特有の物質が含まれていることを発見、若年成人の神経障害としてはもっとも一般的なこの疾患を確実に診断するバイオマーカーになるという結果を得た。2017年10月30日付Scientific Reportsオンライン版に掲載された研究論文は、簡単な血液検査だけで、「調節異常」のmicro-RNAの微小分子を発見し、それによってMSを正確に診断し、また患者の疾患の段階の違いも判定できたと記述している。
オープンアクセス論文として掲載されたこの論文は、「Exosomal MicroRNA Signatures in Multiple Sclerosis Reflect Disease Status (多発性硬化症固有のエキソソーム由来MicroRNAが疾患状態の指標に)」と題されている。現在のところ、MSを確実に発見する検査法はなく、疾患の診断と観察は、臨床診察、MRI、脳脊髄液検査、電気生理検査などに頼っている。MSは慢性疾患であり、しかも現行の診断、観察検査は金がかかる上に疾患の異なる段階を判定するにもその能力には限界がある。同研究チームは、健康人とMS患者を識別するバイオマーカーを発見しただけでなく、再発寛解型多発性硬化症 (RRMS) と進行型多発性硬化症という2種のMS亜型を判別する9種の固有なmicro-RNA分子を見つけている。MS患者の70%ほどが再発寛解型多発性硬化症 (RRMS) であり、これはしばしば二次進行型MSに発達することがある。MS患者の10%から15%は、発症当初から進行型と診断される一次性進行型MSである。研究チームはさらに研究の
エキソソーム中のミトコンドリアDNAは抗ウイルス応答の前兆となる
 スペインのマドリッドにあるカルロス3世 国立循環器研究センター(CNIC)の研究者らは、ウイルスやバクテリアなどの病原体に早期に対応する免疫システムの防御機構に関する貴重な情報を提供している。2018年7月9日にネイチャーコミュニケーションズのオンラインで公開されたこの研究データは、免疫系の異なる細胞コンポーネントがどのようにして病原体に効果的な反応を起こすかを説明している。
CNICの研究者らは、ある種のナノベシクルに含まれるミトコンドリアDNAが、抗ウイルス遺伝子プログラムの活性化を引き起こすレセプター細胞に警戒状態を引き起こすと特定した。エキソソームとして知られるこれらのナノベシクルは、Tリンパ球によって産生され、細胞間接触を介して樹状細胞によって捕捉される。病原体に対する免疫応答は、Tリンパ球と抗原提示細胞、特に樹状細胞との間の特異的相互作用を必要とし、免疫シナプスとして知られるプロセスである。 この過程で、細胞表面に存在するレセプター結合とそのリガンド、およびエキソソームの移動の両方によって、細胞間情報が交換されることが、研究者らによって説明されている。今まで、免疫シナプス後のT細胞における活性化経路が研究されてきた。 しかしながら、受容されたシグナルの同一性および樹状細胞に対するそれらの機能的効果は、あまり注目されてこなかった。プリンセサ病院長、マドリード自治大学免疫学教授であるCNICの細胞間コミュニケーショングループのFrancisco Sánchez-Madridk教授は、以前、免疫シナプスの間にエキソソームを樹状細胞に転移させるT細胞の能力を述していた。この論文は、「抗原接触を介した活性化T細胞からのDNA含有細胞外ベシクルによる樹状細胞のプライミング(Priming of Dendritic Cells by DNA-Containing Extra
スペインのマドリッドにあるカルロス3世 国立循環器研究センター(CNIC)の研究者らは、ウイルスやバクテリアなどの病原体に早期に対応する免疫システムの防御機構に関する貴重な情報を提供している。2018年7月9日にネイチャーコミュニケーションズのオンラインで公開されたこの研究データは、免疫系の異なる細胞コンポーネントがどのようにして病原体に効果的な反応を起こすかを説明している。
CNICの研究者らは、ある種のナノベシクルに含まれるミトコンドリアDNAが、抗ウイルス遺伝子プログラムの活性化を引き起こすレセプター細胞に警戒状態を引き起こすと特定した。エキソソームとして知られるこれらのナノベシクルは、Tリンパ球によって産生され、細胞間接触を介して樹状細胞によって捕捉される。病原体に対する免疫応答は、Tリンパ球と抗原提示細胞、特に樹状細胞との間の特異的相互作用を必要とし、免疫シナプスとして知られるプロセスである。 この過程で、細胞表面に存在するレセプター結合とそのリガンド、およびエキソソームの移動の両方によって、細胞間情報が交換されることが、研究者らによって説明されている。今まで、免疫シナプス後のT細胞における活性化経路が研究されてきた。 しかしながら、受容されたシグナルの同一性および樹状細胞に対するそれらの機能的効果は、あまり注目されてこなかった。プリンセサ病院長、マドリード自治大学免疫学教授であるCNICの細胞間コミュニケーショングループのFrancisco Sánchez-Madridk教授は、以前、免疫シナプスの間にエキソソームを樹状細胞に転移させるT細胞の能力を述していた。この論文は、「抗原接触を介した活性化T細胞からのDNA含有細胞外ベシクルによる樹状細胞のプライミング(Priming of Dendritic Cells by DNA-Containing Extra
癌細胞は遠方から免疫システムにドローン(エキソソーム)を送り、免疫システムを抑制することが判明。
 癌細胞は、制御不能になっている細胞の塊ではない。 彼らは自分の生存のために免疫システムとの積極的な戦闘に参加する。免疫系を回避できることは癌の特徴である。 ペンシルベニア大学(Penn)の研究者によると、癌細胞は、血液中を循環する生物学的な"ドローン"であるエキソソームとPD-L1と呼ばれるタンパク質により、腫瘍に到達して戦いをする前にT細胞を疲弊させることを報告した。
2018年8月8日Natureに掲載されたこの研究は、School of Arts and Sciences生物学のWei Guo博士とPerelman School of Medicine病理学研究所のXiaowei Xu博士の共同研究である。主に転移性メラノーマに焦点を当てていたが、チームは乳癌と肺癌もPD-L1を持つエキソソームを放出することを発見した。この論文は、「Exosomal PD-L1は免疫抑制に寄与し、抗PD-1応答に関連する(Exosomal PD-L1 Contributes to Immunosuppression and Is Associated with Anti-PD-1 Response.)」と題されている。 この研究は、癌が免疫系を抑制するために全身的にどのようにアプローチするかについてのパラダイムシフトの絵を提供する。さらに、それはまた、腫瘍と戦うために免疫抑制を中断する抗PD1療法にどの癌患者が応答するかを予測する新たな方法を指し示し、その有効性を追跡する手段となる。「免疫療法は転移性メラノーマ患者の多くにとっての救命措置ですが、これらの患者の約70%が反応しません。」「これらの治療法は費用がかかり、毒性の副作用があるため、どの患者が反応するのかを知ることは非常に有益である。血流中のバイオマーカーを同定することで、どの患者が反応するかを早期に予測でき、 患者さんとそ
癌細胞は、制御不能になっている細胞の塊ではない。 彼らは自分の生存のために免疫システムとの積極的な戦闘に参加する。免疫系を回避できることは癌の特徴である。 ペンシルベニア大学(Penn)の研究者によると、癌細胞は、血液中を循環する生物学的な"ドローン"であるエキソソームとPD-L1と呼ばれるタンパク質により、腫瘍に到達して戦いをする前にT細胞を疲弊させることを報告した。
2018年8月8日Natureに掲載されたこの研究は、School of Arts and Sciences生物学のWei Guo博士とPerelman School of Medicine病理学研究所のXiaowei Xu博士の共同研究である。主に転移性メラノーマに焦点を当てていたが、チームは乳癌と肺癌もPD-L1を持つエキソソームを放出することを発見した。この論文は、「Exosomal PD-L1は免疫抑制に寄与し、抗PD-1応答に関連する(Exosomal PD-L1 Contributes to Immunosuppression and Is Associated with Anti-PD-1 Response.)」と題されている。 この研究は、癌が免疫系を抑制するために全身的にどのようにアプローチするかについてのパラダイムシフトの絵を提供する。さらに、それはまた、腫瘍と戦うために免疫抑制を中断する抗PD1療法にどの癌患者が応答するかを予測する新たな方法を指し示し、その有効性を追跡する手段となる。「免疫療法は転移性メラノーマ患者の多くにとっての救命措置ですが、これらの患者の約70%が反応しません。」「これらの治療法は費用がかかり、毒性の副作用があるため、どの患者が反応するのかを知ることは非常に有益である。血流中のバイオマーカーを同定することで、どの患者が反応するかを早期に予測でき、 患者さんとそ
鼻から侵入する細菌から気道を保護する仕組みが解明される。エクソソーム群は強力な抗菌化合物を作るため武装する。
 細菌は、私たちが呼吸するあらゆる空気の中に存在する。気道がこれらの細菌の感染からどのように保護されるのか、今まで謎のままだった。細菌を吸入すると、細菌を直接攻撃する細胞から直ちに エクソソーム が分泌され、鼻の前部から気道に沿って抗菌タンパク質を送り、細菌が体の奥に入る前に防御する。
マサチューセッツEye and Earの研究チームは、2018年11月12日にJournal of Allergy and Clinical Immunology(JACI)にオンラインで公開された論文でこの新メカニズムについて説明している。この発見は、私たちの免疫システムに新たな光をもたらし、また、ある細胞群から別の細胞群へのこの自然輸送過程を利用する薬物送達技術の開発に役立つ。この論文は、「エクソソーム群は気道病原体を排除し、酸化窒素を介して受動的な上皮免疫防御を提供する(Exosome Swarms Eliminate Airway Pathogens and Provide Passive Epithelial Immunoprotection Through Nitric Oxide.)」と題されている。「スズメバチの巣を蹴るのと同じように、鼻は数十億個のエクソソームを最初の細菌侵入の徴候で粘液に放出し、細菌を殺し、気道のいたるところで細胞を自然かつ強力に防御する」と、筆頭著者のマサチューセッツ Eye and Earの副鼻腔外科医、ハーバード大学医学部耳鼻咽喉科の准教授であるBenjamin S. Bleier医学博士は語った。「これは、エクソソーム集団が、細菌に対し気道をワクチン接種しているようなものだ。」このJACIの研究は、数年前にBleier博士の研究室が行なった発見が複雑だったため行うことになった。副鼻腔炎の研究では、研究者らは、鼻腔の細胞内のタンパク質が患者の鼻
細菌は、私たちが呼吸するあらゆる空気の中に存在する。気道がこれらの細菌の感染からどのように保護されるのか、今まで謎のままだった。細菌を吸入すると、細菌を直接攻撃する細胞から直ちに エクソソーム が分泌され、鼻の前部から気道に沿って抗菌タンパク質を送り、細菌が体の奥に入る前に防御する。
マサチューセッツEye and Earの研究チームは、2018年11月12日にJournal of Allergy and Clinical Immunology(JACI)にオンラインで公開された論文でこの新メカニズムについて説明している。この発見は、私たちの免疫システムに新たな光をもたらし、また、ある細胞群から別の細胞群へのこの自然輸送過程を利用する薬物送達技術の開発に役立つ。この論文は、「エクソソーム群は気道病原体を排除し、酸化窒素を介して受動的な上皮免疫防御を提供する(Exosome Swarms Eliminate Airway Pathogens and Provide Passive Epithelial Immunoprotection Through Nitric Oxide.)」と題されている。「スズメバチの巣を蹴るのと同じように、鼻は数十億個のエクソソームを最初の細菌侵入の徴候で粘液に放出し、細菌を殺し、気道のいたるところで細胞を自然かつ強力に防御する」と、筆頭著者のマサチューセッツ Eye and Earの副鼻腔外科医、ハーバード大学医学部耳鼻咽喉科の准教授であるBenjamin S. Bleier医学博士は語った。「これは、エクソソーム集団が、細菌に対し気道をワクチン接種しているようなものだ。」このJACIの研究は、数年前にBleier博士の研究室が行なった発見が複雑だったため行うことになった。副鼻腔炎の研究では、研究者らは、鼻腔の細胞内のタンパク質が患者の鼻
エクソソームがパーキンソン病の脳の特定領域にドーパミンを直接送達することがマウスでの研究で実証された
 2018年9月5日にParkinson's Disease Todayに掲載された研究コラムニストのAlice Melao氏の記事によれば、血液中を自然循環するエクソソームは脳を含む中枢神経系に効果的に薬を運搬することができ、マウスでの初期の研究ではパーキンソン病の影響を受けた脳の特定の領域にドーパミンを直接的に送達することができたことを示唆しているという。
中国の四川大学の研究者らによるこの論文は、「パーキンソン病のより良い治療のために脳にターゲティングされたドーパミン負荷血液エクソソーム(Dopamine-Loaded Blood Exosomes Targeted to Brain for Better Treatment of Parkinson’s Disease)」と題され、Journal of Controlled Releaseの2018年10月10日号に掲載された。パーキンソン病は、ドーパミンを産生する脳における神経細胞(ドーパミン作動性ニューロンと呼ばれる)の進行性変性および死によって特徴付けられる。 ドーパミンは、脳細胞の活性および機能を調節する重要なシグナル伝達分子である。Melao氏は、この病気の進歩的な性質を考えると、ドーパミン作動性ニューロンの死滅を防ぐ方法や、脳のドーパミンレベルを回復させる方法の研究に焦点を当てているという。しかし、主要な課題は、脳を保護する半透過性の膜である血液脳関門を越えて標的治療領域に到達する可能性のある治療薬を獲得することであった。四川大学の研究者らは、 エクソソーム をドーパミン輸送手段として使用する可能性について検討した。 チームはマウスの血液からエクソソームを単離して精製し、それらを容易に追跡できるように緑色の蛍光タグで標識した。 研究者らは、実験室で増殖させたマウス脳細胞でこれらのエクソソームを使用したとき
2018年9月5日にParkinson's Disease Todayに掲載された研究コラムニストのAlice Melao氏の記事によれば、血液中を自然循環するエクソソームは脳を含む中枢神経系に効果的に薬を運搬することができ、マウスでの初期の研究ではパーキンソン病の影響を受けた脳の特定の領域にドーパミンを直接的に送達することができたことを示唆しているという。
中国の四川大学の研究者らによるこの論文は、「パーキンソン病のより良い治療のために脳にターゲティングされたドーパミン負荷血液エクソソーム(Dopamine-Loaded Blood Exosomes Targeted to Brain for Better Treatment of Parkinson’s Disease)」と題され、Journal of Controlled Releaseの2018年10月10日号に掲載された。パーキンソン病は、ドーパミンを産生する脳における神経細胞(ドーパミン作動性ニューロンと呼ばれる)の進行性変性および死によって特徴付けられる。 ドーパミンは、脳細胞の活性および機能を調節する重要なシグナル伝達分子である。Melao氏は、この病気の進歩的な性質を考えると、ドーパミン作動性ニューロンの死滅を防ぐ方法や、脳のドーパミンレベルを回復させる方法の研究に焦点を当てているという。しかし、主要な課題は、脳を保護する半透過性の膜である血液脳関門を越えて標的治療領域に到達する可能性のある治療薬を獲得することであった。四川大学の研究者らは、 エクソソーム をドーパミン輸送手段として使用する可能性について検討した。 チームはマウスの血液からエクソソームを単離して精製し、それらを容易に追跡できるように緑色の蛍光タグで標識した。 研究者らは、実験室で増殖させたマウス脳細胞でこれらのエクソソームを使用したとき
ショウガ由来エクソソーム様ナノ粒子は腸内微生物叢に取り込まれ、病気の改善に効果があることが報告された
 Cell Host&Microbeに発表された研究において、ケンタッキー州のルイビル大学微生物免疫学部 James Graham Brown癌センターの研究者らは、植物由来 エクソソーム 様ナノ粒子(ELNs: exosome-like nanoparticles)が腸内微生物叢によって取り込まれ、マイクロバイオーム組成および宿主の生理機能を変化させるRNAを含むことをマウスで実証した。2018年11月14日号に掲載されたこの論文は「植物由来エクソソームMicroRNAが腸内微生物叢を形成する(Plant-Derived Exosomal MicroRNAs Shape the Gut Microbiota.)」と題されている。
著者らは、ショウガELN(GELN)について、GELN脂質依存的にラクトバチルス科によって優先的に取り込まれ、そしてラクトバチルスラムノサス(Lactobacillus rhamnosus,LGG)内の様々な遺伝子を標的とするマイクロRNA(miRNA)を含むことを示した。特に、著者らは、LGGモノオキシゲナーゼycnEのGELN mdo-miR7267-3p仲介ターゲティングがインドール-3-カルボキシアルデヒド(I 3 A)の増加をもたらすことに注目した。アリール炭化水素受容体のリガンドであるGELN-RNAまたはI 3Aは、バリア機能の改善に関連するIL-22の産生を誘導する。著者によれば、GELN-RNAのこれらの機能は、IL-22依存性メカニズムを介してマウス大腸炎を改善することができるとしており、植物製品とそのマイクロバイオームへの影響を利用して特定の宿主プロセスを標的にして病気を改善できると結論している。画像は論文の要旨から取得したものであり、要旨のページ(下のリンクから)で詳細を確認することができる。【BioQuick Ne
Cell Host&Microbeに発表された研究において、ケンタッキー州のルイビル大学微生物免疫学部 James Graham Brown癌センターの研究者らは、植物由来 エクソソーム 様ナノ粒子(ELNs: exosome-like nanoparticles)が腸内微生物叢によって取り込まれ、マイクロバイオーム組成および宿主の生理機能を変化させるRNAを含むことをマウスで実証した。2018年11月14日号に掲載されたこの論文は「植物由来エクソソームMicroRNAが腸内微生物叢を形成する(Plant-Derived Exosomal MicroRNAs Shape the Gut Microbiota.)」と題されている。
著者らは、ショウガELN(GELN)について、GELN脂質依存的にラクトバチルス科によって優先的に取り込まれ、そしてラクトバチルスラムノサス(Lactobacillus rhamnosus,LGG)内の様々な遺伝子を標的とするマイクロRNA(miRNA)を含むことを示した。特に、著者らは、LGGモノオキシゲナーゼycnEのGELN mdo-miR7267-3p仲介ターゲティングがインドール-3-カルボキシアルデヒド(I 3 A)の増加をもたらすことに注目した。アリール炭化水素受容体のリガンドであるGELN-RNAまたはI 3Aは、バリア機能の改善に関連するIL-22の産生を誘導する。著者によれば、GELN-RNAのこれらの機能は、IL-22依存性メカニズムを介してマウス大腸炎を改善することができるとしており、植物製品とそのマイクロバイオームへの影響を利用して特定の宿主プロセスを標的にして病気を改善できると結論している。画像は論文の要旨から取得したものであり、要旨のページ(下のリンクから)で詳細を確認することができる。【BioQuick Ne
化学療法は乳癌細胞から転移促進エキソソームの放出を刺激し、エクソソームはその内容物を肺に放出することがある。
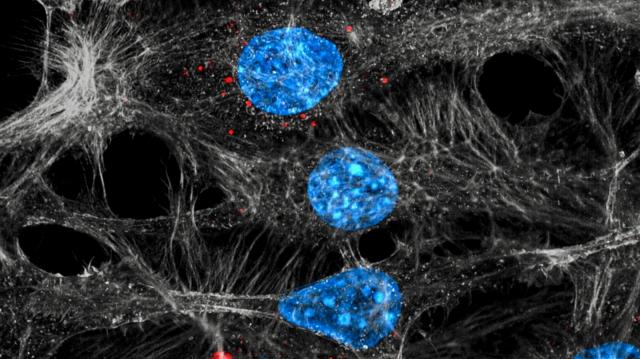 乳癌患者の中には、腫瘍が手術で取り除かれる前に化学療法を受ける人もいる。 ネオアジュバント療法と呼ばれるこのアプローチは、乳房温存手術を容易にするために腫瘍のサイズを縮小するのを助け、外科医が除去するための癌性細胞をほとんどまたは全く残さずに腫瘍を根絶することさえできる。 そのような場合、患者は手術後の生涯に渡り癌のないまま過ごせる可能性が高い。
しかし、すべての腫瘍が化学療法で縮小するわけではない。 腫瘍が術前療法に抵抗すると、転移性疾患を発症するリスクが高くなる可能性がある。これは、腫瘍が骨や肺などの他の臓器に再発することを意味している。化学療法に抵抗し、原発腫瘍を治療する間に他の臓器に広がる癌性細胞が原因の可能性がある。スイスのEPFL(Ecole Polytechnique FédéraleDe Lausann)のMichele De Palma博士が率いる国際研究者チームが、このプロセスに新たな光を投げかけている。 腫瘍モデルを用いて、研究者らは、患者に頻繁に使用される2つの化学療法薬、パクリタキセルとドキソルビシンが、乳腺腫瘍を誘発して エクソソーム を放出することを発見した。 化学療法の下では、エクソソームはタンパク質アネキシンA6を含み、これは未治療の腫瘍から放出されたエクソソームには存在しない。「アネキシンA6のエクソソームへのローディングは化学療法に反応して有意に増強されるようだ」と筆頭著者のIoanna Keklikoglou博士は説明する。エクソソームは化学療法治療を受けた腫瘍から放出された後、血中を循環する。 肺に到達すると、エクソソームはアネキシンA6を含むそれらの内容物を放出する。 これは肺細胞を刺激して、単球と呼ばれる免疫細胞を引き付ける別のタンパク質CCL2を放出させる。 単球が肺における癌性細胞の生存および増殖を促進する可能性があること
乳癌患者の中には、腫瘍が手術で取り除かれる前に化学療法を受ける人もいる。 ネオアジュバント療法と呼ばれるこのアプローチは、乳房温存手術を容易にするために腫瘍のサイズを縮小するのを助け、外科医が除去するための癌性細胞をほとんどまたは全く残さずに腫瘍を根絶することさえできる。 そのような場合、患者は手術後の生涯に渡り癌のないまま過ごせる可能性が高い。
しかし、すべての腫瘍が化学療法で縮小するわけではない。 腫瘍が術前療法に抵抗すると、転移性疾患を発症するリスクが高くなる可能性がある。これは、腫瘍が骨や肺などの他の臓器に再発することを意味している。化学療法に抵抗し、原発腫瘍を治療する間に他の臓器に広がる癌性細胞が原因の可能性がある。スイスのEPFL(Ecole Polytechnique FédéraleDe Lausann)のMichele De Palma博士が率いる国際研究者チームが、このプロセスに新たな光を投げかけている。 腫瘍モデルを用いて、研究者らは、患者に頻繁に使用される2つの化学療法薬、パクリタキセルとドキソルビシンが、乳腺腫瘍を誘発して エクソソーム を放出することを発見した。 化学療法の下では、エクソソームはタンパク質アネキシンA6を含み、これは未治療の腫瘍から放出されたエクソソームには存在しない。「アネキシンA6のエクソソームへのローディングは化学療法に反応して有意に増強されるようだ」と筆頭著者のIoanna Keklikoglou博士は説明する。エクソソームは化学療法治療を受けた腫瘍から放出された後、血中を循環する。 肺に到達すると、エクソソームはアネキシンA6を含むそれらの内容物を放出する。 これは肺細胞を刺激して、単球と呼ばれる免疫細胞を引き付ける別のタンパク質CCL2を放出させる。 単球が肺における癌性細胞の生存および増殖を促進する可能性があること
Nischarin発現細胞からのエキソソームは乳癌細胞の運動性と腫瘍増殖を減少させることが発見された。薬剤とNischarin発現エクソソームの併用で、優れた乳癌治療の可能性。
 米国ルイジアナ州立大学公衆衛生学(LSU Health)のSuresh K Alahari博士は、乳癌細胞の遊走や動きの制御など、さまざまな生物学的プロセスに関与する新規タンパク質、Nischarinを発見した。 彼の研究室は、Nischarinが腫瘍抑制因子として機能することを示した。この研究はより良い癌治療につながるかもしれない。
現在の研究で研究チームは エクソソーム 放出におけるNischarinの機能を調べた。 エクソソームは、タンパク質を含むナノサイズの小胞であり、生理学的および病理学的プロセスの両方に関与する遺伝的および他の物質を含む。腫瘍由来のエクソソームは、腫瘍の進行および癌の転移に関与する細胞間コミュニケーションのための様々なシグナル伝達メッセンジャーを含む。 腫瘍エクソソームは、腫瘍の微小環境内の様々な種類の細胞の相互作用に影響を及ぼし、腫瘍の発生、進行、および転移を制御する。 原発腫瘍はエクソソームを放出し、それが転移性癌細胞の播種および増殖を増強する。この新しい論文は、2019年1月11日にCancer Researchに掲載され「Nischarin発現細胞由来のエクソソームは乳癌細胞の運動性と腫瘍増殖を減少させる(Exosomes from Nischarin-Expressing Cells Reduce Breast Cancer Cell Motility and Tumor Growth)」と題されている。
この研究で、Nischarinは:・細胞接着を調節し、エクソソームの性質を変える。 ・Nischarin陽性細胞由来のエクソソームは、乳癌細胞の運動性および癒着、ならびに腫瘍体積を減少させる。 ・Nischarin陽性細胞はより少ないエクソソームを放出し、細胞生存は減少する。 ・乳癌細胞をNischarin陽性エクソソームと共培養
米国ルイジアナ州立大学公衆衛生学(LSU Health)のSuresh K Alahari博士は、乳癌細胞の遊走や動きの制御など、さまざまな生物学的プロセスに関与する新規タンパク質、Nischarinを発見した。 彼の研究室は、Nischarinが腫瘍抑制因子として機能することを示した。この研究はより良い癌治療につながるかもしれない。
現在の研究で研究チームは エクソソーム 放出におけるNischarinの機能を調べた。 エクソソームは、タンパク質を含むナノサイズの小胞であり、生理学的および病理学的プロセスの両方に関与する遺伝的および他の物質を含む。腫瘍由来のエクソソームは、腫瘍の進行および癌の転移に関与する細胞間コミュニケーションのための様々なシグナル伝達メッセンジャーを含む。 腫瘍エクソソームは、腫瘍の微小環境内の様々な種類の細胞の相互作用に影響を及ぼし、腫瘍の発生、進行、および転移を制御する。 原発腫瘍はエクソソームを放出し、それが転移性癌細胞の播種および増殖を増強する。この新しい論文は、2019年1月11日にCancer Researchに掲載され「Nischarin発現細胞由来のエクソソームは乳癌細胞の運動性と腫瘍増殖を減少させる(Exosomes from Nischarin-Expressing Cells Reduce Breast Cancer Cell Motility and Tumor Growth)」と題されている。
この研究で、Nischarinは:・細胞接着を調節し、エクソソームの性質を変える。 ・Nischarin陽性細胞由来のエクソソームは、乳癌細胞の運動性および癒着、ならびに腫瘍体積を減少させる。 ・Nischarin陽性細胞はより少ないエクソソームを放出し、細胞生存は減少する。 ・乳癌細胞をNischarin陽性エクソソームと共培養
循環エクソソームの超高感度検出が可能になる新装置をカンザス大学が発明
 カンザス大学、カンザス大学癌センター、およびKUメディカルセンターの研究者によって発明された新しい超高感度診断装置は、医師が血液または血漿の小滴から癌を迅速に検出することを可能にし、患者のためのより迅速な対処とより良い結果につながるだろう。この エクソソーム を検出するリキッドバイオプシー(liquid biopsy)分析のためのラボオンチップは、2019年2月25日にNature Biomedical Engineering誌にオンラインで報告された。エクソソームは、すべての細胞から放出されるが、特に癌細胞によって大量に産生される傾向がみられる。
この論文は「3Dナノパターンマイクロ流体チップを用いた循環エクソソームの超高感度検出(Ultrasensitive Detection of Circulating Exosomes with a 3D-Nanopatterned Microfluidic Chip.)」と題されている。
「歴史的に、エクソソームは細胞が不要な細胞内容物を捨てるために使用できるゴミ袋のようなものだと考えられていた。しかし過去10年間で、科学者たちは彼らがメッセージを受け手の細胞に送り、多くの生物学的機能において重要な分子情報を伝達するのに非常に有用であることを認識した。 基本的に、腫瘍はエクソソームを送り出して、親細胞の生物学的特徴を反映する活性分子を包含する。 すべての細胞がエクソソームを産生するが、腫瘍細胞は正常細胞と比較して実際に活性がある。」と、KUのDocking Family Scholarおよび化学准教授のYong Zeng博士は述べた。
この新しいラボオンチップの重要な技術革新は、自然界で一般的に見られるヘリンボーンパターンに基づいて生物学的要素を混合して感知し、「マス転送」と呼ばれるプロセスでエクソ
カンザス大学、カンザス大学癌センター、およびKUメディカルセンターの研究者によって発明された新しい超高感度診断装置は、医師が血液または血漿の小滴から癌を迅速に検出することを可能にし、患者のためのより迅速な対処とより良い結果につながるだろう。この エクソソーム を検出するリキッドバイオプシー(liquid biopsy)分析のためのラボオンチップは、2019年2月25日にNature Biomedical Engineering誌にオンラインで報告された。エクソソームは、すべての細胞から放出されるが、特に癌細胞によって大量に産生される傾向がみられる。
この論文は「3Dナノパターンマイクロ流体チップを用いた循環エクソソームの超高感度検出(Ultrasensitive Detection of Circulating Exosomes with a 3D-Nanopatterned Microfluidic Chip.)」と題されている。
「歴史的に、エクソソームは細胞が不要な細胞内容物を捨てるために使用できるゴミ袋のようなものだと考えられていた。しかし過去10年間で、科学者たちは彼らがメッセージを受け手の細胞に送り、多くの生物学的機能において重要な分子情報を伝達するのに非常に有用であることを認識した。 基本的に、腫瘍はエクソソームを送り出して、親細胞の生物学的特徴を反映する活性分子を包含する。 すべての細胞がエクソソームを産生するが、腫瘍細胞は正常細胞と比較して実際に活性がある。」と、KUのDocking Family Scholarおよび化学准教授のYong Zeng博士は述べた。
この新しいラボオンチップの重要な技術革新は、自然界で一般的に見られるヘリンボーンパターンに基づいて生物学的要素を混合して感知し、「マス転送」と呼ばれるプロセスでエクソ
免疫療法抵抗性腫瘍はリンパ節に移動して免疫細胞活性化を遠隔的に阻害するPD-L1が詰まったエクソソームを輸送することが発見された
 チェックポイント阻害剤として知られている免疫療法薬は癌の治療に革命をもたらした。最近まで治療不可能と考えられていた悪性腫瘍を持つ多くの患者が長期寛解を経験している。 しかし、多数の患者がこれらの薬には反応せず、特定の癌で他のものより遥かによく効くことに科学者は混乱してきた。現在、カリフォルニア大学サンフランシスコ校(UCSF)の研究者、およびカリフォルニア大学バークレー校の共同研究者は、なぜ多くの癌がこれらの薬に反応しないのかを説明する驚くべき現象を特定し、病気に対する免疫システムを解き放つ新しい戦略を示唆している。
2019年4月4日にCellのオンラインで発表されたこの論文は、「 エクソソーム PD-L1の抑制による全身性抗腫瘍免疫と記憶の誘導(Suppression of Exosomal PD-L1 Induces Systemic Anti-Tumor Immunity and Memory.)」と題されている。「黒色腫のような最善のシナリオでは、免疫チェックポイント阻害剤に反応する患者はわずか20〜30%だが、前立腺癌のように他のケースでは1桁の奏効率しかない。それは患者の大多数が反応していないことを意味する。 その理由を知りたかったのだ。」とRobert Blelloch博士(UCSFの泌尿器科教授および新研究の上級著者)は述べた。悪性組織では、PD-L1と呼ばれるタンパク質が「見えない外套」として機能する。PD-L1をその表面に提示することによって、癌細胞は免疫系による攻撃から身を守る。 最も成功している免疫療法のいくつかは、PD-L1または免疫細胞上に存在するその受容体、PD-1を妨害することによって作用する。PD-L1とPD-1との間の相互作用が遮断されると、腫瘍は免疫系から隠れるそれらの能力を失いそして抗癌免疫攻撃に対して脆弱になる。 いくつか
チェックポイント阻害剤として知られている免疫療法薬は癌の治療に革命をもたらした。最近まで治療不可能と考えられていた悪性腫瘍を持つ多くの患者が長期寛解を経験している。 しかし、多数の患者がこれらの薬には反応せず、特定の癌で他のものより遥かによく効くことに科学者は混乱してきた。現在、カリフォルニア大学サンフランシスコ校(UCSF)の研究者、およびカリフォルニア大学バークレー校の共同研究者は、なぜ多くの癌がこれらの薬に反応しないのかを説明する驚くべき現象を特定し、病気に対する免疫システムを解き放つ新しい戦略を示唆している。
2019年4月4日にCellのオンラインで発表されたこの論文は、「 エクソソーム PD-L1の抑制による全身性抗腫瘍免疫と記憶の誘導(Suppression of Exosomal PD-L1 Induces Systemic Anti-Tumor Immunity and Memory.)」と題されている。「黒色腫のような最善のシナリオでは、免疫チェックポイント阻害剤に反応する患者はわずか20〜30%だが、前立腺癌のように他のケースでは1桁の奏効率しかない。それは患者の大多数が反応していないことを意味する。 その理由を知りたかったのだ。」とRobert Blelloch博士(UCSFの泌尿器科教授および新研究の上級著者)は述べた。悪性組織では、PD-L1と呼ばれるタンパク質が「見えない外套」として機能する。PD-L1をその表面に提示することによって、癌細胞は免疫系による攻撃から身を守る。 最も成功している免疫療法のいくつかは、PD-L1または免疫細胞上に存在するその受容体、PD-1を妨害することによって作用する。PD-L1とPD-1との間の相互作用が遮断されると、腫瘍は免疫系から隠れるそれらの能力を失いそして抗癌免疫攻撃に対して脆弱になる。 いくつか
エクソソームが脳細胞と回路の形成に深い役割を果たし、発達性脳障害の治療と診断に寄与する可能性をスクリプス研究所が示唆。
 ジェット機の下から荷降ろしされるたくさん詰め込まれたスーツケースのように、 エクソソーム と呼ばれる生物学的小包は、体内のすべての細胞から継続的に展開され、これらを送り出すことによって細胞はタンパク質および遺伝物質を介して互いに通信をする。 単に細胞の「ゴミ」の微小な袋であると考えられていたエクソソームは、今や我々の健康にとって非常に重要なものであると理解されている。
近年の研究では、癌やアルツハイマー病などの神経変性疾患の蔓延に関連した分子を輸送することを示している。 しかし、最近まで、脳の発達におけるエクソソームの役割は謎のままだった。2019年7月22日にPNASのオンライン発表された新しい研究では、スクリプス研究所のHollis Cline博士(写真)と彼女の同僚は、エクソソームがニューロンや神経回路の発達に不可欠なだけではなく、発達障害の影響を受けた脳細胞の健康を回復することができることを示すことによって知識の溝を埋めようとしている。このオープンアクセスのPNASの論文は、「エクソソームは神経発生と回路構築を調節する(Exosomes Regulate Neurogenesis and Circuit Assembly.)」と題されている。「脳の発達のさまざまな段階において、細胞間のシグナル伝達が不可欠だ。我々は、エクソソームがこれらのシグナルを伝達する方法の1つであることを見出した。」と、スクリプス研究所の神経科学部門の共同議長であり、スクリプス研究所のDorris Neuroscience Centerのディレクターを務めるCline博士は語った。私たちの体は細胞内および細胞間で異なる物質を行き来させるために「ベシクル」と呼ばれる球形の容器を使用している。 エクソソームは、さまざまな生物学的積荷(脂質、タンパク質、RNA)を細胞間で輸送することを目的と
ジェット機の下から荷降ろしされるたくさん詰め込まれたスーツケースのように、 エクソソーム と呼ばれる生物学的小包は、体内のすべての細胞から継続的に展開され、これらを送り出すことによって細胞はタンパク質および遺伝物質を介して互いに通信をする。 単に細胞の「ゴミ」の微小な袋であると考えられていたエクソソームは、今や我々の健康にとって非常に重要なものであると理解されている。
近年の研究では、癌やアルツハイマー病などの神経変性疾患の蔓延に関連した分子を輸送することを示している。 しかし、最近まで、脳の発達におけるエクソソームの役割は謎のままだった。2019年7月22日にPNASのオンライン発表された新しい研究では、スクリプス研究所のHollis Cline博士(写真)と彼女の同僚は、エクソソームがニューロンや神経回路の発達に不可欠なだけではなく、発達障害の影響を受けた脳細胞の健康を回復することができることを示すことによって知識の溝を埋めようとしている。このオープンアクセスのPNASの論文は、「エクソソームは神経発生と回路構築を調節する(Exosomes Regulate Neurogenesis and Circuit Assembly.)」と題されている。「脳の発達のさまざまな段階において、細胞間のシグナル伝達が不可欠だ。我々は、エクソソームがこれらのシグナルを伝達する方法の1つであることを見出した。」と、スクリプス研究所の神経科学部門の共同議長であり、スクリプス研究所のDorris Neuroscience Centerのディレクターを務めるCline博士は語った。私たちの体は細胞内および細胞間で異なる物質を行き来させるために「ベシクル」と呼ばれる球形の容器を使用している。 エクソソームは、さまざまな生物学的積荷(脂質、タンパク質、RNA)を細胞間で輸送することを目的と
創傷治療治験中のペプチド変異体が、心臓発作の『バイスタンダー効果』による損傷を防御する可能性。研究グループはエクソソームによる防御ペプチドの送達を検討中。
 健康な心筋組織を保護することで損傷を減らす心臓発作の直後に服用できる薬があると想像して欲しい。 心臓発作が起きた場合、心臓の専門医は、「時は筋肉なり」と言うと、バージニア工科大学カリリオン心臓医療センター・フラリン生物医学研究所のディレクターであるRobert Gourdie博士(写真)は語った。
血流によって酸素が供給されないと、心臓細胞はすぐに死ぬ。 しかし、心臓発作は血液と酸素を心臓細胞の隔離された部分だけしか減らすことができず低酸素性虚血性傷害を引き起こすが、死にかけている細胞は隣の細胞に信号を送る。「問題は、死にかけている組織の領域は隔離されていないことだ。損傷した心臓細胞は健康な細胞に信号を送り始め、損傷はさらに大きくなる。」そうバージニア工科大学のGourdie博士(心臓再生医学研究、生物医学工学および機械学科の教授)は述べた。科学者は、この損傷信号が近くの健康な組織に広がることを「バイスタンダー効果」と呼ぶ。しかし、もし近くの心筋細胞が無傷のまま、低酸素性虚血性損傷によって直接影響を受けた細胞グループの損傷を局所化して維持する方法があったらどうだろうか?アメリカ心臓学会誌に2019年8月19日にオンラインで公開された研究では、Gourdie博士が率いる研究者チームによって開発された新しい分子が、心臓発作中およびその後でも心臓組織の維持に役立つことが明らかにされた。オープンアクセス論文は、「αカルボキシル末端1ペプチドとコネキシン43カルボキシル末端との相互作用は、虚血再灌流傷害後の左心室機能を維持する。(Interaction of α Carboxyl Terminus 1 Peptide with the Connexin 43 Carboxyl Terminus Preserves Left Ventricular Function After Is
健康な心筋組織を保護することで損傷を減らす心臓発作の直後に服用できる薬があると想像して欲しい。 心臓発作が起きた場合、心臓の専門医は、「時は筋肉なり」と言うと、バージニア工科大学カリリオン心臓医療センター・フラリン生物医学研究所のディレクターであるRobert Gourdie博士(写真)は語った。
血流によって酸素が供給されないと、心臓細胞はすぐに死ぬ。 しかし、心臓発作は血液と酸素を心臓細胞の隔離された部分だけしか減らすことができず低酸素性虚血性傷害を引き起こすが、死にかけている細胞は隣の細胞に信号を送る。「問題は、死にかけている組織の領域は隔離されていないことだ。損傷した心臓細胞は健康な細胞に信号を送り始め、損傷はさらに大きくなる。」そうバージニア工科大学のGourdie博士(心臓再生医学研究、生物医学工学および機械学科の教授)は述べた。科学者は、この損傷信号が近くの健康な組織に広がることを「バイスタンダー効果」と呼ぶ。しかし、もし近くの心筋細胞が無傷のまま、低酸素性虚血性損傷によって直接影響を受けた細胞グループの損傷を局所化して維持する方法があったらどうだろうか?アメリカ心臓学会誌に2019年8月19日にオンラインで公開された研究では、Gourdie博士が率いる研究者チームによって開発された新しい分子が、心臓発作中およびその後でも心臓組織の維持に役立つことが明らかにされた。オープンアクセス論文は、「αカルボキシル末端1ペプチドとコネキシン43カルボキシル末端との相互作用は、虚血再灌流傷害後の左心室機能を維持する。(Interaction of α Carboxyl Terminus 1 Peptide with the Connexin 43 Carboxyl Terminus Preserves Left Ventricular Function After Is
南カリフォルニアのHOAG 病院は、癌の遺伝的リスクが高い人の癌検出と管理の早期疾患マーカーとしてエクソソームを研究。
 カリフォルニア州オレンジ郡にある非営利の地域医療提供ネットワークのHoag Memorial Hospital Presbyterianは、癌診断、癌の進行、および治療抵抗性の初期疾患マーカーの可能性を特定および特徴付ける研究の開始を発表した。 Exosome Sciences社および、Aethlon Medical社の子会社との提携により、癌の遺伝的リスクが高い癌患者の エクソソーム 研究を開始する。
エクソソームは、癌細胞から豊富に放出されるナノ粒子であり、腫瘍の遺伝的およびタンパク質カーゴのスナップショットを提供できるため、癌の非侵襲的な液体生検の重要な標的となる。Hoag Memorial Hospital PresbyterianのPrecision Medicineのプログラムディレクターであり、Hoagの主任研究者であるMichael Demeure医学博士は、次のように述べている。「液体生検には、癌の早期発見と潜在的な治療の有効性の評価をリアルタイムで実施できる可能性がある。Hoagには、癌を発症するリスクの高い多数の個人および家族を支援する積極的な遺伝性がんプログラムがあり、癌の発見において可能な限り早期かつ最も治療可能な段階でのブレークスルーの達成に取り組んでいる。」
Exosome Sciences社およびAethlon Medical社のCEOであるTimothy Rodell医学博士は、次のように述べている。 「Hoagとのこのパートナーシップは、エクソソームベースの液体生検の開発を大幅に加速し、癌患者とその家族の発見、進行、治療オプションに関する深い洞察を提供する可能性がある。 このプロジェクトでDemeure 博士とHoagのチームが協力する機会を得たことを嬉しく思う。」 Hoagの遺伝性癌プログラムと癌研究の多くの面は、慈善活動によってサ
カリフォルニア州オレンジ郡にある非営利の地域医療提供ネットワークのHoag Memorial Hospital Presbyterianは、癌診断、癌の進行、および治療抵抗性の初期疾患マーカーの可能性を特定および特徴付ける研究の開始を発表した。 Exosome Sciences社および、Aethlon Medical社の子会社との提携により、癌の遺伝的リスクが高い癌患者の エクソソーム 研究を開始する。
エクソソームは、癌細胞から豊富に放出されるナノ粒子であり、腫瘍の遺伝的およびタンパク質カーゴのスナップショットを提供できるため、癌の非侵襲的な液体生検の重要な標的となる。Hoag Memorial Hospital PresbyterianのPrecision Medicineのプログラムディレクターであり、Hoagの主任研究者であるMichael Demeure医学博士は、次のように述べている。「液体生検には、癌の早期発見と潜在的な治療の有効性の評価をリアルタイムで実施できる可能性がある。Hoagには、癌を発症するリスクの高い多数の個人および家族を支援する積極的な遺伝性がんプログラムがあり、癌の発見において可能な限り早期かつ最も治療可能な段階でのブレークスルーの達成に取り組んでいる。」
Exosome Sciences社およびAethlon Medical社のCEOであるTimothy Rodell医学博士は、次のように述べている。 「Hoagとのこのパートナーシップは、エクソソームベースの液体生検の開発を大幅に加速し、癌患者とその家族の発見、進行、治療オプションに関する深い洞察を提供する可能性がある。 このプロジェクトでDemeure 博士とHoagのチームが協力する機会を得たことを嬉しく思う。」 Hoagの遺伝性癌プログラムと癌研究の多くの面は、慈善活動によってサ
ミトコンドリアDNA減少が乳がん転移の原因に
 以前から研究者は、侵襲性の強いタイプの乳がん患者のがん細胞にはミトコンドリアDNAが少ないという観察結果に注目していた。しかし、そのような特徴ががん進行にどのように影響するのかということについては誰にも分からなかった。最近になってようやく、University of Pennsylvaniaの研究チームが、ミトコンドリアDNAの減少で人間の乳がん細胞が侵襲性の強い転移性を獲得することを明らかにした。
2013年11月4日付オンライン版Oncogene誌に掲載されたこの研究論文は、なぜ一部のがんは他のがんに比べて進行も広がりも速いのかという疑問を解明する新しい手がかりを与えており、臨床医にとっては特に侵襲性の強いがんの患者を特定するバイオマーカーとして利用でき、治療法の個人化を進める上で役立つと考えられる。この研究は、Penn School of Veterinary Medicineの主任研究員、Dr. Manti Guhaと、Department of Animal BiologyのHarriet Ellison Woodward Professor of Biochemistryを務めるDr. Narayan Avadhaniが指導して進められた。
また、共同研究者として、Penn VetのDr. Satish Srinivasan、Dr. Gordon Ruthel、Dr. Anna K. Kashina、Dr. Thomas Van Winkleが参加しており、その他にもUniversity of Pennsylvania, Perelman School of MedicineのDr. Russ P. Carstens、National Cancer InstituteのDr. Arnulfo Mendoza、Dr. Chand Khannaらが加わって
以前から研究者は、侵襲性の強いタイプの乳がん患者のがん細胞にはミトコンドリアDNAが少ないという観察結果に注目していた。しかし、そのような特徴ががん進行にどのように影響するのかということについては誰にも分からなかった。最近になってようやく、University of Pennsylvaniaの研究チームが、ミトコンドリアDNAの減少で人間の乳がん細胞が侵襲性の強い転移性を獲得することを明らかにした。
2013年11月4日付オンライン版Oncogene誌に掲載されたこの研究論文は、なぜ一部のがんは他のがんに比べて進行も広がりも速いのかという疑問を解明する新しい手がかりを与えており、臨床医にとっては特に侵襲性の強いがんの患者を特定するバイオマーカーとして利用でき、治療法の個人化を進める上で役立つと考えられる。この研究は、Penn School of Veterinary Medicineの主任研究員、Dr. Manti Guhaと、Department of Animal BiologyのHarriet Ellison Woodward Professor of Biochemistryを務めるDr. Narayan Avadhaniが指導して進められた。
また、共同研究者として、Penn VetのDr. Satish Srinivasan、Dr. Gordon Ruthel、Dr. Anna K. Kashina、Dr. Thomas Van Winkleが参加しており、その他にもUniversity of Pennsylvania, Perelman School of MedicineのDr. Russ P. Carstens、National Cancer InstituteのDr. Arnulfo Mendoza、Dr. Chand Khannaらが加わって
樹状細胞由来のエクソソームが多発性硬化症の治療候補に - Neuroscience 2013
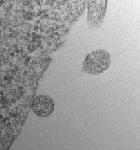 現在、多発性硬化症 (MS) の治療方法には髄鞘再形成を促進するようなタイプのものはない。しかし、2013年5月10日、サンディエゴで開かれていたSociety for Neuroscience 2013年総会において、取材に対して、University of Chicago Medicine, Director of the Migraine Headache ClinicでProfessor in Neurosciencesを務めるRichard Kraig, M.D., Ph.D.は、「血液中に存在する免疫細胞の一種、樹状細胞を骨髄から採取培養し、刺激を与えることで エクソソーム (画像参照) と呼ばれる小粒子を放出させることができる」と述べた。
このエクソソームを脳に送り込むと、エクソソームは髄鞘形成を著しく促進し、一方、MSなどによる脱髄的な損傷が起きているところでは髄鞘再形成を促した。MSは炎症性の疾患で、希突起膠細胞減少、脱髄、脳の損傷を受けた領域の髄鞘再形成不能などを伴う。中枢神経系の希突起膠細胞は、軸索を取り巻く絶縁体のミエリンを生成し、これは神経信号伝達に不可欠である。希突起膠細胞の損傷と、それに伴って起きるこのミエリンが消失する脱髄は重大な神経障害をもたらすことになる。
髄鞘再形成は、希突起膠細胞前駆細胞を損傷領域に集めることで自動的に始まる修復作業といえる。その後、前駆細胞が希突起膠細胞に分化し、消失したミエリンを補うことができるようになる。一般にMS患者は、初めのうち再発寛解という疾患経過をたどり、不完全な髄鞘再形成による部分的な回復を見せる。しかし、時間経過とともにこの修復能力が衰え、二次性進行型多発性硬化症に至り、疾患経過は着実に悪化していく。現在、アメリカ国内のMS患者は40万人を超えており、医療にとっても非常な重圧になっている。最
現在、多発性硬化症 (MS) の治療方法には髄鞘再形成を促進するようなタイプのものはない。しかし、2013年5月10日、サンディエゴで開かれていたSociety for Neuroscience 2013年総会において、取材に対して、University of Chicago Medicine, Director of the Migraine Headache ClinicでProfessor in Neurosciencesを務めるRichard Kraig, M.D., Ph.D.は、「血液中に存在する免疫細胞の一種、樹状細胞を骨髄から採取培養し、刺激を与えることで エクソソーム (画像参照) と呼ばれる小粒子を放出させることができる」と述べた。
このエクソソームを脳に送り込むと、エクソソームは髄鞘形成を著しく促進し、一方、MSなどによる脱髄的な損傷が起きているところでは髄鞘再形成を促した。MSは炎症性の疾患で、希突起膠細胞減少、脱髄、脳の損傷を受けた領域の髄鞘再形成不能などを伴う。中枢神経系の希突起膠細胞は、軸索を取り巻く絶縁体のミエリンを生成し、これは神経信号伝達に不可欠である。希突起膠細胞の損傷と、それに伴って起きるこのミエリンが消失する脱髄は重大な神経障害をもたらすことになる。
髄鞘再形成は、希突起膠細胞前駆細胞を損傷領域に集めることで自動的に始まる修復作業といえる。その後、前駆細胞が希突起膠細胞に分化し、消失したミエリンを補うことができるようになる。一般にMS患者は、初めのうち再発寛解という疾患経過をたどり、不完全な髄鞘再形成による部分的な回復を見せる。しかし、時間経過とともにこの修復能力が衰え、二次性進行型多発性硬化症に至り、疾患経過は着実に悪化していく。現在、アメリカ国内のMS患者は40万人を超えており、医療にとっても非常な重圧になっている。最
幹細胞から放出されたエクソソーム中の特定miRNAが卒中からの回復に関与
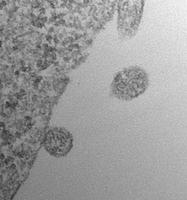 Henry Ford Hospitalの研究チームは、動物を使った新しい研究で、卒中発作後に幹細胞から放出される エクソソーム と呼ばれる微小な (50nm) 脂質性の細胞内器官に内包されるRNA (リボ核酸) 塩基配列のごく短いmicroRNAのうち、特定のものが神経的な回復に一役買っていることを突き止めた。研究チームのラットを用いた実験では、この特定のmicroRNAが幹細胞からエクソソームを使って脳細胞に送られ、卒中発作後の機能回復を強化していた。
この研究で、幹細胞が負傷した組織の再生に重要な役割を果たしていることが明らかになってきただけでなく、成人に長期的な障害を引き起こす卒中や神経疾患に新しい治療法を開発できる希望も生まれてきた。この研究論文は、2013年4月30日付オンライン版「Stem Cells」に掲載されている。卒中患者のほとんどは、手など一旦はマヒしていた体の各部分を自分の意思で使えるところまで回復するが、約半数の患者は体の片側が自由に動かない状態が続き、一生障害を抱えることになる人も大勢いる。現在のところ、卒中患者の運動機能を改善したり、回復する治療法はなく、その原因として脳や神経が損傷した後に自ら修復する機序が’まだ謎に包まれていることが挙げられる。この研究論文の首席著者、Henry Ford Neuroscience Instituteの科学部長、Department of Neurology at Henry Ford Hospitalのvice chairmanを務めるMichael Chopp, Ph.D.は、「この研究は、脳が、卒中その他の外傷を受けた後、自分自身を治療する能力があり、それに対して特定の幹細胞がそれぞれ異なる度合いで役割を果たしていることを証明し、これまで謎とされてきた問題の一つを解決に導いた可能性がある」と述べて
Henry Ford Hospitalの研究チームは、動物を使った新しい研究で、卒中発作後に幹細胞から放出される エクソソーム と呼ばれる微小な (50nm) 脂質性の細胞内器官に内包されるRNA (リボ核酸) 塩基配列のごく短いmicroRNAのうち、特定のものが神経的な回復に一役買っていることを突き止めた。研究チームのラットを用いた実験では、この特定のmicroRNAが幹細胞からエクソソームを使って脳細胞に送られ、卒中発作後の機能回復を強化していた。
この研究で、幹細胞が負傷した組織の再生に重要な役割を果たしていることが明らかになってきただけでなく、成人に長期的な障害を引き起こす卒中や神経疾患に新しい治療法を開発できる希望も生まれてきた。この研究論文は、2013年4月30日付オンライン版「Stem Cells」に掲載されている。卒中患者のほとんどは、手など一旦はマヒしていた体の各部分を自分の意思で使えるところまで回復するが、約半数の患者は体の片側が自由に動かない状態が続き、一生障害を抱えることになる人も大勢いる。現在のところ、卒中患者の運動機能を改善したり、回復する治療法はなく、その原因として脳や神経が損傷した後に自ら修復する機序が’まだ謎に包まれていることが挙げられる。この研究論文の首席著者、Henry Ford Neuroscience Instituteの科学部長、Department of Neurology at Henry Ford Hospitalのvice chairmanを務めるMichael Chopp, Ph.D.は、「この研究は、脳が、卒中その他の外傷を受けた後、自分自身を治療する能力があり、それに対して特定の幹細胞がそれぞれ異なる度合いで役割を果たしていることを証明し、これまで謎とされてきた問題の一つを解決に導いた可能性がある」と述べて
エクソソーム、ディープ・シーケンシング、バイオマーカーへの応用も
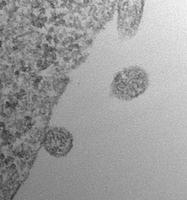 2013年4月17日から20日までボストンで開かれた年次恒例のInternational Society for Extracellular Vesicles (ISEV)において、アムステルダムのVU University Medical Center、Pathology Departmentの免疫学者、Michiel Pegtel, Ph.D.が、「包括的なディープ・シーケンシングで、特定のRNA小片が腫瘍の エクソソーム に組み込まれていることを突き止めた。この発見から、新しくバイオマーカーとして応用することも考えられる」と口頭発表した。エクソソーム (写真) は、細胞より小さな膜結合性の小胞 (直径30nmから150nm) で、様々なタイプの正常細胞からもがん細胞からも放出され、小胞内に膜タンパク質、細胞タンパク質、microRNA (miRNA)、その他、mRNA断片を含む様々なタイプのRNAを含んでおり、その内容はエクソソームを放出した細胞によって異なる。
このエクソソームは細胞間の情報運搬の役目を担っていると考えられている。たとえば、がん細胞から放出されたエクソソームには免疫系を抑制する物質が含まれており、血管新生を刺激し、それによって腫瘍増殖を促すことになる。
Dr. Pegtelは、BioQuickとのインタビューで、博士の研究においてはディープ・シーケンシングが重要な役割を果たしていることを強調し、「マイクロアレイやRT-PCRアレイなどのように閉じられたプロファイル技術とは対照的に、ディープ・シーケンシングは文字通り、人体のトランスクリプトームの複雑さについて我々の目を開かせてくれるものだ。私たちが以前に個別定量RT-PCRを用いて行った研究で、腫瘍ウイルスのエプスタイン・バー・ウイルス (EBV) に感染したヒトB細胞から放出されたエクソソ
2013年4月17日から20日までボストンで開かれた年次恒例のInternational Society for Extracellular Vesicles (ISEV)において、アムステルダムのVU University Medical Center、Pathology Departmentの免疫学者、Michiel Pegtel, Ph.D.が、「包括的なディープ・シーケンシングで、特定のRNA小片が腫瘍の エクソソーム に組み込まれていることを突き止めた。この発見から、新しくバイオマーカーとして応用することも考えられる」と口頭発表した。エクソソーム (写真) は、細胞より小さな膜結合性の小胞 (直径30nmから150nm) で、様々なタイプの正常細胞からもがん細胞からも放出され、小胞内に膜タンパク質、細胞タンパク質、microRNA (miRNA)、その他、mRNA断片を含む様々なタイプのRNAを含んでおり、その内容はエクソソームを放出した細胞によって異なる。
このエクソソームは細胞間の情報運搬の役目を担っていると考えられている。たとえば、がん細胞から放出されたエクソソームには免疫系を抑制する物質が含まれており、血管新生を刺激し、それによって腫瘍増殖を促すことになる。
Dr. Pegtelは、BioQuickとのインタビューで、博士の研究においてはディープ・シーケンシングが重要な役割を果たしていることを強調し、「マイクロアレイやRT-PCRアレイなどのように閉じられたプロファイル技術とは対照的に、ディープ・シーケンシングは文字通り、人体のトランスクリプトームの複雑さについて我々の目を開かせてくれるものだ。私たちが以前に個別定量RT-PCRを用いて行った研究で、腫瘍ウイルスのエプスタイン・バー・ウイルス (EBV) に感染したヒトB細胞から放出されたエクソソ
エクソソームは脳卒中の顕著な回復を促進する
 最初の脳卒中薬が承認されてからほぼ四半世紀が経つが、現在承認されている薬は1つだけだ。2019年12月6日にTranslational Stroke Researchで公開されたオープンアクセスの論文で、NIHの資金提供を受けた動物科学者は、重度の脳卒中の人に見られるのと同じ神経変性パターンでモデル化されたブタの完全な回復をサポートした新しい脳卒中治療の脳画像データを提示した。このオープンアクセスの論文は、「神経幹細胞の細胞外小胞がブタの虚血性脳卒中モデルにおける正中線シフトの予測結果を分裂させる。(Neural Stem Cell Extracellular Vesicles Disrupt Midline Shift Predictive Outcomes in Porcine Ischemic Stroke Model.) 」と題されている。
ジョージア大学(UGA)農業環境科学大学のブルックス特別教授で、ジョージア・リサーチ・アライアンスの著名な学者であるSteven Stice 博士は、次のように述べている。Stice博士はArunA Biomedical Inc.の最高科学責任者でもあり、UGAに入る前は、Advanced Cell Technologyの共同設立者であり、CSOとその会社のCEOを務めていた。 「恐らく最も奇なる発見は、 エクソソーム 治療後に回復することができたことだ。」Stice博士とUGAの再生バイオサイエンスセンター(RBC)の同僚は、脳が片側に押しやられている正中線シフト中の最初の観察証拠を報告し、低侵襲および非手術のエクソソーム治療が現在のところ重度の脳卒中による損傷を修復できることを示唆している。エクソソームは、腫瘍と隣接細胞の挙動を変えることができる長距離の細胞間コミュニケーションの強力なメディエーターであると考えられている。
最初の脳卒中薬が承認されてからほぼ四半世紀が経つが、現在承認されている薬は1つだけだ。2019年12月6日にTranslational Stroke Researchで公開されたオープンアクセスの論文で、NIHの資金提供を受けた動物科学者は、重度の脳卒中の人に見られるのと同じ神経変性パターンでモデル化されたブタの完全な回復をサポートした新しい脳卒中治療の脳画像データを提示した。このオープンアクセスの論文は、「神経幹細胞の細胞外小胞がブタの虚血性脳卒中モデルにおける正中線シフトの予測結果を分裂させる。(Neural Stem Cell Extracellular Vesicles Disrupt Midline Shift Predictive Outcomes in Porcine Ischemic Stroke Model.) 」と題されている。
ジョージア大学(UGA)農業環境科学大学のブルックス特別教授で、ジョージア・リサーチ・アライアンスの著名な学者であるSteven Stice 博士は、次のように述べている。Stice博士はArunA Biomedical Inc.の最高科学責任者でもあり、UGAに入る前は、Advanced Cell Technologyの共同設立者であり、CSOとその会社のCEOを務めていた。 「恐らく最も奇なる発見は、 エクソソーム 治療後に回復することができたことだ。」Stice博士とUGAの再生バイオサイエンスセンター(RBC)の同僚は、脳が片側に押しやられている正中線シフト中の最初の観察証拠を報告し、低侵襲および非手術のエクソソーム治療が現在のところ重度の脳卒中による損傷を修復できることを示唆している。エクソソームは、腫瘍と隣接細胞の挙動を変えることができる長距離の細胞間コミュニケーションの強力なメディエーターであると考えられている。
乳児の栄養および感染対策におけるミルクエクソソームサプリメントの利点について、ネブラスカ大学の専門家がコメントを発表
 世界牛乳の日(6月1日)に、米国農務省(USDA)は、ネブラスカ大学リンカーン校栄養健康科学部・分子栄養学のJanos Zempleni博士のコメントを発表した。Zempleni博士は乳児用調合乳に、牛乳からの小さく利益が豊富なナノ粒子( エクソソーム )を補うことの潜在的な利点について主張している。以下、Zempleni博士のコメントを紹介する。USDAの経済調査サービスのデータによると、米国では牛乳の平均年間消費量は1人あたり約64リットルである。牛乳は生後6か月までの乳児にとって唯一の栄養源であるため、子供のうち大部分は乳児が占めている。
牛乳にはもともと感染症に対抗する性質があるが、通常、市販の乳児用調製粉乳にはない。 USDAの国立食品農業研究所およびその他のスポンサーからの資金提供により、粉ミルクのサプリメントとして栄養を高め、感染を防ぐことができる可能性がある牛乳の要素を探ることができた。牛乳の栄養の重要性について尋ねると、カルシウムやビタミンDなどの栄養素が思い浮かぶかもしれない。 しかし、もっとある。私は2014年に牛乳に含まれる新しい生理活性化合物の探索を開始し、牛乳1液量オンスあたり「エクソソーム」と呼ばれる6兆もの天然ナノ粒子が含まれていることを発見した。牛乳を飲むと、ミルクエクソソームが体内に入り、さまざまなタンパク質、脂質、RNA、DNAを、肝臓、脳、胎盤、腸に届ける。
エクソソームとその内包物は魔法を働かせ、学習と記憶、免疫系、生殖などの重要な機能をサポートする。 牛乳を摂取したすべてのエクソソームが人間の組織に到達するわけではない。 「腸内細菌叢」と呼ばれる環境で腸内にとどまり、細菌と相互作用する人もいる。私の研究には、ミルクエクソソームと腸の微生物叢の相互作用の研究が含まれている。 私の調査結果は、ミルクエクソソームが細菌の遺伝子
世界牛乳の日(6月1日)に、米国農務省(USDA)は、ネブラスカ大学リンカーン校栄養健康科学部・分子栄養学のJanos Zempleni博士のコメントを発表した。Zempleni博士は乳児用調合乳に、牛乳からの小さく利益が豊富なナノ粒子( エクソソーム )を補うことの潜在的な利点について主張している。以下、Zempleni博士のコメントを紹介する。USDAの経済調査サービスのデータによると、米国では牛乳の平均年間消費量は1人あたり約64リットルである。牛乳は生後6か月までの乳児にとって唯一の栄養源であるため、子供のうち大部分は乳児が占めている。
牛乳にはもともと感染症に対抗する性質があるが、通常、市販の乳児用調製粉乳にはない。 USDAの国立食品農業研究所およびその他のスポンサーからの資金提供により、粉ミルクのサプリメントとして栄養を高め、感染を防ぐことができる可能性がある牛乳の要素を探ることができた。牛乳の栄養の重要性について尋ねると、カルシウムやビタミンDなどの栄養素が思い浮かぶかもしれない。 しかし、もっとある。私は2014年に牛乳に含まれる新しい生理活性化合物の探索を開始し、牛乳1液量オンスあたり「エクソソーム」と呼ばれる6兆もの天然ナノ粒子が含まれていることを発見した。牛乳を飲むと、ミルクエクソソームが体内に入り、さまざまなタンパク質、脂質、RNA、DNAを、肝臓、脳、胎盤、腸に届ける。
エクソソームとその内包物は魔法を働かせ、学習と記憶、免疫系、生殖などの重要な機能をサポートする。 牛乳を摂取したすべてのエクソソームが人間の組織に到達するわけではない。 「腸内細菌叢」と呼ばれる環境で腸内にとどまり、細菌と相互作用する人もいる。私の研究には、ミルクエクソソームと腸の微生物叢の相互作用の研究が含まれている。 私の調査結果は、ミルクエクソソームが細菌の遺伝子
Life Science News from Around the Globe
Edited by Michael D. O'Neill

バイオクイックニュースは、サイエンスライターとして30年以上の豊富な経験があるマイケルD. オニールによって発行されている独立系科学ニュースメディアです。世界中のバイオニュース(生命科学・医学研究の動向)をタイムリーにお届けします。バイオクイックニュースは、現在160カ国以上に読者がおり、2010年から6年連続で米国APEX Award for Publication Excellenceを受賞しました。
BioQuick is a trademark of Michael D. O'Neill